
図1
最近、ゲノム解析が世間の耳目を集めているが、それによって明らかにされる遺伝子情報と実際のタンパク質の構造や機能との間には依然大きな隔たりがある。タンパク質はDNA情報に基づいて翻訳された後、フォールディングや糖付加といった様々な修飾を受けて成熟していく。生命活動はこの成熟したタンパク質の働きによって支えられており、成熟過程(翻訳後修飾)の研究や、あるいはタンパク質間の相互作用の研究は、ポストゲノムの中心的課題になると思われる。これらの研究に利用される化合物は多いが、最近、従来のアプローチとは異なる新たな低分子化合物が報告されたので紹介したい。
バイオテクノロジーの分野では、組み換え遺伝子を発現させるのに大腸菌などの微生物が用いられる。しかしこれらの細胞では、遺伝情報が翻訳された後の修飾系が大きく異なるか欠けているため、ヒト DNA のような真核細胞の遺伝子を(例えば大腸菌で)発現させるときには、活性なタンパク質が生成しないばかりか、inclusion body と呼ばれる凝集体が沈殿したりする。
これらは、本来の細胞では小胞体(ER)内で折りたたまれて固有のコンフォメーションをとるべきものが、大腸菌ではその機構を備えていないためである。タンパク質が折りたたまれるのはシステイン残基のチオール基(-SH)同士が酸化的に結合してジスルフィド結合(-S-S-)を生成するためで、正しいジスルフィド結合はタンパク質の高次構造、すなわち活性に必須である。
特に、システイン残基の数が多い場合は誤った対を形成する確率も高くなり、正しく折りたたまれないことが多い。これは酵母を発現系とする場合でも同様であり、バイオテクノロジーの分野では長年の課題であった。一方で生体は、誤って形成されたジスルフィド結合を解き、正しい対を再形成するリフォールディング反応を触媒する酵素も備えている。ER に存在する 57 kDa のタンパク質である PDI(protein disulfide isomerase)がそれで、最近、この酵素の低分子ミミック(BMC、図1)が Raines1)らによって報告された。

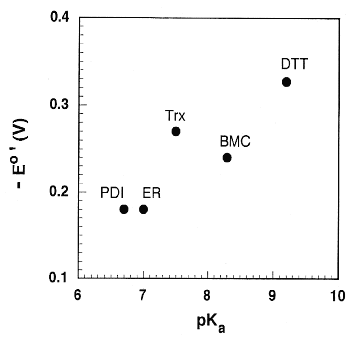
ER はタンパク質合成の中心に位置する細胞内器官で、新たに合成されたタンパク質はここで正しく折りたたまれた後、それぞれ機能を発揮する場所へ送られる。このため ER 内は、細胞質が還元的な環境であるのに対して、酸化的な環境になっており、ジスルフィド結合の生成が可能である(ジスルフィド結合の還元電位 E0'=−0.18 V)2)。BMC は PDI 同様、ER 内で誤って折りたたまれたタンパク質のリフォールディングを触媒すると考えられる(図2)。

この反応で重要なのは、BMC の還元電位と pKa 値である。
同じ低分子ジチオール化合物である DTT と比較して、BMC は大きな還元電位を有し、かつ、pKa=8.3(第一解離)と、DTT(pKa=9.2)3)よりも低いため、pH 7 の ER 内でも僅にチオレートアニオンが生成しており、より安定なコンフォメーションの native タンパク質へ異性化すると考えられる。因みに、ジスルフィド結合の還元電位と pKa の値を他の化合物と比較したものを図3に示している(図では、上に行くほど ER 内での存在比率が RSSR>RSH となり、また、右に行くほど RSH>RS−となる)。これからも分かるように PDI は ER の環境に非常に近く、異性化効率が良いことが窺える4),5)。同様に、低分子の BMC は酵素である PDI には及ばないが、DTT よりも ER の環境に近く、効率が良いことが分かる。BMC のアミド構造は pKaを引き下げる効果があり、さらに、分子が環化されてることによる立体的な歪みはジスルフィド結合生成には不利に働く筈である。もともとこの化合物は Fritzberg らによって 1985 年に腎機能検査のためのテクネチウム(99mTc)キレーターとして報告されているが6)、今回 Raines らによって全く新たな用途が見つけられたことになる。
BMC の生物学的な評価系として、in vitro の系で RNase 活性を、また、in vivo の系で酵母細胞からの組み換え酵素 S. pombe acid phosphatase の分泌量を測定している。前者は、ランダムにジスルフィド結合を生成した RNase(8個のシステイン残基をもつ)と、pH 7.6、30 ℃の条件で BMC をインキュベートし、酵素活性をモニターしている。コントロールと比較して、リフォールディングによる2倍の酵素活性の上昇が見られた。また、後者の系では酵母 S. cerevisiae の培養液に BMC(0.1 mg/ml)を加えたところ、コントロールの3倍以上の酵素の分泌が見られ、これは PDI を 15 倍量過剰発現させた場合に匹敵する量である。この結果は、BMC が膜を透過した後、酵母細胞の ER 内で外来性のタンパク質である S. pombe acid phosphatase のリフォールディングを触媒していることを示しており、実用的には重要である。
このように BMC は、培養系へ添加することによって組み換えタンパク質の発現量を向上させることができ、かつ低分子であるため安定、安価であり、大量に使用することも可能で、容易に系から除去することもできる。さらには、タンパク質のフォールディング異常によって引き起こされるヒトの遺伝的な疾病7)の治療薬としての可能性も秘めている。