相分離生物学の先へ
Beyond Phase-Separation Biology
 |
白木 賢太郎 筑波大学数理物質系 教授 |
Abstract
Liquid-liquid phase separation (LLPS) is currently a hot topic in cell biology. In this manuscript, I
first present the finding on several topics that led to the emergence of Phase-Separation Biology. The
relevance of LLPS to amyloid and anticancer drugs is an important issue for this area. Finally,
Protein-Solution Science will be introduced as a comprehensive view of the application of a protein
science for industry.
1. はじめに
タンパク質の液-液相分離に関して、はじめて講演したのは2018年夏のことだった。翌年にこの分野の概要を整理した『相分離生物学』を出版したが、この頃はたくさんの講演の機会をいただいた。当時は、いったいどういう仕組みでタンパク質が相分離するのか、凝集とは何が違うのか、界面はどのようになっているのか、細胞内で実測するにはどのような方法があるのかなど、初歩的な質問も多かった。それから5年が過ぎているが、この分野に興味を持つ研究者も増えてきている1)。タンパク質の機能を理解するためには、タンパク質の立体構造だけではなく、タンパク質の溶液状態を理解する必要がある、というコンセプトは今では共通認識になってきている。本稿では、相分離生物学の成り立ちと、これから期待される応用の可能性について整理してみたい。
2. 相分離生物学の原郷
相分離生物学の分野の歴史を辿ってみると、細胞の中の構造の研究に行き着くだろう。卵細胞の中にある核小体の研究であれば、すでに19世紀初頭には行われていたような古くからあるテーマである。一方、液-液相分離という現象は、水と油のような身近な例としても知られており、高分子の液-液相分離も1940年代には統計力学で厳密に議論できるようになっていた。だが、この両者が結び付けられたのは21世紀に入ってからのことであった。相分離生物学の原典となる成果に、マックス・プランク研究所のAnthony A. Hymanらが報告した2009年の論文がある2)。線虫の受精卵にはP顆粒があり、受精後に卵割が進むにつれて片側に集まることが知られていた。このような非対称性が生まれるのはなぜかというと、P顆粒が液体の性質を持つからだというのがこの論文での発見であった。すなわち、この非膜性構造体をドロプレットとみなし、細胞内に物理学の世界を改めて持ち込んだのがこの論文であった。この論文の第一著者であるClifford P. Brangwynneは、その後、プリンストン大学に研究室を持ち、この見方をさらに発展させている。
3. ATPはドロプレットを溶かす
Hymanらの研究グループは、この成果以外にも、相分離に関連する魅力的な仮説をいくつも提唱している。そのひとつに、『ATPは生物学的ハイドロトロープである』という2017年の論文がある3)。ハイドロトロープとは疎水性分子を溶かす物質という意味である。細胞内には数mMのATPがあるとされるが、ATPを「エネルギー通貨」として利用している酵素はATPと親和性が高いので、これだけ高濃度のATPは不要である。ではなぜ、細胞内には過剰量のATPがあるのだろうか?
この論文ではATPがFUSタンパク質のドロプレットを溶かすことが示されている。ATPの濃度が薄いときにはFUSはドロプレットを形成するが、10
mMのATPが含まれているとドロプレットを形成しないのである。つまり、ATPが細胞内にこれだけ高濃度あるのは、FUSのように液-液相分離しやすいタンパク質を分散した状態に保つために働いているのだというのが、この論文の主張である。
この結果から筋萎縮性側索硬化症の発症について次のように考察できるだろう4)。FUSタンパク質はアミロイドを形成し、筋萎縮性側索硬化症を発症するとされるタンパク質である。細胞内にATPが少ない場合、FUSはドロプレットを形成して濃縮された状態になり、アミロイドを形成しやすい。他方、細胞内にATPがたくさん含まれているとFUSはドロプレットを形成しないので、アミロイドにもなりにくいだろう。すなわち、FUSのドロプレットの形成を抑制することで、この疾患の発症を抑制できる可能性がある。
ATPの化学構造をあらためて見てみると、確かに疎水性の高い領域を構成する核酸塩基と、親水性の高い領域を構成するリン酸基とが糖を介してつながっていることがわかる。ミセルを形成するほど大きな疎水性領域は持っていないが、疎水性物質と相互作用して溶解度を上げる働きがあってもおかしくはない。こうして「タンパク質は液-液相分離する」ということを仮定して考えると、ATPのような著名な分子が細胞内の溶液環境でどのような影響をおよぼしているのかについて、新たな見え方をするのは興味深い。この論文を初めて読んだときのそのような印象を今もよく覚えており、その後、こういう見方を「相分離メガネをかける」などと称している1)。
4. 薬の効果を見直す
創薬は相分離生物学の時代によって見方が変わる分野である。研究が盛んに行われているテーマのひとつに、アミロイドと神経変性疾患の関係がある1)。アミロイドとはタンパク質が主鎖の分子間にできる水素結合によって安定化された線維状の凝集体で、アルツハイマー病やパーキンソン病、プリオン病などに関わるとされてきた。先述のFUSや、パーキンソン病の原因になるとされるα-シヌクレインなど5)、アミロイドの形成の途中にドロプレットを形成することが発見されてきていた。すなわち、アミロイドの途中にあるドロプレットが、創薬の新しいターゲットになるのである。
低分子の薬の効果も相分離の見方によって変わるだろう。もしレセプターがドロプレットを形成するならば、そのドロプレットへの薬の溶けやすさによって薬効が異なるからである。すなわち、ドロプレットによく溶けるなら少量の薬でも効果を発揮するが、溶けないのならいくらその薬を導入しても効果はない。このような見方による最初の報告として、リチャード・ヤングらの研究チームによる抗がん剤の研究がある6)。これまでに報告されている抗がん剤は、その種類によって、核内に何種類か存在しているドロプレットへの溶けやすさが異なるのである。すなわち、標的となるドロプレットによく溶けることが薬の効果を高めることにもなり、副作用を減らすことにもなるだろう。
5. タンパク質の液-液相分離を再現する
タンパク質の液-液相分離は、試験管で簡単に再現できる。ありふれたタンパク質を用いてデモンストレーションをしてみたい。卵白の主成分であるオボアルブミンと、リゾチームをおよそ1mg/ml程度の溶液を準備し、薄い緩衝液の中で混ぜると白濁した状態になる図1。これが現在、広く言われている「タンパク質の液-液相分離」の一種であり、白く濁ったものが「ドロプレット」と呼ばれるものである。ドロプレットは凝集体とは異なり溶媒を含み流動性があるので、この例のようにタンパク質分子が静電相互作用によって集まっているのであれば、塩水を加えるだけで透明な状態に戻る。水に溶けたイオンによる静電遮蔽効果によって、溶質が分散するからである。一方、ここで作らせたドロプレットは時間と共に少しずつ成熟する性質があり、白濁した状態で30分も置いておけば、同じ濃度の塩水を入れても溶けなくなる。つまり時間とともに疎水性相互作用が強まっていき、イオンでは溶けなくなるのである。要するに、分散したタンパク質を混ぜると液滴になり、時間とともに凝集体へと成熟するのである。
このような試験管内で簡単に再現できるような現象が、なぜ細胞内にあるタンパク質の働きと関連づけて理解されてこなかったのは不思議である。その理由のひとつとして、タンパク質は固有の構造を形成して働き、構造形成に役立たない天然変性領域には注意が向けられてこなかったことが考えられる。事実、ヒトのタンパク質の場合、30残基以上の天然変性領域を持つものは半数以上あると試算されており7)、この領域は液-液相分離を制御していると考えられるが、どういうアミノ酸配列を持つと相分離しやすいのかについては、ホットなテーマとなっている。現在では、アミノ酸配列と天然変性領域のほか、アミノ酸配列と相分離性を理解するためのデータベースの整理も進んできている。

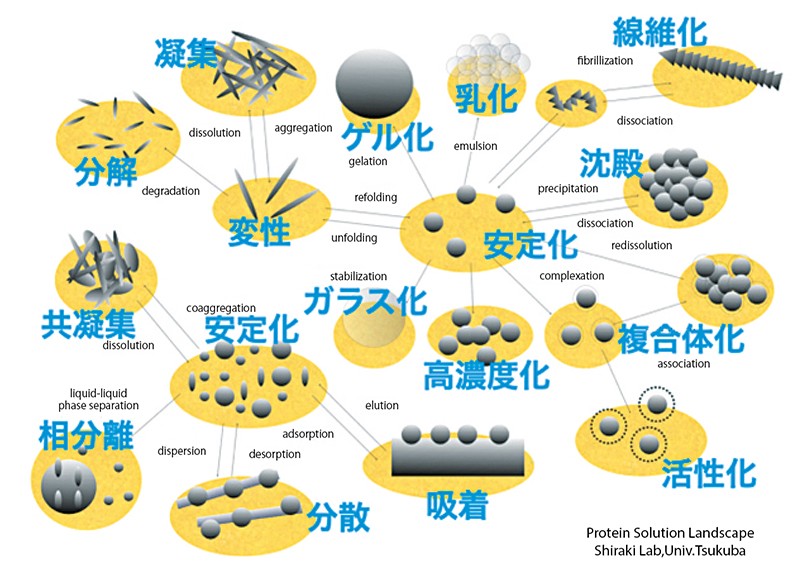
6.タンパク質は多様な状態を取る
タンパク質は固有の立体構造を形成して働くが、他方で多様な立体構造を形成し、多様な溶液状態を作り出す(図2)。先ほどの図1で示した結果のように、時間とともにタンパク質の立体構造が変化することもあるので、タンパク質の溶液状態は多様である。例えば、タンパク質の溶液を加熱すると凝集体ができる。しかし凝集といっても多様であり、濃縮すれば均質に全体が濁ったオパレッセンスと呼ばれる状態になるし、高濃度のタンパク質溶液を加熱すると分子間のネットワークができることでゲルになるし、低濃度のタンパク質溶液を加熱すると粒の揃った白濁した凝集体になる。他にも、油を含ませた溶液を混ぜるとタンパク質は構造変化して両親媒性の構造になって乳化剤にもなるし、空気を含めてふり混ぜると泡立つこともある。このような性質は食品加工の分野では積極的に使われることもあるし、バイオ医薬品の開発やタンパク質科学の基礎研究からは嫌がられる特徴にもなっている。
このようにタンパク質が多様な状態をとりうるのは、タンパク質の分子が構造変化し、水やイオン、他のタンパク質や溶質との相互作用が多様に変わるからである。つまり、タンパク質の一次配列を明らかにし、水溶液中で形成するネイティブ構造を明らかにしても、タンパク質の可能性の世界からはごく一部しか見ていないことになる。タンパク質を、分子そのものではなく、水分子を含めた「溶液系」としてとらえなおすとき、液-液相分離した状態もそのひとつとして研究者が意識するようになり、その見方によって相分離生物学という新しい分野が出てきたのである。
7.蛋白質溶液学へ
タンパク質の分子の研究は20世紀半ば以降、広く興味の持たれた分野である。現在では、分子生物学や生化学、酵素学、構造生物学などの分野として各国に学会があり、教科書が書かれている。一方、タンパク質溶液を研究対象とする分野は、不思議なことに確立してはいない。相分離生物学は、細胞内にあるタンパク質溶液を対象とした分野であり、ようやく2010年代後半になって意識されてくるようになったものである。ここでさらに一般的に見方を広げ、タンパク質の溶液状態の全体を扱う分野を、仮に蛋白質溶液学と名づけてみたい。タンパク質を原子レベルの分解能で観察し、物理量に還元して理解するのではなく、タンパク質集合物を現象論的に扱う分野である。
例えば、アルギニンは天然アミノ酸の一種であり、いわばありふれた分子である。しかし、アルギニンをタンパク質溶液に入れると、タンパク質の凝集が抑制できることが知られている8)。今ではアルギニン溶液は、タンパク質の精製や難溶性分子の分散剤など、さまざまな使い方がされてきている。これらの仕組みは全て同じように理解でき、少し専門的になるが、タンパク質などの分子間のπ-π相互作用をアルギニンが弱めることで、凝集をふせいだり、よく溶かしたりするということである。アルギニンの他に、静電相互作用や疎水性相互作用、水素結合などに影響をおよぼす多様な添加剤が開発され、凝集や相分離の制御に応用されてきている9)。
タンパク質の凝集や相分離は、産業に目を向けると広いテーマに関連している。例えば、私たちが関係している研究例だけでも、卵白の加熱凝集の抑制や10)、大豆タンパク質の乳化剤としての応用11)、食肉の溶解度の改良12)、高濃度の抗体溶液に見られる相分離の抑制13)、インスリン14)やポリグルタミン15)などのアミロイドの形成の制御、髪の毛のようなタンパク質の凝集抑制などの多様な課題がある16)。これらの課題を持つ業界は食品や医薬品、美容品などに及ぶが、全てタンパク質溶液という見方では共通している。ここでは、どのようにしてタンパク質の溶液状態が保たれているのかという理解と、どのようにすれば制御できるのかという技術の開発が期待されている。
このような多様なタンパク質の溶液状態のひとつが液-液相分離であり、細胞内にあるタンパク質の溶液状態の統一的な理解のために相分離生物学が誕生した。これを含めたタンパク質一般の見方が蛋白質溶液学になる。広くタンパク質の溶液状態を扱うためには解像度は低い方がよく、できるだけ多様な状態をつなげるような見方をすると価値がある。卵白を加熱したときのゲル化をふせぐ分子を、髪の毛の安定化に応用したり、その知見をアミロイドの形成の抑制につなげたりするなど、タンパク質溶液でつながる世界は広い。
これまで産学連携の共同研究をしてきた皆様と、研究室で一緒に研究してきた学生の皆様に感謝したい。
| [ 著者プロフィール ] | |
| 氏名 | 白木 賢太郎(Kentaro Shiraki) |
|---|---|
| 所属 |
筑波大学数理物質系 〒305-8573 茨城県つくば市天王台1-1-1 Tel:029-853-5306 |
| 出身学校 | 大阪大学 |
| 学位 | 博士(理学) |
| 専門分野 | 蛋白質溶液学、相分離生物学 |
| 現在の研究テーマ | タンパク質の凝集や分散の理解 |
| [ 出版物のご案内 ] | |
| 本総説の白木賢太郎先生の著書、「相分離生物学」は細胞内の液ー液相分離の成果を整理し、細胞生物学と分子生物学の間に生まれつつある新しい分野を紹介する書籍です。これからこの分野での研究を始める方ばかりでなく、生命科学分野の幅広い読者におすすめです。 | |
 |
相分離生物学 白木 賢太郎 著 東京化学同人 2019年8月2日発行 A5判 176ページ ISBN 978-4-8079-0965-0 |
|---|---|