p62 body を介する選択的オートファジーの分子機構と生理機能
Mechanism and functions of p62 body-mediated selective autophagy

高田 周平
順天堂大学大学院
医学研究科 器官・細胞生理学
博士課程 4 年

小松 雅明
順天堂大学大学院
医学研究科 器官・細胞生理学
主任教授

森下 英晃
九州大学大学院
医学研究院 生体機能学分野
教授
Abstract Selective autophagy can degrade not only membrane-bound organelles but also biomolecular condensates, including phase-separated p62/SQSTM1 body, but its molecular mechanisms and physiological relevance remain unclear. In this manuscript, we discuss the mechanism and role of p62 body-mediated selective autophagy. We further present our recent findings on the development of a purification method for phase-separated p62 bodies and the discovery of “vault-phagy”, a p62 body-mediated selective autophagy of the supramolecular vault complex.
1. はじめに
オートファジーはユビキチン・プロテアソーム系と並ぶ代表的な細胞内分解機構の一つであり、細胞内の成分をリソソームに輸送することでそれらを分解する仕組みである。オートファジーは基質の輸送経路の違いから、マクロオートファジー(オートファゴソームを介して基質をリソソーム内に輸送する)、ミクロオートファジー(リソソーム膜の陥入により基質をリソソーム内に輸送する)、シャペロン介在性オートファジー(リソソーム膜のトランスポーターを介して基質をリソソーム内に輸送する)の 3タイプに分類され、これらのうちマクロオートファジー(以後、単にオートファジーと呼ぶ)は最も研究が進んでいる。オートファジーが発見されたのは 1960 年前後であるが1)、その分子機構や生理機能は長らく不明であった。しかし、1990 年代の大隅良典博士らによる出芽酵母を用いたオートファジー関連遺伝子群の発見を端緒として、2000 年代にはオートファジー関連遺伝子欠損マウスを用いた生理機能解析が爆発的に進んだ結果、オートファジーは飢餓適応や細胞内品質管理に重要な役割を担うことが明らかになった2)。さらに、オートファジーは細胞内成分をランダムに分解するだけでなく、異常あるいは過剰な細胞内成分を選択的に分解する「選択的オートファジー」と呼ばれる重要な作用を有することも明らかになった。選択的オートファジーの基質選択性は、基質とオートファゴソーム関連因子の両者と結合するオートファジー受容体(autophagy receptor)によって担保されており、ミトコンドリア、小胞体、ペルオキシソーム、細胞内侵入性細菌、凝集体等の選択的基質に対応する様々なオートファジー受容体が存在する3)。本稿では、代表的な選択的基質であるポリユビキチン化タンパク質を含む p62 body を介する選択的オートファジーに焦点を絞り、その分子機構、意義、関連疾患について概説するとともに、最近筆者らが見出した p62 body を介する新たな選択的オートファジーの経路「ヴォルトファジー」4)についての知見も紹介する。
2. p62 body を介する選択的オートファジー
生理的条件下やストレス条件下では、液 - 液相分離(LLPS)によって p62 body 等の様々な生体分子凝縮体(biomolecular condensate)が形成され、それらの一部は選択的オートファジーによって分解される。以下では、p62 body を介する選択的オートファジーの分子機構、意義、関連疾患について概説する。
2.1 p62 body を介する選択的オートファジーの分子機構
p62 body はサイトゾルに形成されるユビキチン陽性の生体分子凝集体であり、その形成には p62 とユビキチン化タンパク質が必要である5, 6)。 p62 はマルチドメインタンパク質であり、N 末端の PB1(Phox and Bem1p)ドメインで p62 の別の分子と結合し自己オリゴマー化する一方で、LC3 相互作用領域(LIR)でオートファゴソーム上の Atg8 ファミリータンパク質と、LIR を含む天然変性領域でオートファゴソーム形成の最上流因子 FIP200 (FAK family kinase-interacting protein of 200 kDa)と7)、C 末端のユビキチン関連(UBA)ドメインでポリユビキチン化タンパク質と結合する(図1A)。p62 は PB1-PB1 相互作用を通して p62 フィラメントと呼ばれるらせん構造を形成する6)。オリゴマー化した p62 はポリユビキチン化タンパク質と相互作用することで液 - 液相分離し、p62 body を形成する(図1B)。 p62 body の形成には PB1 とUBA ドメインが必須である5)。
p62 body にはさらに NBR1(Next to BRCA1, gene 1)、TAX1BP1(Tax1-binding protein 1)等のオートファジー受容体が集積し、これらの受容体はさらに FIP200 等のオートファジー関連タンパク質をリクルートすることで8)、p62 body の表面においてオートファゴソーム形成を誘導する(図1B)。p62 とオートファゴソーム膜上の Atg8 ファミリータンパク質(LC3 や GABARAP ファミリー分子)との結合は、p62 body の表面とオートファゴソーム膜のウェッティング(wetting、濡れ現象)や膜伸長の方向の決定に必要である9, 10)。
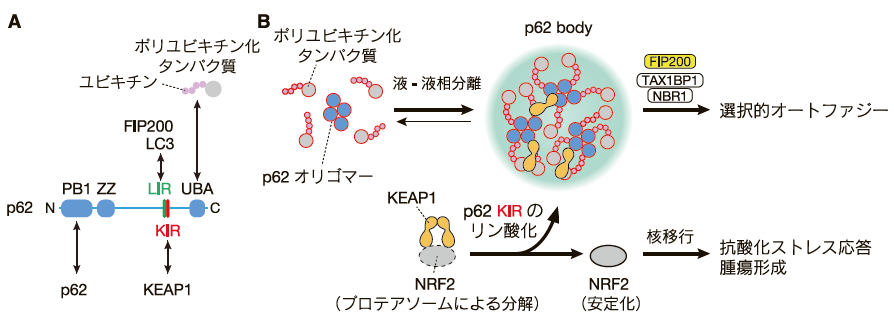
- A, p62 のドメイン構造とその主要な結合分子。PB1: Phox and Bem1p、ZZ: ZZ 型ジンクフィンガーモチーフ、UBA: ユビキチン関連(UBA)ドメイン、LIR: LC3 相互作用領域、KIR: KEAP1 相互作用領域。
- B, ポリユビキチン化タンパク質と p62 オリゴマーが結合すると液 - 液相分離が起こり、p62 body が形成される。p62、NBR1、TAX1BP1 などのオートファジー受容体は、FIP200 等のオートファジー関連因子群を p62 body 上にリクルートし、p62 body 表面におけるオートファゴソームの形成を誘導する。p62 body は、KEAP1 などのクライアントタンパク質とともに選択的オートファジーにより分解される。KEAP1 は定常状態では NRF2 と相互作用し、NRF2 をユビキチン化することで、プロテアソームによる NRF2 の分解を誘導する。p62 body が形成され、p62 の KIR がリン酸化されると、p62 と KEAP1 の相互作用が強化され、p62 は KEAP1 と NRF2 の結合を競合的に阻害する。その結果、NRF2 のユビキチン化の阻害、NRF2 の安定化、核内移行、抗酸化ストレス応答遺伝子発現が誘導される。
2.2 p62 body を介する選択的オートファジーの意義と関連疾患
p62 body を介する選択的オートファジーは、ポリユビキチン化タンパク質の効率的な分解だけでなく、p62 body を介するストレス応答の制御にも重要な役割を担っている 11-14)。例えば、Cullin 3 ユビキチン E3 リガーゼのアダプタータンパク質である KEAP1(Kelch-like ECH-associated protein 1)は、定常状態では抗酸化ストレス応答に重要な転写因子 NRF2(Nuclear factorerythroid 2-related factor 2)と相互作用し、NRF2 をユビキチン化することで、プロテアソームによる NRF2 の分解を誘導する(図1B)。一方、p62 body が形成され、p62 の KEAP1 結合領域(KIR)が p62 body の内部でリン酸化されると、p62 は KEAP1 と強く相互作用し、KEAP1 と NRF2 の結合を競合的に阻害する。その結果、KEAP1 による NRF2 のユビキチン化が阻害され、NRF2 の安定化、核内移行、抗酸化ストレス応答の活性化が引き起こされる11)。肝臓特異的にオートファジーを欠損させたマウスでは肝細胞内にリン酸化 p62 を多量に含む p62 body が形成され、それらの p62 body に KEAP1 が隔離される。その結果、NRF2 依存的な抗酸化ストレス応答が過剰に活性化し、肝障害、肝腫大、肝腫瘍形成等を引き起こす11-13)。
アルコール性脂肪性肝炎、非アルコール性脂肪性肝炎(NASH)、原発性胆汁性肝硬変、非アルコール性肝硬変、肝細胞がん等の患者の肝細胞内では、しばしばリン酸化された p62 やユビキチン化タンパク質を含むマロリーデンク体(Mallory-Denk body)と呼ばれる構造体が出現する15)。マロリーデンク体の形成、p62のリン酸化は、NRF2 の活性化、肝細胞がんの増殖に寄与している12)。さらに肝細胞がん前駆細胞における p62 の蓄積は、NRF2 の活性化だけでなく mTORC1-c-Myc 経路も活性化することで、肝細胞がんへの進展を促進する16)。したがって、マロリーデンク体は、腫瘍形成とがん化の両方の作用を有すると考えられる。しかし、マロリーデンク体の構成成分やそれらの分解の意義については未だにほとんど不明である。
3. p62 body 精製法の開発
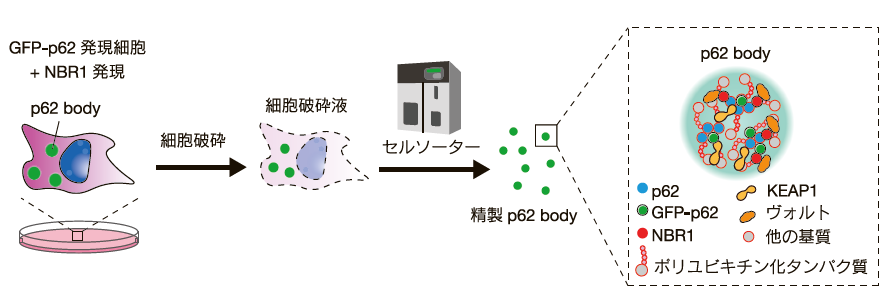
以上のように、近年、p62 body を介する選択的オートファジーの分子機構や意義についての理解は徐々に進んでいる一方で、p62 body の構成成分については未だにほとんど不明であり、p62 body の形成、分解の意義は分子レベルでは進んでいない。 この原因として、相分離により形成された p62 body は構造的に脆弱であるため、従来の免疫沈降法等の方法では p62 body を単離しその構成成分を解析することは非常に困難であったことが挙げられる。そこで我々は最近、P-body(Processing body)の精製方法17)を改良することで、セルソーターを用いて p62 bodyを効率的に精製可能な方法を開発した4)(図2)。この方法では、まず p62 body を豊富に有している細胞(例: ヒト肝細胞がん株 Huh-1)に GFP-p62 を低発現させ、p62 body を GFP 標識する(図2)。次に p62 body の流動性を低下させる作用を有する NBR118)(p62 と結合するオートファジー受容体)をアデノウイルスを用いて細胞に高発現させ、p62 body の数を増加させる。これらの細胞を低濃度の界面活性剤存在下で破砕し、セルソーターを用いて細胞破砕液から GFP 標識 p62 body を精製する(図2)。精製した p62 body は、蛍光顕微鏡観察、ウェスタンブロッティング、質量分析等の様々な解析に使用することができる4)。なお精製した p62 body の質量分析の結果、主要な p62 body 構成タンパク質(ユビキチン、p62、NBR1、TAX1BP1、KEAP1 等)の種類は NBR1 の過剰発現によって変動しなかったため、NBR1 の過剰発現は p62 body の構成成分の種類には大きな影響を与えないと考えられる4)。今回我々が開発した p62 body 精製法は、各種ストレスや疾患における p62 body の構成因子の同定とそれらの分解の意義、関連疾患の病態の理解に貢献できるものと考えられる。
4.p62 body を介する新たな選択的オートファジー経路“ヴォルトファジー”の発見
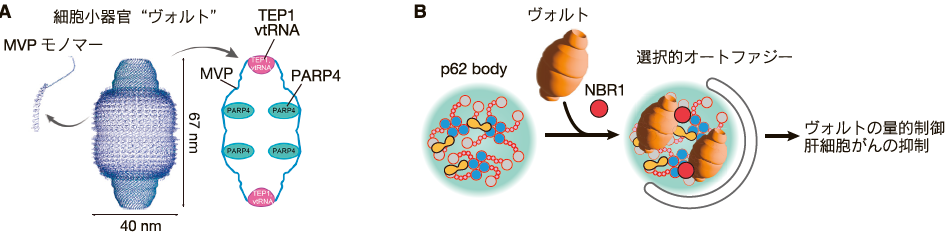
我々は p62 body を介する選択的オートファジーで分解される新規基質を同定するため、Huh-1 細胞から精製したp62 body の質量分析と、肝臓特異的選択的オートファジー阻害マウス9)の肝臓の質量分析を組み合わせた4)。その結果、p62 body に含まれ、かつ p62 body を介する選択的オートファジーによって分解される新規基質として、細胞小器官ヴォルト(vault)を同定することに成功した(図3)4)。以下では、p62 body を介する選択的オートファジーによるヴォルトの分解(「ヴォルトファジー」と命名4))の分子機構、意義、関連疾患について概説する。
4.1 細胞小器官「ヴォルト」
ヴォルトは 1986 年に発見された細胞小器官であり19)、高等真核生物に保存されており、様々な組織に存在している。ヴォルトはリボソームの3 倍の大きさを有する巨大なリボ核酸タンパク質複合体であり、ヴォルトの外殻は 78 分子の MVP (Major vault protein)から構成され、内部には PARP4 (Poly[ADP-Ribose]polymerase family member 4)、TEP1 (Telomerase associated protein 1)、およびノンコーディング RNA の vtRNA が存在している(図3A)。驚くべきことに発見から約 40 年経過した現在においても、ヴォルトの生理機能は未だにほとんど解明されていない。
4.2 ヴォルトは NBR1 依存的に p62 body に集積し、p62 body を介する選択的オートファジーより分解される
ヴォルトは Huh-1 細胞において恒常的に p62 body に局在しており、この局在は NBR1 を過剰発現した細胞で増強する一方で、NBR1 欠損細胞では消失し、ヴォルトの分解も阻害される4)。さらに肝臓特異的に NBR1 を欠損させたマウスの肝臓ではヴォルトの蓄積を認めることから、ヴォルトは NBR1 を介して p62 body に集積し分解されることが明らかになった4)(図3B)。さらにオートファジーに必須な FIP200 あるいは p62 を欠損させた細胞では、ヴォルトの蓄積を認め、p62 欠損細胞で認められたヴォルトの蓄積は p62 body を形成することができない変異体 p62 K7A/D69A ではレスキューされないことがわかった4)。したがって、ヴォルトは p62 body を介する選択的オートファジーによって恒常的に分解されていることが明らかになった。
4.3 ヴォルトは NBR1 の UBA ドメインと直接結合する
一般的にユビキチン結合ドメイン(UBA)を有する NBR1 等のオートファジー受容体は、その UBA ドメインを介してポリユビキチン化タンパク質と相互作用する。FLAG-NBR1 発現 Huh-1 細胞を用いて抗 FLAG 抗体で免疫沈降を行なったところ、ヴォルトの構成要素である MVP、PARP4、TEP1 を検出でき、この相互作用には NBR1 の UBA ドメインが必要かつ十分であった4)。次にユビキチン化が起こらない大腸菌で作製した MVP と NBR1 UBA のリコンビナントタンパク質を用いてプルダウンアッセイを行ったところ、MVP はユビキチン化されていないにも関わらず予想外にも NBR1 UBA によってプルダウンされ、この相互作用はユビキチンによって競合阻害された4)。したがって、MVP は NBR1 の UBA ドメインのユビキチン相互作用部位近傍とユビキチン化非依存的に相互作用できることが強く示唆された4)。さらに高速原子間力顕微鏡を用いた解析の結果、NBR1 の UBA ドメインはヴォルト粒子のショルダー領域と結合することが示唆された(図3)。さらに変異体解析の結果、ヴォルトのショルダー領域に相当する MVP のループ構造(607-623aa)が NBR1 の UBA ドメインとの相互作用することが、ヴォルトの分解に必要であることがわかった4)。
4.4 ヴォルトファジーの障害は非アルコール性脂肪肝炎由来肝細胞がんと関連する
我々はヴォルトファジーの意義を解析するため、p62 body のオートファジー分解が抑制されていることが複数のマウスモデルにおいて報告されている NASH 由来肝細胞がんに注目した16)。NASH 由来肝細胞がん患者の臨床検体(腫瘍部と非腫瘍部を採取)における MVP、p62、NBR1 をウェスタンブロッティング解析した結果、いずれのタンパク質も非腫瘍部と比べて腫瘍部において蓄積を認め、MVP の増加は p62 や NBR1 の増加と相関していた4)。さらに、NASH 由来肝細胞がんの腫瘍部において、MVP と NBR1 は p62 陽性マロリーデンク体と共局在することが明らかになった4)。これまでに、マウスモデルを用いた解析から MVP の増加は肝細胞がんを促進すること、ヒト肝細胞がん患者では MVP の量は肝細胞がんの悪性度、生存率低下と相関することが報告されている20)。したがって、p62 body の分解低下によるヴォルトファジーの障害が、ヒト NASH 由来肝細胞がんの発症に寄与している可能性が強く示唆された。
5. おわりに
本稿では、p62 body を介する選択的オートファジーの分子機構や意義に焦点を絞り、最近我々が発見したヴォルトファジーに関する知見も交えながら概説した。しかし、p62 body を介する選択的オートファジーには未だに多くの謎が残されている。例えば、p62 body 上に形成されるオートファゴソームの膜供給源は何か? p62 body の性状(リン酸化状態、流動性、表面張力等)はオートファゴソームの形成に影響するのか? p62 body 内部に存在するユビキチン化タンパク質の種類およびそれらのユビキチン化のメカニズム・意義は? 各種ストレスや加齢に応じて p62 body の構成成分はどのように変動するのか? ヴォルト以外の巨大超分子複合体や他の生体分子凝集体も p62 body に集積し分解されるのか? p62 body 分解の障害はどのような疾患と関連しているのか? 各臓器におけるヴォルトファジーの生理機能は何か? ヴォルトファジーの障害はどのようなメカニズムで肝細胞がんを促進するのか? といった多くの問いが未解決のまま残されている。また、p62 自身やp62 とユビキチン化タンパク質との相互作用を正に制御する TBK1(TANK-binding kinase 1)をコードする遺伝子への変異が筋萎縮性側索硬化症(ALS)において同定されており21)、p62 body と ALS との関連の理解も大きな課題である。今後これらの課題が解決されることで、選択的オートファジーについての包括的理解が進むことが期待される。
| [ 著者プロフィール ] | |
| 氏名 | 高田 周平(Shuhei Takada) |
|---|---|
| 所属 |
順天堂大学大学院医学研究科 器官・細胞生理学 博士課程4年 〒113-8421 東京都文京区本郷2丁目1番1号A棟8階 TEL 03-5802-1029 |
| 出身学校 | 東京理科大学 |
| 学位 | 博士課程(医学)在学中 |
| 専門分野 | 細胞生物学、分子生物学 |
| 現在の研究テーマ | 選択的オートファジー |
| [ 著者プロフィール ] | |
| 氏名 | 小松 雅明(Masaaki Komatsu) |
|---|---|
| 所属 |
順天堂大学大学院医学研究科 器官・細胞生理学 主任教授 〒113-8421 東京都文京区本郷2丁目1番1号A棟8階 TEL 03-5802-1029 |
| 出身学校 | 明治大学、順天堂大学 |
| 学位 | 博士(医学) |
| 専門分野 | 病態医化学、細胞生物学、分子生物学 |
| 現在の研究テーマ | 選択的オートファジー、UFM1 システム |
| [ 著者プロフィール ] | |
| 氏名 | 森下 英晃(Hideaki Morishita) |
|---|---|
| 所属 |
九州大学大学院医学研究院 生体機能学分野 教授 〒812-8582 福岡県福岡市東区馬出 3-1-1 生体機能学分野 TEL 092-642-6053 |
| 出身学校 | 九州大学、東京医科歯科大学 |
| 学位 | 博士(医学) |
| 専門分野 | 細胞生物学、発生生物学、医化学、分子生物学 |
| 現在の研究テーマ | 選択的オートファジー、大規模細胞内分解 |