次世代の分子認識素子「核酸アプタマー」の開発と今後の展望
Development and future prospects of nucleic acid aptamers, next generation elements for molecular recognition

北村 裕介
熊本大学
大学院先端科学研究部
助教
Abstract Overall, this review provides an introduction to nucleic acid aptamers for beginners interested in the fields of nucleic acid science and nucleic acid medicine. Although you can study the outlines for the selection and application of nucleic acid aptamers, for more further understanding, I recommend you to read other excellent reviews.
1. はじめに
新型コロナウイルス感染症のパンデミックにより mRNA ワクチンがスポットライトを浴びたことをきっかけとし、核酸科学、核酸医薬に対する関心が急速に高まっている。本総説は、これらの研究分野に対して新しく興味を持った初学者に対して、次世代の分子認識素子ともいわれる核酸アプタマーを紹介する入門書のようなものである。ここでは核酸アプタマーの取得法、応用例のアウトラインを述べるが、さらに詳しい知識を身につけるためには、他の多くの優れた総説などをお読み頂きたい1-4)。
2.核酸アプタマーとは
かつてかの有名なチャールズ・ダーウィンは、生物の進化に関して、環境により適合した形質を有する個体が優位に子孫を増やしてきたという自然選択理論を提唱した。時を経て現代、同理論は、試験管内の分子群から任意の機能を有する分子を進化的に取得する戦略(in vitro selection 法、もしくは試験管内分子進化法)の概念モデルとなっている。試験管内環境を一定の方向に変化させながら、適合する分子を淘汰的に選択するプロセスを繰り返すことで、分子群の中から特定の分子を見出す仕組みであり、基礎バイオ、臨床、創薬の領域で重宝される高機能性分子が次々と創出されている。
核酸アプタマーもまた、分子進化工学的に取得された分子認識素子である。一本鎖核酸(DNA および RNA)がフォールディングし、高次構造(ヘアピンループ、シュードノット、バルジ、グアニン四本鎖など)を形成することで、緻密な分子認識面を構築しており、標的(タンパク質、ペプチド、糖、脂質、小分子、金属イオンなど)と水素結合、静電相互作用、疎水性相互作用、π - πスタッキングおよびファンデルワールス力を介して特異的に結合する。一般的に核酸アプタマーは、SELEX(Systematic Evolution of Ligands by EXponential Enrichment)5-7)と呼ばれる手法を用い、ランダム配列領域を有するオリゴ核酸の大規模集団(ライブラリー)の中から、標的分子に対する結合親和性に基づき選択取得される。従って得られたアプタマーは標的に対して非常に高い親和性を有する(一般的に解離定数は nM から pM の範囲)。メチル基一つの違い8)や、アミノ酸の鏡像異性体9)も容易に識別可能なことが知られており、高い結合特異性を有している分子認識素子とも言えよう。これらの特性からモノクローナル抗体と比較されることが多い。抗体の製造には、細胞中における発現系を利用した複雑なプロセスを必要とする。対照的に、核酸アプタマーは化学合成による単純なプロセスで製造可能であり、バッチ間の変動が少なく、HPLC を用いることで、高純度に精製することも可能である。また、蛍光色素や反応性基の導入、非天然構造との置換も容易であり、機能の付与、機能の向上が可能な「化学抗体」とも呼ばれている。一度変性してもアニーリングにより容易に再生することは大きな利点であろう。また、サイズ的に抗体(10-15 nm)より小さい(~ 3 nm)こともあり、抗体がアクセスできないような込み入ったサイトを標的化できると考えられている。結合したアプタマーは、生理的条件下にて相補鎖を添加するだけでマイルドに解離可能な点もユニークである。免疫原性が最小限であり、臨床応用への期待値も高い。DNA アプタマーとRNA アプタマー間で特に強調して差別化されることはないが、RNA の方が分解されやすい点を考慮すると、細胞外から作用させる際には DNA アプタマーが有利な場合もあるかもしれない。一方、RNA アプタマーの場合、アプタマー配列をコードした発現プラスミドをトランスフェクションすることで、細胞内にて RNA アプタマーを生産可能な点が大きな強みであろう。
3. SELEX 法の概要
SELEX 法の概略図を図1に示す。ライブラリー核酸を標的分子とインキュベートし、結合した核酸のみを分離回収する。続いてこれを PCR で指数関数的に増幅させることで次世代のライブラリー核酸を作成することができる。RNA アプタマー取得時には、標的に結合した RNA を用いて逆転写反応を行った後、PCR を実施することで次世代のライブラリー核酸を得ることができる。一般的な手法ではアプタマー取得までに、この一連のプロセスを 10 ~ 15 回繰り返す必要がある。以下にて留意点等を詳細に説明したい。
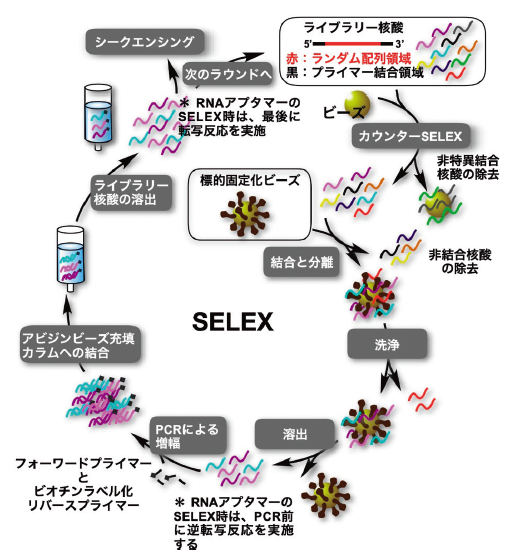
3.1 ライブラリー核酸の設計
良質なアプタマーが得られるかどうかは、ライブラリー核酸の設計時に決まってしまっていると言っても過言ではない。通常、ライブラリー核酸はランダム配列領域の両端がそれぞれ定常配列領域(プライマー結合領域)で挟まれた構造を有している。ランダム配列は核酸合成時に A、G、C、T/U のアミダイト試薬を混合し、合成することで得られる。ライブラリー核酸の多様性は、このランダム配列の長さに依存する。例えば、30 塩基長の場合、430(約 1018)種類の配列が含まれることとなるが、実験上現実的な物質量ではないため、1015 未満のスケールで実施されることが多い。
多様性の確保や複雑な分子認識面の担保のために、一様にランダム配列領域を長く設定すれば良いという話でもない。核酸合成時における 1 塩基のカップリング効率が約 99.5% の場合、全長 70 塩基長の核酸で合成収率が約 70%、100 塩基長の核酸で約 61% であり、長いアプタマーは製造コストにおける負担が大きくなる。抗体では標的化できない狭い空間を認識できるという長所も失われるかもしれない。また、ランダム配列領域が長くなる程プライマーが非特異的に同領域に結合するリスクを高めるため、結果として SELEX の失敗リスクを高めてしまう。一方、ランダム配列領域を短くすれば良いという訳でもない。Szostak らは、高親和的に結合するアプタマーとは自身で安定な分子内構造を形成するアプタマーであると結論づけている10)。ランダム配列領域が短すぎる場合、安定な構造を形成するとすれば、シングルヘアピンループ構造、バルジ構造、グアニン四本鎖構造等に限定されてくるため、構造の多様性を失っている可能性が高い。ランダム配列領域の長さは自由に選択可能であるが、様々な事情を考慮して 30 塩基長から 60 塩基長程度に設定されているケースが最も多い印象である。
3.2 非結合核酸の分離除去
SELEX において非常に重要な工程として挙げられるのが、非結合核酸の除去工程である。これが十分に除去されていないと、続く増幅過程にてライブラリー核酸中におけるアプタマー成分比を効果的に増加させることはできない(進化させることができない)。取得に要する SELEX のラウンド数(一連のプロセスの反復数)の増加に繋がるだけではなく、残存した非結合核酸によって、PCR 増幅時にアプタマーの存在比を指数関数的に減少させ、最悪の場合、枯渇させてしまう恐れがある。手軽で最もポピュラーな非結合核酸の分離除去法は、標的を基体に固定化した状態でライブラリーの選択を実施した後、洗浄分離する方法であろう。標的がタンパク質であれば、タグ(His タグや Fc タグなど)を介して磁気ビーズやゲルビーズに固定化させる事例を見かけることが多い。メンブレンに物理吸着させている例もある。
ここで、いくつかの問題点や考慮点がある。洗浄時のデッドボリュームや基体への非特異吸着による非アプタマー核酸の残存もその一つである。標的の基体への最適な固定化密度も考慮される必要があるだろう。また、いわゆる「固定化タンパク結合性」アプタマーの取得が懸念されている。それらの解決法となるのがキャピラリー電気泳動法の利用である(CE-SELEX)11-14) 。泳動度の違いを利用し、非結合核酸、タンパク質、およびアプタマーとタンパク質の複合体を分離することが可能であるが、処理量が少ないためライブラリー核酸の多様性が制限される。また、分離するためには、アプタマー、標的、およびそれらの複合体間で、十分なサイズと電荷の違いも必要であるため、小分子などを標的とするには困難な場合がある。近年では、これらの問題点を解決する MACE®-SELEX 法と呼ばれる手法も開発されている15)。
3.3 カウンター SELEX
非標的を提示し、その結合成分を除去する操作はカウンター SELEX(もしくはネガティブセレクション)と呼ばれ、標的とライブラリーのインキュベート前後のいずれかで実施される。固定化のために基体を用いる際には、その基体に対する結合成分を必ず除去しなければならない。また類似構造を有する非標的分子や結合競合が予想される非標的分子に対する結合を回避するために同操作は非常に効果的である。
3.4 次世代ライブラリー核酸の生成と淘汰圧の調整
標的に結合するライブラリー核酸を回収し、PCR にて増幅した後、ライブラリー核酸の相補鎖側は不要であるため除去する必要がある。ビオチンで標識された相補鎖(リバースプライマーとして 5’位ビオチン修飾物を用いれば、PCR 産物中のライブラリー核酸の相補鎖は全てビオチンで標識される)を介し、PCR 産物をストレプトアビジン修飾アガロースビーズ充填カラムにトラップした後、水酸化ナトリウム溶液を負荷することで二本鎖を変性させてライブラリー鎖のみを溶出し、最後に脱塩すれば、簡便迅速かつ高収率でライブラリー核酸を回収できる。
次のラウンドでは更なる進化を促すために選択時の淘汰圧を高める必要がある。一般的には標的濃度の減少や標的とのインキュベーション時間の短縮、洗浄強度や洗浄回数の増加、カウンターセレクションの追加などで達成される。当然、淘汰圧が厳しすぎると、アプタマー候補が絶滅してしまうが、弱すぎると進化が遅れるか進化に失敗するため、適度な塩梅が求められる。淘汰圧はラウンドを重ねるごとに徐々に強くしていくと良い。
3.5 配列解析と構造予測
最終的に得られたライブラリー核酸の配列は、(i)インサートとしてライブラリー配列が組み込まれたプラスミドベクターを大腸菌に形質転換し、クローニングした後、各コロニーの培養抽出液から回収したプラスミド DNA をサンガーシークエンスする手法、もしくは(ii)次世代シークエンサーにて網羅的に解析する手法によって解読される。後者に関しては、費用面での負担が大きいが、候補配列の解読漏れを防止できる上、ラウンド毎に解析すれば、配列の進化の過程も詳細に追跡可能である。
配列の解読が終わった後は、存在割合から優位な配列の調査、配列のグループ化(ファミリー化)、コンセンサス配列の調査が行われる。その後、NUPACK や Mfold などのツールを用い、アプタマーの高次構造が予測される。場合によっては、その予測構造から、不要と想定されるドメインの削除(ダウンサイジング)を試みることがある。特に両末端のプライマー結合領域は、進化の過程で選ばれた配列ではなく、実験者が任意に設定した配列であるため、アプタマーの構造形成に関与していない場合もあり、その場合は無駄に分子サイズを大きくしているだけである。ダウンサイジング前後での結合挙動の変化を確認し、最適なアプタマー配列が決定される。プライマー結合領域がアプタマーのコア構造に極力含まれないように、プライマー結合領域とランダム配列領域の間にリンカーとして T の連続配列を配置する工夫が施されることもある16)。標的との結合構造はドッキングシミュレーションなどで推定することはあるが、正確な構造の予測は未だ困難である。低分子リガンドとの結合構造に関しては X 線結晶構造解析や NMR などが利用されてきたが、クライオ電子顕微鏡の登場により、タンパク質との結合構造解析も可能となってきている17, 18)。
3.6 Cell-SELEX とハイブリッド SELEX
細胞を直接標的化し、SELEX を行うこともできる(Cell-SELEX)19)。その際、非標的細胞を用いたカウンター SELEX は必須となる。Cell-SELEX の特徴として、標的化したい細胞表面と区別化したい細胞(非標的細胞)表面に関する知見を十分に持ち合わせていない状況であっても、標的細胞に特異的に結合し得るアプタマーの取得が可能な点が挙げられる。得られたアプタマーと細胞表面の未知な結合対象とを化学連結した後、プルダウンされた成分を解析することによって、後から結合対象を知ることも可能であり、未知のバイオマーカーの発見にも期待が寄せられている。
標的とすべき膜タンパクが明確に判っている場合であっても Cell-SELEX を介してアプタマーを取得した方が良い可能性もある。発現タンパクを対象とした SELEX の場合、細胞環境下における実際のタンパク質構造を正確に提示できる保証がないためである。例えば、膜タンパク質は多様な糖鎖修飾を受けることが知られているが、発現タンパクでその多様性や存在比が再現されているかは不明である。したがって、発現膜タンパクを用いた SELEX と同膜タンパクを高発現する細胞を用いた Cell-SELEX によって優先的に取得されてくるアプタマー配列が異なっていてもおかしくはない。
発現膜タンパクを用いた SELEX と同膜タンパクを発現する細胞を用いた Cell-SELEX を組み合わせる(ハイブリッド SELEX)20, 21)ことで、細胞表面の任意の膜タンパクに結合するアプタマーを安定して取得できる。標的膜タンパク非発現細胞から安定発現株を樹立し、Cell-SELEX を行っても良いだろう。元の非発現細胞に対するカウンター SELEX との併用で目的のアプタマーが取得できる。
近年、生体中での SELEX も報告されている。修飾 RNA のライブラリーを腫瘍担持マウスに静脈注射し、腫瘍に局在するアプタマーを抽出し増幅した結果、選択された 2 つのアプタマーが、腫瘍内で高発現しているバイオマーカー(P68)を標的としていることが判明し、注目を集めている22)。
3.7 結合親和性の評価
得られたアプタマーの標的に対する解離定数 Kd や見かけの Kd は、ドットブロットアッセイ、直接 ELISA、フローサイトメトリー、等温滴定型カロリメトリー(ITC)、マイクロスケール熱泳動(MTS)などの測定から算出できる。また、結合・解離の速度定数まで知りたい場合は、表面プラズモン共鳴(SPR) を原理とする分子間相互作用解析を行うと良い。
4. 標的化のスペシャリスト
本項では 4.1. ドラッグデリバリー、4.2. 生体分子反応の制御、4.3. 分離・分析、などの分野における応用例を紹介したい。
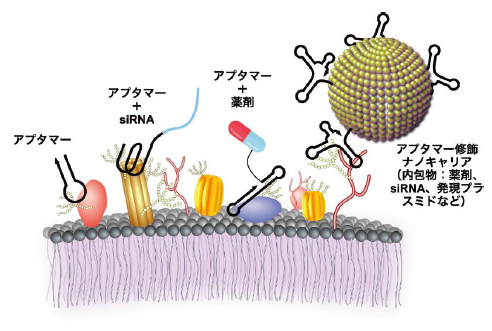
4.1 細胞標的化モジュールとしてのアプタマー
がん細胞標的化モジュールとして、抗ヌクレオリンアプタマー(AS1411)23)、抗 PTK7 アプタマー(Sgc8c)24)、抗 SDF-1 アプタマー(NOX-A12)25)、抗ビメンチンアプタマー(NAS-24)26)、抗 PSMA アプタマー(A10)27)、抗 CD44 アプタマー(Apt1)28)、抗 EpCAM アプタマー(SYL3C)29)、抗 PD-L1 アプタマー(aptPD-L1)30)、抗 MUC-1 アプタマー31)、抗 EGFR アプタマー32)、抗 HER2 アプタマー(E6 およびE7)33)などが既に開発されている。図2に示すようにドラッグ(Dox などの薬剤小分子や siRNA など)もしくはドラッグキャリア(リポソームや 2 型アデノ随伴ウイルスなど)表面にこれらのアプタマーを修飾することで、細胞・組織・臓器特異的な送達が試みられている。AS1411 に代表されるように一部のアプタマーは、細胞表面の標的タンパクとの結合をきっかけとして内在化することが知られており、高い関心を集めている4)。
4.2 生体分子反応を制御するアプタマー
生命活動の基盤となる複雑な生物学的プロセスは、生理活性物質とタンパク間の相互作用、タンパク質- タンパク質間相互作用などによって緻密に制御されている。ペガプタニブナトリウム(Macugen®) は、FDA によって承認された最初の治療用アプタマーである。血管内皮増殖因子 VEGF165 に結合することで Fit-1、KDR、NP-1 受容体への結合を阻害し、結果として血管新生の阻害と血管透過性の亢進を引き起こす34)。CD28 35)、OX40 36)、4-1BB 37)、CD30 38)などの免疫関連受容体に結合するアプタマーは、同受容体を遮断または活性化することによって、アゴニスティックに免疫反応を調節できることがわかった。免疫チェックポイント阻害の機構に関与している PD-L1 に結合するアプタマーは、T 細胞の腫瘍への浸潤度と IL-2、TNF-α、IFN-γ などのサイトカインの分泌量を上昇させることがわかった39)。また、G タンパク質共役受容体の活性をアロステリックに制御するアプタマーも報告されている。E3 リガーゼリガンドをアプタマーとコンジュゲーションすることで PROTAC システムを利用可能である40)。近年、血管脳関門の障壁を突破する興味深いアプタマーも報告されている41)。
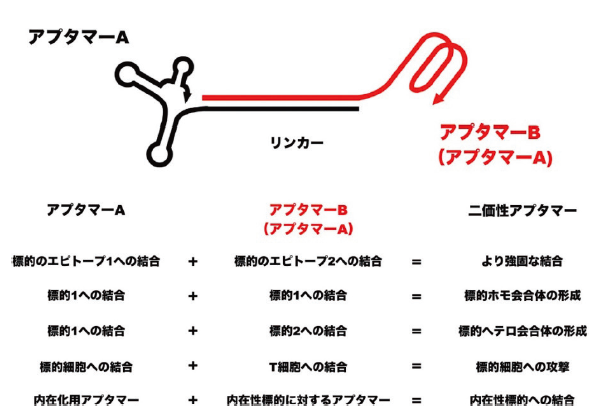
ここ最近のトレンドとして、図3に示すようにアプタマーの多価化戦略が注目されている。トロンビンのエキソサイト 1 および 2 に結合する 2 つのアプタマー(それぞれ TBA15 および TBA29)を連結することで、単独時より 50 倍程、抗凝固能が向上することがわかった42)。SARS-CoV-2 スパイクタンパク質を標的とする 2 つのアプタマー、MSA1T および MSA5T を連結した結果、それぞれ単独時より約 100 倍および 30 倍高い結合親和性を示すことがわかった43)。また、T 細胞特異的な LD201t1 アプタマーと標的細胞を認識するアプタマーを連結して用いれば、T 細胞による標的がん細胞の殺傷効果を促進できることが見出された44)。二価性アプタマーによるサイトカイン受容体の二量化を介して受容体の活性制御も達成されている45)。
4.3 分離・分析用ツールとしてのアプタマー
アプタマーを利用した分離・分析例は非常に多く、ここではエッセンスの紹介だけに留め、詳しくは他の総説46, 47)などを参考にして頂きたい。基本的に、化学修飾によりプローブ化したアプタマーが、標的との結合時(解離時)に起こす構造変化を利用している事例が多い。その際、任意のシグナルアウトプットが可能であり、FRET シグナルや電気化学的シグナルを変化させたり、呈色させたり、アプタザイムを動作させたりとその選択肢は様々である。また、アプタマーを修飾したセンサーチップ等は、同様な抗体修飾品と比較すると一般的に変性に強い。仮に変性した場合でも、適切な条件でアニーリングすれば活性な構造が再生することは特筆すべき点であろう。
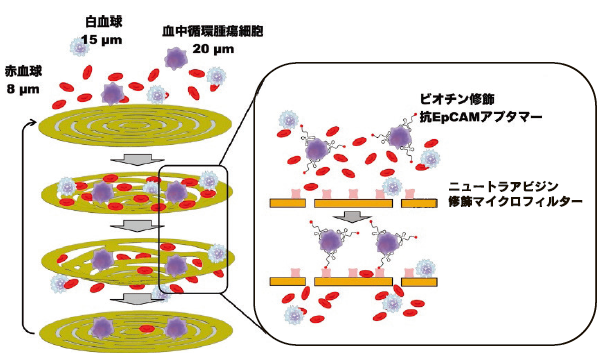
筆者もまた、アプタマーを用いたがん患者の血中からの腫瘍細胞の選択的捕捉(図4)48)、均一系における ATP の選択的センシング49)、ELONA 法もしくはリアルタイム PCR 法を用いた体液検査法 50)に関する報告を行なっており、参考として紹介したい。
生体分子の細胞内における機能を正確に知るためには、生細胞におけるイメージング技術が必要であり、それを目的としたアプタマーの開発も進んでいる。なかでも緑色蛍光タンパク質 GFP の発色団である 3,5- ジフルオロ-4- ヒドロキシベンジリデンイミダゾリノン(DFHBI)類似体である非蛍光性分子に対する RNA アプタマーが最も有名である。同分子は単独では発光を与えないが、アプタマーと結合すると蛍光を発する51, 52)。現在は、熱安定性や光安定性が向上した派生種53-55)や消光剤 BHQ 56)に対するアプタマーも出現しており、その質や種類も充実してきている。これらの蛍光性 RNA アプタマーはタグとして標的 RNAに連結付与することで、標的 RNA の細胞内における局在や輸送のダイナミクスの検証に利用することができる。また、標的分子に対する RNA アプタマーと連結して用いれば、RNA 以外の分子に対するイメージングにも応用可能である。これらの蛍光性アプタマーラベル化 RNA は in vitro で発現させた後、トランスフェクションすることもできるが、発現プラスミドとして細胞内に導入しておけば、in situ で発現させることもできる。
アプタマーの分子認識機構とトランス切断活性を有する CRISPR-Cas を利用したバイオセンシングシステム57)との組み合わせも盛んに検討されてきており、バイオ分析分野におけるアプタマーの重要性は今後一層高まっていくものと予想される。
5. おわりに
核酸科学における様々な技術的進歩、知見の集積、および新たな SELEX 法の開発等により、実験工程が合理化され、新たなる参入者への障壁も低くなった。その結果、1990 年ではわずか 20 件程度であった核酸アプタマーに関する文献数は、30 年後の 2020 年には 14,000 件を超える数となっている。市場調査の結果(www.marketdataforecast.com)によると、世界のアプタマー市場の規模は、年平均成長率 23.5% で、2023 年に 2億8,260万米ドル、2028 年までに 6億1,070万米ドルに達すると推定されている58)。アプタマーを利用した多くの分析法や治療法において、基礎研究、概念実証、臨床評価のステージからの脱却と医療現場での活用ステージへの飛躍が強く期待されていることであろう。
一方で、その実現には解決すべき課題もいくつか残っている。一つは、核酸の分解に関するものである。やはり、核酸は生体環境下ではヌクレアーゼによって容易に分解されてしまう。RNA に至っては、糖鎖 2’位の OH 基の存在によって化学的にも DNA より不安定である。そこで、2’位の OH 基から非天然構造である OMe 基や F 基への置換が検討されている。また、40 kDa の PEG を末端に導入することで、エキソヌクレアーゼから受ける分解の影響を低減でき、半減期が大きく伸びることもわかった59)(因みに Macugen®の5’末端は 40 kDa の PEG で、3’末端は inverted dT で修飾されている)。天然構造の核酸から取得されたアプタマーを、後から非天然構造に置換しようとすると、場合によっては結合活性を失ってしまう可能性があるだけではなく、強い免疫応答を誘起する可能性もあり、試行錯誤が続いている。もう一つの課題点は、エンドソームからの脱出効率があまり高くない点にある。これに関しては、脱出効率を改善する分子の修飾が検討されている60)。以上の問題点・課題点は、アプタマー固有のものという訳ではなく、核酸医薬品全般に渡っての共通問題である。時勢もあり、核酸や核酸医薬品の研究開発に大きな注目が集まる世界的潮流の中、これらの共通問題も加速的に解決に向かっていくものと考えている。将来的には、名実と共に次世代の分子認識素子としてアプタマーが広く利用される時代の到来を期待するところである。
| [ 著者プロフィール ] | |
| 氏名 | 北村 裕介(Yusuke Kitamura) |
|---|---|
| 所属 |
熊本大学大学院先端科学研究部 〒860-8555 熊本市中央区黒髪 2-39-1 TEL 096-342-3872 |
| 出身学校 | 熊本大学 |
| 学位 | 博士(工学) |
| 専門分野 | 核酸科学、分析化学 |
| 現在の研究テーマ | 核酸を基体としたバイオセンサーの開発 |