小社が立地する熊本県の生命科学研究最前線を、熊本大学の若手研究者が連載(8回)でお届けします。
生命が体内エネルギーの恒常性を維持する脳内メカニズム
Brain mechanisms to maintain energy homeostasis

戸田 知得
熊本大学大学院
生命科学研究部
中枢性代謝制御学講座
特任助教
Abstract After sensing the systemic energy information, the hypothalamus regulates appetite and metabolism in peripheral tissues to maintain homeostasis of body weight and blood glucose levels. Hormones such as leptin secreted by peripheral tissues and blood nutrient concentrations activate or inhibit various neurons in the hypothalamus, allowing energy sensing by the brain. Glucose-sensing neurons are the neurons whose electrical activity is altered by changes in glucose concentration. There are two types: glucose-excited and glucose-inhibited neurons. We have elucidated the molecular mechanisms necessary for regulating leptin signaling and glucose sensing in the hypothalamus. We started our laboratory, named the Department of Neuroscience for Metabolic Control in the Faculty of Life Science, Kumamoto University, in December 2022. We would like to continue to elucidate the brain mechanism of energy sensing. At the same time, we are interested in the mechanisms by which memory and prediction alter systemic metabolism.
1. はじめに
多くの方が経験するように、お腹が空きすぎるとご飯のことばかり考えて仕事にならない。また、風邪などで長期間食べることができなかったときには体調が回復してからも身体が思うように動かない。これは体内エネルギーが不足していて、栄養摂取に対する願望が増えることと、筋肉などの代謝および機能が低下していることが原因の 1 つである。自然界では身体が動かないと外敵から逃げたり反撃することができない。したがって、体内に十分なエネルギーをためて維持していることが生命の維持に必須であり、日々、元気溌剌と生活するためにも必要である。
脳は体内エネルギーの蓄積量を、末梢ホルモンや上行性神経などの情報によってモニターしている。体内エネルギーが不足してくると食欲を上げ、代謝を低下させてエネルギー不足から回復させる。そして食事のチャンスが来るまで待てる体内環境を作り出す。古くから糖質、脂質、アミノ酸が全身エネルギーの恒常性維持のトリガーとなると考えられ、それぞれ glucostatic、lipostatic、aminostatic theory と呼ばれた。実際に、食事中のこれらの栄養成分を減らすとその成分を十分量摂取できるまで食べて過食になる1)。
2. 脳による体内エネルギーのセンシングと代謝調節
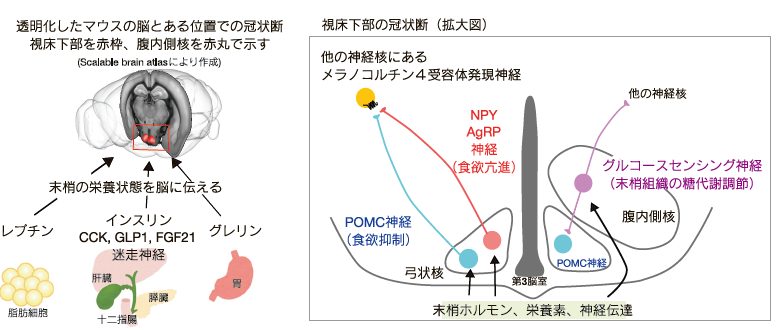
このような代謝研究の中でレプチンの発見は研究分野の大きな発展につながった。脂肪細胞から分泌されるレプチンは体重調節に必須の役割を果たす。そのためレプチン欠損マウスは過食とエネルギー消費の低下によって重度の肥満になる。その後、視床下部の pro-opiomelanocortin(POMC)、Neuropeptide Y(NPY)、Agouti-related protein (AgRP)、Melanocortin receptor 4(MC4R) などについて様々な遺伝子欠損マウスが作られて、レプチンを含めた多くの末梢ホルモンが視床下部の POMC、NPY/AgRP 神経に作用し、POMC は食欲抑制、NPY/AgRP 神経は食欲亢進を起こすこと、POMC の神経終末から α-MSH、NPY/AgRP 神経から NPY/AgRP が放出され、室傍核のメラノコルチン 4 受容体を介して体重調節を起こすことが明らかにされてきた(図1)2)。詳しくは実験医学などの総説にまとめてあるのでそちらを読んでいただきたい3, 4)。これらのタンパク質をコードする遺伝子の欠損および多型が肥満や糖尿病に関わっており、遺伝子欠損の場合は組み換えタンパク質やメラノコルチン受容体アゴニストを投与することで重度肥満症を改善することができる5)。
逆に脂肪組織で脂肪滴を形成するタンパク質の異常などでおこる脂肪萎縮症では、やせているにもかかわらず糖尿病になる。脂肪萎縮症では脂肪組織が形成されないことでレプチン生成も無くなる。この患者さんにレプチンの組み換えタンパク質を投与することで糖尿病が改善することから、人においてもレプチンが糖代謝に重要であることが分かっている6)。私もレプチンが血糖値を変える脳内メカニズムを研究しており、その脳内メカニズムの一部を解明した7, 8)。簡単にまとめると、視床下部の中でも腹内側核のレプチン受容体が全身糖代謝を増加させるレプチンの効果に最も重要な部位であり、腹内側核の中に骨格筋と肝臓のインスリン感受性を調節する別々の神経細胞および細胞内シグナル伝達機構があること、そして腹内側核の神経が活性化した後、弓状核の POMC 神経およびそのさらに下流の MC4R を介して末梢組織の糖代謝を調節することを明らかにした(図1)。
3. グルコースセンシング神経の発見は九州から
グルコースは脳の主なエネルギー基質であり、極度の低血糖になると意識がなくなり、血糖値を回復させないと死亡する。逆に高血糖が持続すると血管障害が起こり、網膜、腎臓、脳などで糖尿病合併症が起こる。したがって、脳は常に血糖値の変化をモニターしており、低血糖になった場合は食欲の増加および肝臓などからの糖産生を増加させ血糖値を回復させる。高血糖でも食欲低下および骨格筋や肝臓のインスリン感受性増加によって正常の血糖値に戻す。脳にはグルコースセンシング神経があり、これらの調節を行っている。グルコースセンシング神経にはグルコース興奮性神経とグルコース抑制性神経の 2 種類がある。グルコース興奮性神経は高血糖時、グルコース抑制性神経は低血糖時に活性化して、血糖値の増加または低下から正常値に戻そうと働く。グルコース興奮性神経は 1969 年に大村裕先生(九州大学)が Nature 誌に発表した9)。余談であるが大村先生は 90 歳を超えた今でも肥満学会などで一般演題の口頭発表を続けておられ、私は勝手に人生の師匠として尊敬、目標、憧れなどの感情を持っている。グルコース濃度が低下するとグルコース抑制性神経内で AMP/ATP 比が増加し、AMP-activated protein kinase (AMPK)を活性化する。AMPK は NO および Cl-チャネルを介して神経細胞を脱分極する。グルコース興奮性神経ではグルコース濃度の増加が細胞内 ATP 濃度を増加し、ATP 依存性カリウムチャネル(KATPチャネル)を閉じて脱分極させる(図2A)4)。
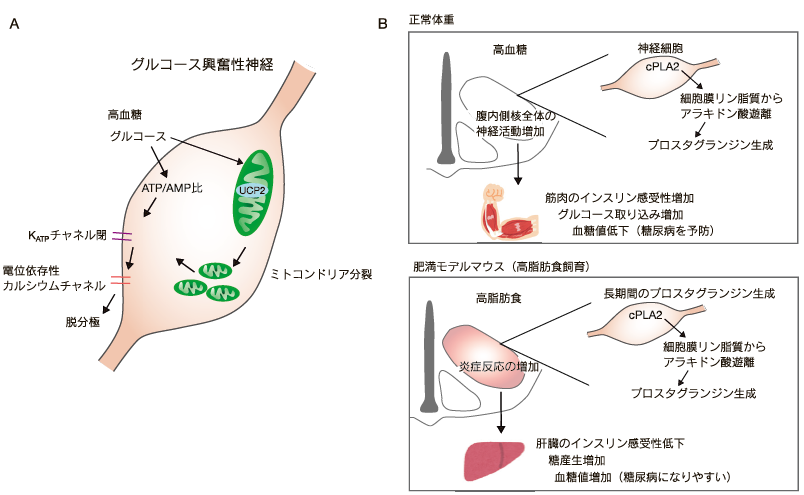
- A. 腹内側核のグルコース興奮性神経において、高血糖時にミトコンドリア内膜にある脱共役タンパク質 2(UCP2)の作用によりミトコンドリアが分裂し神経活動の増加に必須に役割を果たす。
- B. 腹内側核では高血糖時に cytosolic Phospholipase A2(cPLA2)がプロスタグランジン生成を増加させ、腹内側核全体の神経活動亢進および骨格筋の糖代謝増加によって血糖値を低下させる。しかし、肥満モデルマウスでは長期間のプロスタグランジン生成によって視床下部でミクログリアの活性化などの炎症反応が増加し、肝臓に作用して血糖値を増加させる。
4. ミトコンドリア分裂がグルコースセンシング神経の活性化に必須
私が Yale 大学に留学した時に与えられたテーマは視床下部腹内側核のミトコンドリア脱共役タンパク質 2(UCP2)欠損マウスの解析だった。このマウスは体重、食事量、熱産生などは野生型と変わらなかったが、糖代謝が悪化していた。特にグルコースを投与したときに高血糖が続き、視床下部の神経活動も高血糖時に活性化しなかった。そこからグルコース興奮性神経の調節に UCP2 が関わっている可能性を調べ、UCP2 がグルコース興奮性神経の中で活性酸素およびミトコンドリアの分裂に必須であり、ミトコンドリアのサイズが小さくなることが高血糖のセンシングに必要であることを発見した(図2A)10)。その際、KATP チャネルを介した神経活動の増加であったことから、ミトコンドリアが小さくなると細胞内 ATP が増加すると考えられるが、他の細胞では小さいミトコンドリアは ATP 産生能力が低く、むしろ古くなったミトコンドリアの一部を切り離してオートファジー(マイトファジー)によって分解させるために小さくすると報告されているため、詳細は未だに不明である11)。
5. 脳内プロスタグランジン生成が視床下部のグルコースセンシングには重要
帰国して学部時代の出身ラボである北海道大学獣医学部生化学教室の助教になった。北大の他学部に生理学研究所時代のソフトボール大会で同じチームだった早坂孝宏さんがいることを知り(ただし私の趣味は剣道です。先日、左ふくらはぎの肉離れを起こし、42 才はもう若くないことを実感しました。)、挨拶に行くとイメージング質量分析機で組織内の分子の分布を測定していた。当時は視床下部の研究でこの技術を誰も使っておらず、これは新しい発見につながると思いイメージング質量分析を視床下部のグルコースセンシング研究に利用した。
マウス腹腔内にグルコースを投与すると、視床下部でアラキドン酸を含むリン脂質が減少してプロスタグランジンが増加した。これは、高血糖時に視床下部の細胞膜リン脂質からアラキドン酸が遊離して代謝されていることを示唆する。実際にグルコースを投与すると視床下部でプロスタグランジン生成が増加していた。アラキドン酸の遊離は、細胞質型ホスホリパーゼ A2 (cPLA2)によって調節されている。通常食を与えたマウスの腹内側核で cPLA2 の発現をノックダウンしたところ、筋肉のインスリン感受性が低下した。この時、腹内側核でグルコース投与によって増加する神経活動が、cPLA2 ノックダウンマウスで抑制された12)。つまり、高血糖が cPLA2 を介したプロスタグランジン生成によって腹内側核の神経活動を増加して、骨格筋のインスリン感受性を亢進させると考えられる(図2B)。
一方、高脂肪食により肥満したマウスでは、腹内側核の cPLA2 ノックダウンにより耐糖能異常が改善した12)。高脂肪食飼育マウスでは常に cPLA2 が活性化されてプロスタグランジンを産生し、視床下部の炎症が肝臓のインスリン感受性が低下させてグルコース恒常性を破綻させていると考えられた(図2B)。つまり、視床下部の cPLA2 を起点とするリン脂質代謝は、やせ型では生理的な血糖値調節に機能しており、肥満では糖尿病を悪化させる、という異なる結果となっていた。
6. 今後の展開
このように、長期間のエネルギー状態(脂肪組織の重量)を反映するレプチンや食後に上昇する血糖値等が視床下部に作用して血糖値を下げる方向に働くネガティブフィードバック機構として存在する。しかし実は食事を見た瞬間に、これまでの経験から食べ物にどれぐらいのエネルギー量が含まれているかを予測して、食べ物が胃の中に入る前に消化、吸収そして代謝されやすいように体が準備し始める(図3)。例えば、夜中に美味しそうな食事の映像がテレビに流れると、お腹が空いて唾液が出るような現象である。これは頭相反応と呼ばれ、パブロフの犬の条件付けのようによく知られた応答であるが、その脳内メカニズムは十分にわかっていない。我々はグルコースセンシングを主な研究対象としているが、頭相反応のように記憶による代謝調節がどのような神経回路で行われているかについて非常に興味を持っており、現在研究を進めている。また、グルコースセンシングに関わる細胞内シグナル分子では ATP が重要であるが、視床下部で ATP や解糖系の中間代謝物を測定するためには Focused Microwave によってマウスの脳をミリ秒単位で熱処理する必要がある。熊本大学の動物施設には Focused Microwave があり、質量分析の共通機器もそろっている。高血糖、低血糖、肥満などの状態で視床下部の中でグルコースがどのように代謝されてグルコースセンシングにつながり、その悪化が糖尿病に関わるかを明らかにしたい。

7. おわりに
九州において発見されたグルコースセンシング神経ではあるが、最近ではこれを研究する日本人が少なくなり、退官された先生方からもっとグルコースセンシング神経を研究しなさいと言われる。幸運にも熊本大学において自分の研究室を立ち上げることができて運命的なものを感じている。研究室の名前も中枢性代謝制御学講座にした。これからもグルコースセンシングについて研究を進めるとともに、これまで脳内メカニズムについて全く研究が進んでいない頭相反応についても研究を進め、熊本からグルコースセンシングのような大きな発見をしたい。はじめにお腹が空くと仕事ができないと書いたが、軽い空腹感はむしろ集中力を上げると私は思う。また、糖尿病の患者さんが低血糖になった時に血糖値の低下を感じることは意外と難しく、グルコースセンシング神経では説明できない。このように脳と血糖値の研究にはまだ未解明な研究領域が多く残されており、今後どのような研究成果が出て来るか楽しみな分野である。この研究分野の発展に貢献していきたい。
【参考文献】
- M. López, S. Tovar, M. J. Vázquez, L. M. Williams and C. Diéguez, “Peripheral tissue–brain interactions in the regulation of food intake”, Proc. Nutr. Soc., 2007, 66, 131-155.
- C. Toda, A. Santoro, J. D. Kim and S. Diano, “POMC Neurons: From Birth to Death”, Annu. Rev. Physiol., 2017, 79, 209-236.
- 岡勇輝, “ 個体生存に不可欠な本能行動のサイエンス”, 実験医学, 2022, 40.
- 箕越靖彦, 近藤邦生, 中島健一朗, “ 神経が司る代謝・炎症制御と生体恒常性 臓器ネットワークを理解し、疾患予防・治療へ繋ぐ”, 実験医学増刊,2023, 41.
- Y. Yang and Y. Xu, “The central melanocortin system and human obesity”, J. Mol. Cell Biol., 2020, 12, 785-797.
- D. Araújo-Vilar and F. Santini, “Diagnosis and treatment of lipodystrophy: a step-by-step approach”, J. Endocrinol. Invest., 2019, 42, 61-73.
- C. Toda et al., “Extracellular Signal-Regulated Kinase in the Ventromedial Hypothalamus Mediates Leptin-Induced Glucose Uptake in Red-Type Skeletal Muscle”, Diabetes, 2013, 62, 2295-2307.
- C. Toda et al., “Distinct Effects of Leptin and a Melanocortin Receptor Agonist Injected Into Medial Hypothalamic Nuclei on Glucose Uptake in Peripheral Tissues”, Diabetes, 2009, 58, 2757-2765.
- Y. Oomura, T. Ono, H. Ooyama and M. J. Wayner, “Glucose and Osmosensitive Neurones of the Rat Hypothalamus”, Nature, 1969, 222, 282-284.
- C. Toda et al., “UCP2 Regulates Mitochondrial Fission and Ventromedial Nucleus Control of Glucose Responsiveness”, Cell, 2016, 164, 872-883.
- R. Sabouny and T. E. Shutt, “Reciprocal Regulation of Mitochondrial Fission and Fusion”, Trends Biochem. Sci., 2020, 45, 564-577.
- M.-L. Lee et al., “Prostaglandin in the ventromedial hypothalamus regulates peripheral glucose metabolism”, Nat. Commun., 2021, 12, 2330.
| [ 著者プロフィール ] | |
| 氏名 | 戸田 知得(Chitoku Toda) |
|---|---|
| 所属 |
熊本大学大学院生命科学研究部 中枢性代謝制御学講座 〒860-8556 熊本県熊本市中央区本荘 1-1-1 基礎医学研究棟 8 階西側 X(旧ツイッター) @kuma_neurometab ホームページ:https://chitokutoda2.wixsite.com/kumadai-teamtoda TEL 096-373-5082 |
| 出身学校 | 北海道大学獣医学部 |
| 学位 | 博士(学術)@ 総合研究大学院大学・生理学研究所 |
| 専門分野 | 代謝学、神経科学、生理学 |
| 現在の研究テーマ | 脳によるエネルギーセンシングと全身代謝調節機構の解明 |