精神神経疾患と脂質代謝
~スフィンゴ脂質をターゲットとした新たな治療戦略の可能性~
Neuropsychiatric Disorders and Lipid Metabolism: Potential for New Therapeutic Strategies Targeting Sphingolipids

江﨑 加代子
崇城大学生物生命学部
生物生命学科
准教授
Abstract Sphingolipids are components of cell membranes and play important roles in brain development and neurological function. In recent years, several studies have reported changes in sphingolipid metabolism in neurodegenerative diseases, such as amyotrophic lateral sclerosis (ALS) and hereditary sensory and autonomic neuropathy (HSAN), and psychiatric disorders, such as schizophrenia, suggesting the involvement of sphingolipid metabolism in the pathogenesis of these diseases. Since patients with neurodegenerative diseases may also suffer from psychiatric disorders, sphingolipids are suspected to be involved in one of the molecular mechanisms linking these diseases. In this article, I introduce the metabolic abnormalities of sphingolipids in neurodegenerative disease- and psychiatric disorder-related studies based on recent findings from our group.
1. はじめに
スフィンゴ脂質は、細胞膜の構成要素であり、脳の発達や神経機能などで重要な役割を果たすことが知られている。近年、筋萎縮性側索硬化症(ALS)や遺伝性感覚性自律神経性ニューロパチー(HSAN)などの神経変性疾患や、統合失調症などの精神疾患におけるスフィンゴ脂質代謝酵素遺伝子の変異やスフィンゴ脂質代謝の変化が複数報告されており、これら疾患の病態発症メカニズムへのスフィンゴ脂質代謝の関与が示唆されている。神経変性疾患患者においては、精神疾患を併発する場合もあることから、神経を軸とした二つの疾患をつなぐ分子機構の一つとしてスフィンゴ脂質の関与が疑われる。本稿では、我々のグループの最近の研究成果も踏まえて筋萎縮性側索硬化症などの神経変性疾患および精神疾患関連の研究におけるスフィンゴ脂質の代謝異常について紹介する。
2.スフィンゴ脂質の代謝
スフィンゴ脂質は、スフィンゴイド塩基を骨格として持つ脂質の総称である。スフィンゴ脂質には、グリセロ脂質の骨格には存在しない窒素原子を含んでいるという構造的特徴があり、その窒素原子はアミノ酸の L- セリンに由来する。スフィンゴ脂質は受容体を介した機能がよく知られており、ミエリン形成や免疫などの様々な細胞機能に関与するシグナル伝達カスケードの重要なメディエーターである。また、細胞膜の構成成分としても知られており、特にミエリンなど中枢神経系では特に豊富に含まれる。
主要なスフィンゴ脂質の de novo 合成は、セリンパルミトイル転移酵素(SPT)による、アミノ酸 L- セリンとパルミトイル CoA の縮合で始まり、スフィンゴイド塩基のアミノ基に脂肪酸が結合してセラミドが生成される。セラミドに糖やホスホコリンなどが結合することで、グルコシルセラミドやスフィンゴミエリンなどが合成される。さらに、セラミドが分解されてスフィンゴシンやスフィンゴシン -1- リン酸(S1P)なども生成される 1)。また、変異型 SPT などでは、L- セリンの代わりに L- アラニンまたはグリシンとパルミトイル CoA の縮合でスフィンゴ脂質の生合成が開始され、C1 水酸基を欠くデオキシスフィンゴ脂質が生成される(図1)。デオキシスフィンゴ脂質は、ミトコンドリア障害を引き起こし、特に神経細胞に強い毒性を示すことが報告されている 2)。
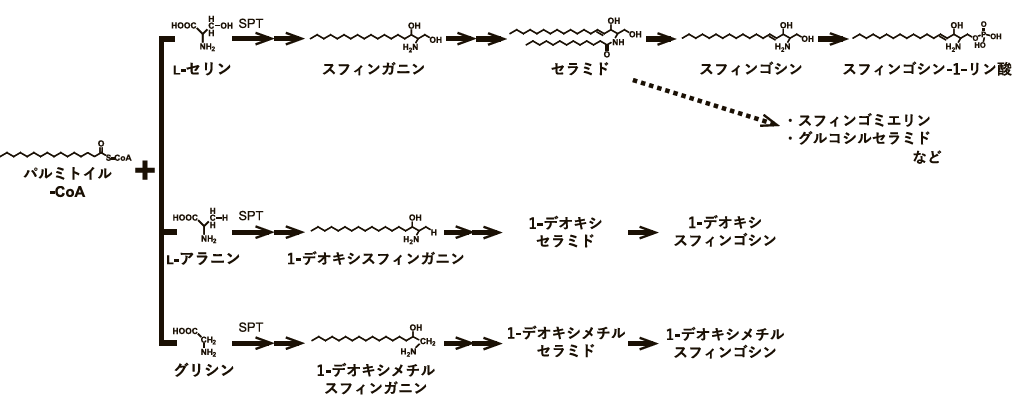
3.セリンパルミトイル転移酵素(SPT)
スフィンゴ脂質合成の初発段階を担う酵素はセリンパルミトイル転移酵素(serine palmitoyltransferase; SPT)であり、セリンとパルミトイル CoA とを縮合してケトジヒドロスフィンゴシンを生成する。 SPT は、3 種類のサブユニット SPTLC1、SPTLC2、SPTLC3 が構成成分として知られており、SPTLC1/SPTLC2 または SPTLC1/SPTLC3 のヘテロ二量体を形成する。スフィンゴ脂質の de novo 合成で主に生成されるスフィンゴイド塩基は C18 スフィンゴシンであるが、SPTLC3 が SPT の構成成分として含まれる場合には、基質として用いる脂肪酸の幅が広がり C16 から C22 スフィンゴシンが生成される。また、SPTSSA(serine palmitoyltransferase small subunit A)または SPTSSB が前述のヘテロ二量体と結合して機能し、SPT の脂肪酸への基質特異性に関与する。 SPTSSA が結合した場合にはパルミトイル CoA への親和性が高くなるため C18 スフィンゴシン、SPTSSB ではステアロイル CoA への親和性が高くなるため C20 スフィンゴシンが生成される。さらに、SPT の活性制御として、SPTSSA および SPTSSB は活性を正に制御し、一方で ORM/ORMDL ファミリータンパク質は負に制御することも知られている 3)。
4.筋萎縮性側索硬化症におけるスフィンゴ脂質過剰産生
筋萎縮性側索硬化症(ALS)は、上位運動ニューロンと下位運動ニューロンの進行性変性を特徴とする神経変性疾患である。 ALS が進行すると、上肢や下肢の筋力低下、口輪筋や呼吸筋の筋力低下を呈する。 ALS の発症率は 10 万人あたり約 2 人で、50-70 歳で発症することが多いが、40 歳未満で発症する若年発症の ALS も知られている。発症からの平均生存期間は 2 ~ 4 年であり、患者の約 50% は運動障害に加えて認知症などの症状がある程度認められる。また、症例の約 10% は家族性で、C9orf72、SOD1、FUS、TDP43 など 30 以上の遺伝子が ALS の原因遺伝子または関連遺伝子として同定されている 4)。
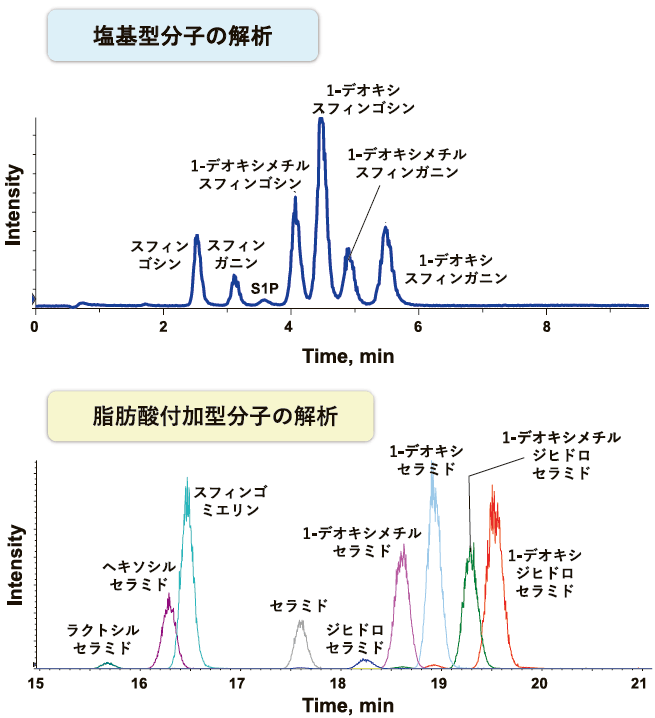
近年、若年性 ALS の家系において SPTLC1 遺伝子における変異が同定された。この変異は、SPT 活性を負に制御する ORMDL と相互作用する膜貫通ドメインに位置することから、SPT 活性の制御異常によるスフィンゴ脂質過剰産生が疑われた。そこで、ALS 型変異を有する SPTLC1 遺伝子を発現させた HEK293 細胞を用い、安定同位体標識した L- セリンを添加して de novo スフィンゴ脂質合成能の変化が検討された。その結果、ALS 型変異 SPTLC1 発現細胞において顕著なスフィンゴ脂質合成能の上昇が観察された 5)。また、筆者らは ALS 患者で新たに同定した、ORMDL3 に隣接する部位の SPTLC2 変異を有する ALS 発症者と、同一家系の変異を有しない非発症者の血漿について、LC-ESI-MS/MS を用いてスフィンゴ脂質分析を行った(図2)。その結果、ALS 発症者群の血漿において、デオキシスフィンゴ脂質を含むスフィンゴ脂質の有意な増加が観察された。これらのことから、過剰なスフィンゴ脂質生合成が ALS の病態発症メカニズムに関与することが明らかになった 6)。
5.遺伝性感覚性自律神経性ニューロパチーにおけるデオキシスフィンゴ脂質合成
遺伝性感覚性自律神経性ニューロパチー(HSAN)は、主に感覚神経に影響を及ぼす遺伝性の神経疾患である。痛覚障害による外傷に起因する感染により、壊疽・潰瘍や骨髄炎をおこし、足趾などの切断にいたる場合も少なくない。また、無汗症などの自律神経症状もみられる。 HSAN 患者においては、SPTLC1 遺伝子または SPTLC2 遺伝子のミスセンス変異が同定されており、これらの変異によって SPT の基質特異性に影響を与えてアラニンやグリシンへの親和性が高くなり、デオキシスフィンゴ脂質産生が亢進することが報告されている 2,7)。デオキシスフィンゴ脂質は、ミトコンドリアの断片化と機能障害を引き起こすため、特にエネルギー要求量が非常に高い末梢神経においてエネルギー不足を生じさせ、神経障害をもたらすと考えられている 8)。さらに、HSAN1 患者および SPT に変異を有しないⅡ型糖尿病患者において、HSAN1 の末梢神経障害と糖尿病性神経障害の臨床症状は非常によく似ており、血中デオキシスフィンゴ脂質の上昇という代謝的な表現型も一致する。これらのことから、両疾患の病態にデオキシスフィンゴ脂質が関与していることが示唆されている 9)。
また、デオキシスフィンゴ脂質の合成は、変異型 SPT によって顕著に誘導されるが、SPT に変異がない場合でもアミノ酸のアラニン/ セリン比が上昇することで合成量が増加することが筆者らのこれまでの研究において明らかになっている 10)。抗がん剤のパクリタキセルは、セリンレベルの低下および血中デオキシスフィンゴ脂質の上昇を引き起こす。パクリタキセルは副作用として末梢神経障害を生じるが、神経障害の発症率および重症度とデオキシスフィンゴ脂質レベルとの間に相関があることが報告されている 11)。糖尿病においても血中アラニンの上昇を伴う報告が複数あることから、アラニン/ セリン比の上昇を伴う神経障害においてデオキシスフィンゴ脂質が疾患の分子メカニズムに関与する可能性は少なくないと考えられる。
6.精神疾患におけるスフィンゴ脂質代謝異常
統合失調症は生涯リスクが約 1% の重度の精神疾患である。幻覚、妄想などの陽性症状、情動の平板化や自閉などの陰性症状、および認知機能障害を特徴とし、思春期から青年期の 10 代後半から 30 代に発症することが多い。統合失調症患者において脳梁を含む脳白質の容積の減少は数多く報告されており、患者の陰性症状と相関することが示されている 12)。加えて、統合失調症患者において、セリンなどのアミノ酸濃度や代謝酵素発現の変化、そしてスフィンゴ脂質の代謝変化が明らかになっている 13, 14)。そこで筆者らは、スフィンゴ脂質代謝と統合失調症病態の関連の解明を目指し、統合失調症患者群と対象群の死後脳のスフィンゴ脂質分析を行った。その結果、統合失調症患者の脳白質において S1P が約 30% 有意に減少していることが明らかになった。さらに、S1P の代謝酵素および受容体の遺伝子解析を行ったところ、統合失調症患者の脳白質において、S1P 分解の亢進による S1P 含量低下、およびその代償反応としての S1P 受容体遺伝子発現レベル上昇が引き起こされている可能性が示唆された 15)。
スフィンゴ脂質の一つで重要なシグナル伝達分子である S1P は、S1P 受容体を介して神経細胞の突起伸長やミエリン形成、造血細胞輸送、免疫細胞の運命決定を含む様々な機能の制御に関与している 16)。最近の研究では、アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患患者やそれらのモデルマウスにおいて、S1P 含有量や S1P 代謝に関連する遺伝子やタンパク質の発現レベルが低下することが報告されている 17-20)。したがって、我々の知見は、統合失調症患者の神経炎症、白質の減少、血液脳関門統合性やオートファジーの調節不全等の病理形成メカニズムに S1P 含量低下が関与する可能性を示した。また、(SO+Cer)/S1P 比の上昇は、アポトーシス、細胞周期の停止、細胞生存および細胞増殖の抑制を誘導する。我々は、この比率が統合失調症患者群において対照群よりも高い傾向を示すことを発見した。さらに、認知症を伴うことの多い ALS においても(SO+Cer)/S1P 比の上昇が観察されており 6)、神経変性疾患における精神障害にスフィンゴ脂質バランスの崩壊が関与する可能性が考えられる。
7.おわりに
近年、新たに発見された非定型デオキシスフィンゴ脂質は機能や代謝について未だ不明な点が多い。軸索が長いことからエネルギー要求量が非常に大きい末梢神経は、エネルギー不足に対して脆弱である。デオキシスフィンゴ脂質はミトコンドリア障害を引き起こすため、デオキシスフィンゴ脂質の合成が誘導される末梢神経障害の分子機構において重要な役割を果たしていると考えられている。また、ALS や精神疾患においてスフィンゴ脂質の過剰産生や含量低下などの代謝異常が報告されている。これらは、非定型デオキシスフィンゴ脂質の毒性だけでなく、スフィンゴ脂質合成バランスの崩壊が病理形成メカニズムに関与する可能性を示しており、末梢神経だけでなく中枢神経におけるスフィンゴ脂質の機能や代謝経路を明らかにすることが今後の重要な研究課題であると考える。これらを解明することがスフィンゴ脂質の代謝制御をターゲットとした治療法の開発に繋がり、神経変性疾患および精神疾患における新たな治療戦略となることが期待される。
| [ 著者プロフィール ] | |
| 氏名 | 江﨑 加代子(Kayoko Esaki) |
|---|---|
| 所属 |
崇城大学 生物生命学部 生物生命学科 〒860-0082 熊本県熊本市西区池田 4-22-1 TEL 096-326-3693 |
| 出身学校 | 宮崎大学/九州大学大学院 |
| 学位 | 博士(農学) |
| 専門分野 | 脂質生化学 |
| 現在の研究テーマ | スフィンゴ脂質の機能や代謝 |