ミトコンドリアダイナミクス研究のこれまで、そして今後の課題
Mitochondrial dynamics research: past and future perspective

石原 直忠
大阪大学大学院
理学研究科 生物科学専攻
教授
Abstract Mitochondria are essential organelles for intracellular energy production, and also have important functions in the metabolism and cellular signaling. Live cell imaging in cultured mammalian cells revealed that elongated network structure of mitochondria moves and change their morphology, with active fusion and fission. “Mitochondrial dynamics” has been actively studied for the past quarter century, and it has been revealed that mitochondrial dynamics are involved in the maintenance and quality control of mitochondrial function in various physiological and pathological conditions. However, the molecular details of the membrane dynamics including mitochondrial fusion and fission, especially their integrated regulation, remain largely unknown. The past progress and future prospects of this research field will be reviewed, with particular reference to the author's own research progress.
1. ミトコンドリアの融合と分裂によるダイナミクス
ミトコンドリアは酸素呼吸によって細胞内の主要な「エネルギー生産」を担う細胞小器官(オルガネラ)である。また、様々な物質の合成と分解からなる「代謝」や、細胞死・自然免疫応答等の「細胞応答」の制御においても重要な機能を持つ。これらの多彩な機能が変化することで細胞分化・細胞応答時の細胞変化を支えている。電子顕微鏡観察でミトコンドリアは内膜クリステを持つ2重膜の特徴的な構造として容易に特定でき、組織によって、また病変時にその構造を大きく変化させることも古くから知られていた。
組織切片の電子顕微鏡ではミトコンドリア断面の多くが円型または楕円形として観察され、ミトコンドリアのモデル図の多くは豆粒状の構造体として記載されてきた。しかし特異的な抗体や蛍光試薬、また蛍光タンパク質を用いてミトコンドリアを標識し蛍光顕微鏡下に観察を行うと、様々な哺乳動物培養細胞でミトコンドリアは一定の豆状構造ではなく、小さな粒子状の分布に加えて、細長く伸びたチューブがさらに枝分かれしたネットワーク状の構造体として観察される(図1)。さらに経時的に生細胞観察を行うと、ミトコンドリアが細胞内を活発に動きその形を変化させる様子を観察することができる。その動きの中で、複数のミトコンドリアが繋がり一つになる「融合」と、ちぎれて複数の小さなミトコンドリアになる「分裂」が頻繁に観察される(図2A)。このように、ミトコンドリアの大きさと形態は複雑な多様性を有し、その形態は融合と分裂を介して変動する。これらの現象・過程は「ミトコンドリアのダイナミクス」と呼ばれており、この四半世紀にわたり活発に研究されてきた1)。
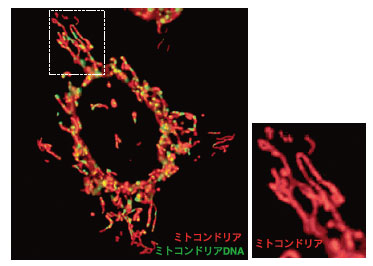
ミトコンドリアはMitoBright LT Deep Redで、ミトコンドリアDNAはSyberGreen Iで染色し、生細胞をLeica Thunder顕微鏡システムにて観察した(撮影:紺野創太 大阪大学理学部生物科学科)。ミトコンドリアの大きさと形態は複雑な多様性を有しており、その形態は融合と分裂を介して変動する。

ミトコンドリアの形態は融合と分裂のバランスにより維持されており、その変動によりミトコンドリアの大きさ・長さが変動する。
2.ミトコンドリアの融合と分裂を制御するGTPaseタンパク質群の同定
20世紀終盤において、酵母等のモデル生物の遺伝学およびヒトゲノムプロジェクト等の遺伝情報集積の両面から、ミトコンドリア形態制御に関与する遺伝子群の同定が進んだ(図2B)。中でもショウジョウバエの雄性不稔変異から同定された、精子形成時のミトコンドリア融合(この現象は昆虫に独特のものである)に関わる因子Fzoは酵母からヒトに至るまで種を超えて広く保存されており、哺乳動物ホモログとして2つのmitofusin(Mfn1, Mfn2)が同定された2)。その後Mfn2は、末梢神経障害となるCharcot-Marie-Tooth(CMT)病の原因遺伝子としても同定された。また、常染色体優性視神経萎縮症 Autosomal Dominant Optic Atrophy(ADOA)の原因遺伝子として同定されたOPA1は内膜の融合に機能することがわかった。一方で、神経細胞のシナプス小胞形成に関わるダイナミンに配列が類似したタンパク質であるダイナミン様タンパク質Drp1(Dlp1, Dnm1lとも呼ばれる)が、ミトコンドリア分裂に働くことが見出された。これらの初期研究から、「核ゲノムにコードされ、種を超えて保存されたGTPaseタンパク質群が融合・分裂に働く」ことが明らかになった3)。これらのGTPase群およびそれらの関連因子群の同定を契機として、ミトコンドリアダイナミクスの研究分野が大きく発展していった。一方で、植物細胞ではミトコンドリアの融合は活発に観察されるにもかかわらず4)、融合制御に関わる分子は未だに見いだされておらず、進化的な側面からも興味深い。
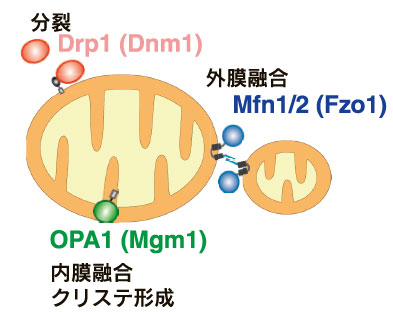
比較的分子量の大きい3つのグループのGTPaseタンパク質群は、核ゲノムにコードされており、ミトコンドリア2重膜のダイナミクスの制御に関わる。
3.ミトコンドリアダイナミクスの生理的な役割
(1) 融合と分裂のバランスによる形態制御
ミトコンドリアの融合と分裂に働く基本因子群が同定されたことで、生体における意義・役割の理解が進められるようになった。先行した酵母の遺伝学的解析から、融合因子を抑制すると分裂のみが進みミトコンドリアが短くなり、逆に分裂因子を抑制すると融合のみが進みミトコンドリアが長くなることが見出された。この結果に基づいて、「ミトコンドリアの形態は融合と分裂のバランスにより維持されており、その変動によりミトコンドリアの大きさ・長さが変動する」、とのミトコンドリアの形態制御の基本概念が提唱された(図2A)5)。
融合因子を欠損した酵母株は、非発酵培地では生存できず呼吸不全となるが、一方で分裂因子の欠損では、ミトコンドリアは長く網目状に繋がるものの、細胞増殖や酸素呼吸活性には大きく影響しない。興味深いことに、融合因子の機能抑制による呼吸不全は、分裂因子を同時に抑制することで、ミトコンドリア形態のみならず呼吸活性をもほぼ正常レベルに回復する。このことから、融合と分裂のバランスによってミトコンドリア機能が維持される、との細胞レベルにおけるミトコンドリアダイナミクスの生理機能の基盤が理解された。
これらの結果から、ミトコンドリアダイナミクスに関する根源的な疑問が生まれた。酵母の融合・分裂の2重欠損細胞では、ミトコンドリアはほぼ正常に機能しており、すなわち融合と分裂の制御は細胞・呼吸機能には必須ではない。それではなぜ融合・分裂を制御するGTPase 群は種を超えて保存されているのか、「細胞内におけるミトコンドリアの融合と分裂の重要性」という基本的な概念の研究・理解は未だに残されている。
(2) 細胞応答の制御
哺乳動物細胞においてミトコンドリア分裂因子を抑制すると、ミトコンドリアからのシトクロムcの放出が抑制され、細胞死が抑制されることがわかった6)。当時、急速に進展していた細胞死研究との関連性が見いだされ、ミトコンドリアダイナミクスが生命科学・医科学の分野から大きく注目を集める契機となった。後の解析により、様々なミトコンドリア形態制御因子がアポトーシス制御因子と関与すること、また逆にアポトーシス制御因子がミトコンドリア形態制御に関わることも見出され、「ミトコンドリアダイナミクスはエネルギー生産のみならず、細胞応答・制御においても重要な機能を持つ」、との基本概念が理解された。
これまでに、ミトコンドリア融合・分裂因子群の多くが細胞死制御因子群と関連・連携して機能することが見出されているが、一方で融合と分裂による膜の変形自体がどのように細胞死制御に関わるのか、なぜ多くの融合・分裂因子群がそれぞれに細胞死制御に関わる必然性があるのか、等の分子詳細にはまだ不明な点が多く残されている。
また、ミトコンドリアは抗RNAウイルスに対する自然免疫応答に関与することが知られており、ミトコンドリアダイナミクス関連因子がミトコンドリア代謝と自然免疫応答を仲介する役割を持つことも明らかになりつつある7, 8)。
(3) マウス個体内での生理機能の解析
ミトコンドリア融合因子Mfn1、Mfn2の遺伝子欠損マウスが構築され、その生理的意義の解析が進んだ9)。細胞レベルでの呼吸不全、初期発生期での胎生致死、また神経特異的Mfn2抑制による神経変性の誘導等の研究が進められ、それらの結果から「ミトコンドリアの融合は細胞レベルから個体レベルにおいてミトコンドリア機能維持に重要な働きを持つ」ことが強く示唆されている。
一方で、ミトコンドリア分裂の哺乳動物個体内での意義を知る目的で、我々は世界に先駆けてDrp1の遺伝子欠損マウス及び組織特異的欠損マウスを構築したところ、組織・分化細胞に応じて特徴的な表現型・病態が観察された10)(図3B)。Drp1欠損により呼吸不全となる組織、一方で呼吸活性低下が顕著に認められない組織もみられた。一例として、神経細胞ではミトコンドリア分布不全により、ミトコンドリアが大きくなりまた数が減少することで、神経突起内でのミトコンドリアの分布不全となり、シナプス形成不全・神経変性死が誘導された(図3A)。またDrp1を欠損したマウス卵子では、ATP濃度を正常に維持するものの、カルシウム応答の変動により卵子の成熟が不全となる。ミトコンドリアと小胞体の接触構造(MAM)を介してカルシウム応答が制御されており、卵子ではその制御にDrp1が関わる可能性が考えられる11)。
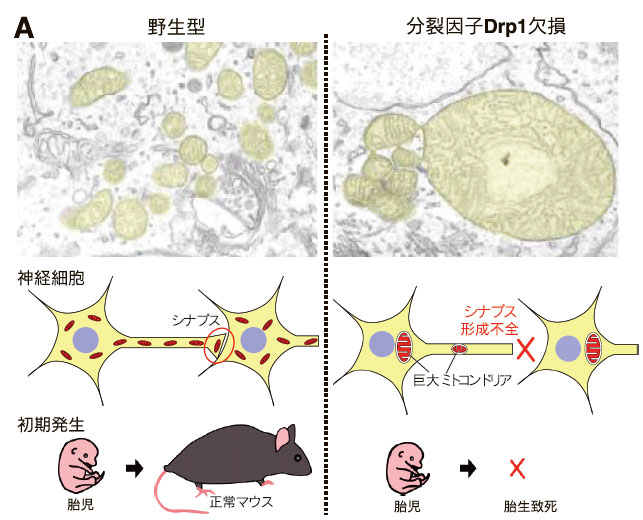
神経細胞のミトコンドリア分裂不全により、神経突起内でのミトコンドリアの分布不全・シナプス形成不全・神経変性死が誘導された。
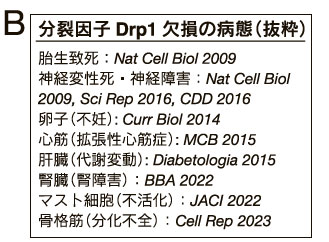
Drp1の遺伝子欠損マウス及び組織特異的欠損マウスを構築したところ、組織・分化細胞に応じて特徴的な表現型を示した。その中で筆者らの研究グループの関わる報告を抜粋した。
また我々は最近、骨格筋におけるミトコンドリア分裂の新しい役割を見出した12)(図4)。筋細胞はミトコンドリアの分裂抑制により筋萎縮となるが、その分子詳細は不明であった。我々は骨格筋特異的Drp1欠損マウス及びDrp1欠損培養筋芽細胞を用いて筋分化及び細胞応答への効果を詳細に解析したところ、Drp1を抑制すると速筋の分化が大きく低下することを見出した。Drp1抑制時には、ミトコンドリアの形態変化に伴いmTORC2の構成成分Rictorがミトコンドリアに効率的に局在し活性化すること、またミトコンドリア病のバイオマーカーとしても注目されているサイトカインGDF15が誘導され、これが速筋分化を抑制することを見出した。速筋のエネルギー生産は主に解糖系に依存しておりミトコンドリアが比較的少ないことが知られているが、Drp1は筋タイプに特異的な役割を持っており、速筋の分化・発達過程に関与する、との興味深い結果が得られた。
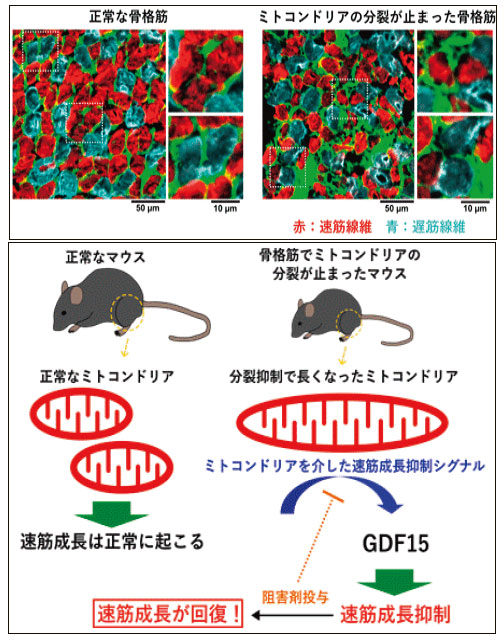
Drp1は筋タイプに特異的な役割を持っており、速筋の分化・発達過程に関与する。
4.ミトコンドリア融合の分子機構
(1) 2重膜の融合
哺乳動物細胞ではミトコンドリア外膜の融合に機能するMfn1とMfn2はGTPaseドメインを細胞質側に露出しており、外膜上で多量体を形成している(図2B)。また内膜の融合に機能するOPA1のGTPaseドメインは膜間スペース部分に存在している。外膜と内膜の融合は協調的に連携しながら起きると考えられており、実際に内膜融合因子OPA1を抑制するとミトコンドリアが断片化し、即ち外膜の融合も強く阻害されると考えられる。酵母細胞においては、外膜融合因子Fzo1と内膜融合因子Mgm1を繋ぐ外膜貫通タンパク質Ugo1が2重膜を協調的に融合させている。しかし哺乳動物細胞では2重膜が連携して融合する機構の理解はごく限られている。
(2) mitofusion による外膜の融合
外膜の2つのMfnタンパク質はGTP加水分解に依存して多量体を形成することで2つの外膜を結合させ(繋留)、その後に外膜の融合過程が起きると考えられている13)。しかし、膜結合後に膜が融合する分子機構はまだ十分には理解されていない。GTP加水分解の意義、膜融合のエネルギーはどのように与えられるのか、など興味深い問題が多く残されている。Mfnタンパク質の構造解析から複合体変化やGTP加水分解の意義が理解されつつあり、その発展が期待されている。
細胞内では、融合に先行して2つのミトコンドリアが近接し結合する必要がある。哺乳動物細胞ではミトコンドリアは主に微小管に沿って細胞内を移動するが、一方で微小管は融合に必ずしも必須ではない。ミトコンドリアの融合前の挙動は、融合の特異性(融合するべきミトコンドリアの選別・マッチング)に関与し品質管理の観点からも重要と考えられる。
(3) OPA1 による内膜の融合
内膜の融合に機能するOPA1は、GTPaseドメインを含むC末端側領域を膜間スペースに配向してN末端側の疎水性領域を内膜に挿入し(L-OPA1)、さらに膜貫通ドメイン近傍を内膜に存在するタンパク質分解酵素Oma1、あるいはYme1Lによりタンパク質切断を受ける(S-OPA1)。ヒトでは複数の選択的スプライシングによりOPA1の切断点及び切断効率が変化し、またこの切断により融合の活性が変動する14)。
ミトコンドリア融合の分子理解を目指して、我々は活性を保ったL-OPA1を発現・精製し、内膜を模したリン脂質組成の人工リポソームに組み込むことで、試験管内で生化学的に融合反応を観察できる実験系の構築に成功している15)。この反応系を用い、L-OPA1を持つ膜と、ミトコンドリア内膜に特異的なリン脂質カルジオリピン(CL)を持つ膜との間で、GTP加水分解エネルギーに依存した膜融合がおきる、との一方向性の独特な膜融合反応系を見出している。この実験系を用いて生化学解析を進めることで、OPA1による内膜融合の分子詳細の理解が可能となった。特にOPA1はミトコンドリア活性に応じて融合活性を大きく変動させるため、ミトコンドリアの機能制御・品質管理に重要な役割を持つと考えられている。この試験管内反応系を活用して、ミトコンドリアの機能低下を抑制し、さらに活性化する分子(新規タンパク質・化合物)の同定が期待される。
5.ミトコンドリア分裂の分子機構
(1) Drp1のミトコンドリア局在化受容体群
ミトコンドリアの分裂にはダイナミン様タンパク質Drp1が機能しており、これらにより細胞質に分布するDrp1がミトコンドリア分裂点に集められる。酵母でDrp1受容体として見出されたFis1は哺乳動物にも保存されているが、HeLa細胞を用いた我々の解析系では、Fis1の抑制によるDrp1局在化やミトコンドリア分裂への効果は限定的であった16)。一方で、哺乳動物細胞ではDrp1の局在化に関わる主要因子としてMff、MiD49、MiD51が見出されており、これらがそれぞれ独特な分裂制御に関わると考えられる17)。ミトコンドリア分裂時には、必ずしもミトコンドリアの中央で分裂するわけではなく、しばしば2つは不均等なミトコンドリアとなる。受容体により中央付近での切断と、末端付近での分裂が起きる可能性が議論されている。しかしこれらの機能分担の詳細はまだ十分には理解されていない。
(2) 2重膜を分裂させる分子機構
ミトコンドリアの分裂点に集められたDrp1は多量体を形成してミトコンドリアに巻き付き、GTP加水分解に伴う構造変化によりその直径が小さく絞り込まれることで膜が切断されると考えられている。一方で、細胞内でミトコンドリアを取り囲むDrp1によるリング構造は(一部の藻類等を除き)ごく限られた観察例しか知られていない。これまでの解析は主に大腸菌で発現・精製したタンパク質が利用されているが、多量体化や膜結合に関して、これらの実験では生理的な状況を反映しているのか、との疑問も残されている。生体内での挙動の本質解析を進めるための新しい解析系の構築などのブレイクスルーが必要であろう。
また、ミトコンドリア内膜は膜電位が維持されているが、現在のモデルではDrp1が細胞質側から2重膜を一気にくびり取り、2重膜のそれぞれがうまく繋がって分裂が起きるとされている。酵母では内膜の分裂を促進するタンパク質が近年見出されており18)、哺乳動物においても2重膜を分裂させる機構理解の進展が期待されている。
6.今後の展望と期待
近年の生命科学において、生理・病理におけるミトコンドリアの多彩な役割の理解が大きく発展している。ミトコンドリアはさらにその重要性を増し、広い研究分野で活発に研究が進められている。しかし、ミトコンドリア自体の理解、すなわちどのように維持され、増加し、遺伝していくか、(たとえば、リン脂質等の膜成分の合成と輸送、複雑な2重膜構造の形成と制御、ミトコンドリアDNAのミトコンドリア内・娘細胞での配置、ミトコンドリアの量の制御)、等の基盤的理解はまだ不十分であるにも関わらず、応用を目指したミトコンドリア関連研究のフロンティアは広がるばかりである。
日本の若い研究者が基礎的な観点からミトコンドリアの本質を理解する研究に参入し、ミトコンドリア理解の飛躍的発展に活躍してくれることを強く期待している。
| [ 著者プロフィール ] | |
| 氏名 | 石原 直忠(Naotada Ishihara) |
|---|---|
| 所属 |
大阪大学大学院 理学研究科 生物科学専攻 教授 〒560-0043 大阪府豊中市待兼山町1-1 |
| 出身学校 | 九州大学 |
| 学位 | 博士(理学) |
| 専門分野 | 細胞生物学、生化学、分子生物学 |
| 現在の研究テーマ | オルガネラ膜のダイナミクス、ミトコンドリアの構造制御、膜の融合と分裂 |