はじめに
エンドサイトーシスは、細胞膜由来の小胞(エンドソーム)を介した細胞内取り込み機構で、リソソームへ内在化 (インターナリゼーション) を行うプロセスです。このプロセスは、免疫応答やアポトーシスを起こした細胞の除去、代謝や細胞シグナル伝達にとって重要です 1)。本キットは、pH感受性蛍光プローブによる標識用キットです。キット付属の NH2-Reactive AcidSensor は、その分子内に活性エステル基を有しているため、アミノ基を有する標的分子と混合するだけで安定な共有結合を形成します。AcidSensor は中性でほとんど蛍光を示さず、酸性環境下で強い蛍光を示す蛍光プローブです。 そのためエンドサイトーシスによって取り込まれたAcidSensor標識体が細胞内で酸性化されると蛍光を発します。また、AcidSensor 標識体の蛍光特性は 633 nm で励起可能であるため、緑色や赤色蛍光色素との多重染色 による様々な実験系への適応が可能です。
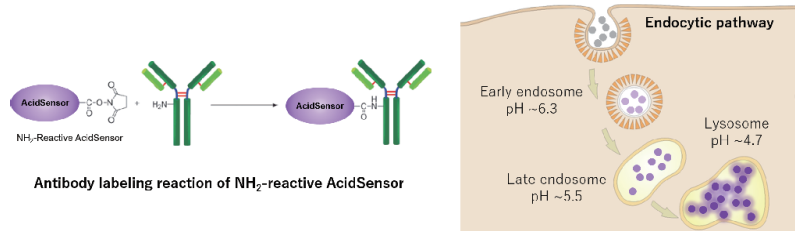
図1. AcidSensor の反応原理とエンドサイトーシス経路
内容
| NH2-Reactive AcidSensor | 3 tubes |
| Reaction Buffer | 4 ml x 1 |
| WS Buffer | 500 μl x 1 |
| Filtration Tube | 3 tubes |
保存条件
遮光、 0–5℃にて保存してください。
- NH2-Reactive AcidSensor は、アルミラミジップに 3 本入っています。アルミアミジップを一旦開封した後は、未使用の NH2-Reactive AcidSensor はアルミアミジップに入れたまま、チャックをしっかりと閉め、-20℃で保存して下さい。NH2-Reactive AcidSensor 以外は 0-5℃ で保存して下さい。
必要なもの
- Dimethyl sulfoxide (DMSO)
- 細胞培養用培地
- Hanks’ Balanced Salt Solution (HBSS)、または血清無し培地
- 遠心機
- マイクロピペット
- マイクロチューブ
使用上の注意
- 分子量が 50,000 以上で、反応性のアミノ基を有するサンプルへ標識することができます。
- 試料溶液中に標識対象以外の分子量 10,000 以上の物質 ( 血清アルブミン、ゼラチンなど ) が含まれる場合は、 標識反応を阻害する恐れがあります。標識にはあらかじめ精製された試料溶液をご使用ください。
- 試料溶液に不溶性の低分子物質が含まれる場合は、遠心して上清のみを標識反応に用いてください。
- 冷蔵保存中もしくは室温に戻した際に、Filtration Tube に水適様の液滴が見られることがあります。 これはメンブランの乾燥防止剤の液滴であり、製品の性能に問題はございません。
操作
AcidSensor 標識体の調製
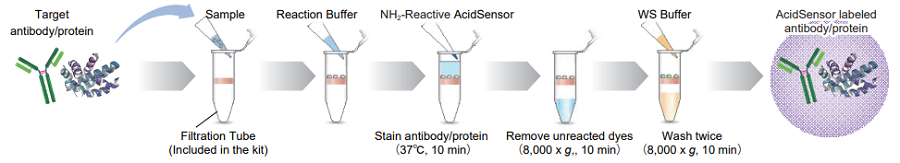
図2. AcidSensor 標識プロトコル
- タンパク質 50–200 μg を含むサンプル溶液と WS Buff er 100 μl を Filtration Tube に入れ、ピペッティングにより 混合する。
- 100 μl 以下の液量を使用してください。タンパク質濃度が 0.5 mg/ml 未満の場合、操作 1 と 2 を繰り返し、50–200 μg となるようにしてください。
- 8,000 x g で 10 分間遠心後、ろ液を捨てる。
- 溶液がメンブレン上に残っている場合は、さらに 8,000 x g で 5 分間遠心してください。
- NH2-Reactive AcidSensor を含むチューブに 10 μl の DMSO を加え、ボルテックスミキサーにより溶解し、DMSO solution を調製する。
- Filtration Tube のメンブレン上に Reaction Buff er 100 μl を加えた後、NH2-Reactive AcidSensor DMSO Solution 全量を加える。
- ピペッティングにより混合した後、37 ℃で 10 分間インキュベーションする。
- WS Buff er 100 μl を Filtration Tube に入れ、8,000 x g で 10 分間遠心する。ろ液を捨てる。
- 溶液がメンブレン上に残っている場合は、さらに 8,000 x g で 5 分間遠心してください。
- WS Buff er 200 μl を Filtration Tube に入れ、8,000 x g で 10 分間遠心する。この操作をもう一度繰り返す。
- 溶液がメンブレン上に残っている場合は、さらに 8,000 x g で 5 分間遠心してください。
- WS Buff er 100 μl を Filtration Tube に入れ、10 回程度ピペッティングし、標識体を新しいマイクロチューブに移す。
- AcidSensor 標識体を回収する際は WS Buff er を使うことを推奨しますが、必要に応じて各種の 溶液をご使用ください。
細胞への AcidSensor 標識体の添加
- 細胞を播種し、5% CO2 存在下、37 ℃で一晩インキュベートする。
- 培地を取り除き、血清なし培地 200 µl で 1 回洗浄する。
- 必要に応じて、血清含有培地や HBSS もご使用いただけます。
- 培地を取り除き、新しい血清無し培地 200 µl を加える。
- 必要に応じて、血清含有培地や HBSS もご使用いただけます。
- 回収した AcidSensor 標識体 10 µl を細胞に添加し、5% CO2 存在下、37 ℃で 1 – 24 時間インキュベートする。
- 細胞種によって最適濃度が異なります。はじめてご使用される際には最適条件をご検討ください。
- 培地を取り除き、血清無し培地 200 µl で 2 回洗浄する。
- 必要に応じて、血清含有培地や HBSS もご使用いただけます。
- 培地を取り除き、新しい細胞培養用培地を加え、蛍光顕微鏡で観察する。
実験例
BSA、Mouse IgG の AcidSensor 標識
- Filtration Tube に 1 mg/ml BSA または 1 mg/ml Mouse IgG 100 µl を入れた。さらに WS Buffer 100 μl を入れ、 ピペッティングにより混合した。
- 8,000 x g で 10 分間遠心を行い、ろ液を捨てた。
- NH2-Reactive AcidSensor を含むチューブに 10 μl の DMSO を加え、ボルテックスミキサーにより溶解し、DMSO solution を調製した。
- Filtration Tube のメンブレン上に Reaction Buffer 100 μl を加え、さらに NH2-Reactive AcidSensor DMSO Solution 全量 (step 3) を加えた。
- ピペッティングにより混合した後、37 ℃で 10 分間インキュベーションした。
- WS Buffer 100 μl を Filtration Tube に入れ、8,000 x g で 10 分間遠心後、ろ液を捨てた。
- WS Buffer 200 μl を Filtration Tube に入れ、8,000 x g で 10 分間遠心した。この操作をもう一度繰り返した。
- WS Buffer 100 μl を Filtration Tube に入れ、10 回のピペッティング後、溶液を新しいマイクロチューブに移した。
HeLa 細胞を用いた AcidSensor 標識 BSA、Mouse IgG の取込実験
- µ-slide 8 well plate (ibidi) に HeLa 細胞 (1×104 cells/well) を播種し、10% FBS を含む minimum essential media (MEM) を用い、 5% CO2 存在下、37 ℃で一晩インキュベートした。
- 培地を除き、200 µl MEM で 1 回洗浄し、新しい MEM を 200 µl 加えた。
- AcidSensor 標識 BSA、または AcidSensor 標識 Mouse IgG を各 well に 10 µl (10 μg 相当量 ) 添加した。
- 5% CO2 存在下、37 ℃で 2 時間インキュベーションした。
- 培地を取り除き、200 µl MEM で 2 回洗浄した。
- 培地を取り除き、新しい 10% FBS を含む MEM を 200 µl 入れ、共焦点顕微鏡で観察した。
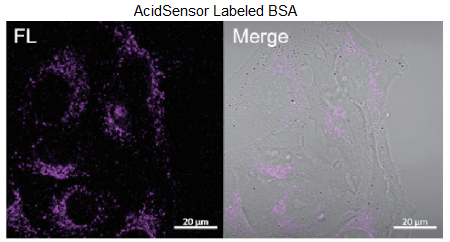
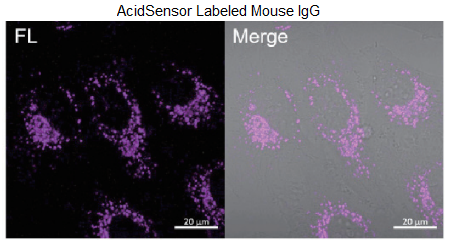
図 3. エンドサイトーシス経路を介した BSA と Mouse IgG 取り込みの可視化
<観察条件> Ex : 633 nm, Em : 650–700 nm
参考文献
1) Kangqiang, Q. et al., Adv. Healthcare Mater., 2022, 11(8), 2102185.
よくある質問/参考文献
A558: AcidSensor Labeling Kit – Endocytic Internalization Assay
Revised Jun., 19, 2023


 を押して省略できます。
を押して省略できます。