はじめに
バイオフィルムは、微生物とその代謝物である細胞外多糖から構成される集合体で、あらゆる環境に存在しています。医療器具内の細菌汚染やう蝕・歯周病の感染症はバイオフィルムが要因とされており、様々な分野でバイオフィルムの関与が指摘されています。バイオフィルム内の微生物は抗生物質等に対して強い耐性を獲得しているため、バイオフィルムによる汚染は深刻な問題となっています。そのため抗バイオフィルム活性を有する薬剤や食品成分の探索が注目を集めています。
Biofilm Formation Assay Kitはクリスタルバイオレット染色法によりバイオフィルム形成量および薬剤のバイオフィルム形成阻害を測定することができます。蓋に固定されたペグにバイオフィルムを形成させるため、洗浄・染色操作によりバイオフィルムが剥がれることがなく、多検体を簡便に測定することが可能です。
キット内容
| 96 tests | |
| Crystal Violet Solution | 22 ml×1 |
| 96-peg Lid | ×1 |
| 96-well Plate | ×10 |
保存条件
冷暗所にて保存してください。
必要なもの (キット以外)
- プレートリーダー(590 nmの吸光フィルター)
- インキュベーター(37℃)
- 20–200 μlのマルチチャンネルピペット
- エタノール
- 生理食塩水
使用上のご注意
- キットには滅菌済みの96-well Plateが10枚添付されています。開封後は使用時まで滅菌状態を保ち、各工程で新しい96-well Plateをご使用ください。
- バイオフィルム形成条件(培地・培養時間等)は微生物種により異なります(表1参照)。バイオフィルム形成条件を確立後、バイオフィルム形成阻害測定を行ってください。
操作
バイオフィルム形成量・バイオフィルム形成阻害測定
-
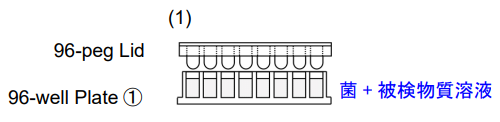
1. 96-well Plate①の各ウェルに菌懸濁液※180 μlを入れ る。96-peg Lidを被せてインキュベーター内で37°C で培養する(ペグ上にバイオフィルムが形成される)。
- バイオフィルム形成阻害を測定する場合は、種々の濃度の被 検物質を含む菌懸濁液180 μlを入れてください。
-
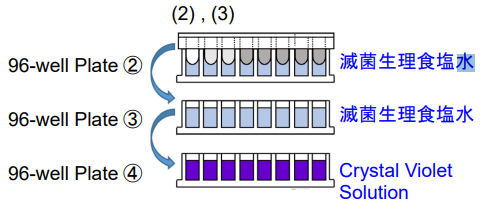
2. 96-well Plate②、96-well Plate③の各ウェルに滅菌 生理食塩水200 μlを、96-well Plate④の各ウェルにCrystal Violet Solution 200 μlを入れる。
3. 96-well Plate②、96-well Plate③に手順(1)の96- peg Lidを順次浸して洗浄する※。続けて96-well Plate④に96-peg Lidを被せて室温で30分静置する。
- 洗浄の際は、96-peg Lidを緩やかに生理食塩水に浸し、激しい振とうは避けてください。
-
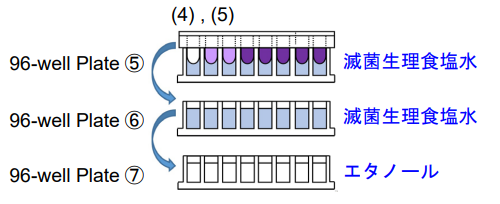
4. 96-well Plate⑤、96-well Plate⑥の各ウェルに滅菌生 理食塩水200 μlを、96-well Plate⑦の各ウェルにエタ ノール200 μlを入れる。
5. 96-well Plate⑤、96-well Plate⑥に手順(3)の96- peg Lidを順次浸して洗浄する※。続けて96-well Plate⑦に96-peg Lidを被せて室温で15分静置する。
- 洗浄の際は、96-peg Lidを緩やかに生理食塩水に浸し、激しい振とうは避けてください。
-
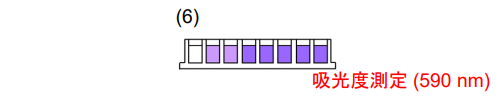
6. 96-peg Lidを取り外し、マイクロプレートリーダーで 590 nmの吸光度を測定する。
実験例
ε-Poly-L-lysineによるバイオフィルム形成阻害実験例:Staphylococcus aureus
- 培養した菌懸濁液をMueller-Hinton broth(MHB)培地で約107 CFU/mlとなるように希釈し播種用菌液とし、96- well Plate①の各ウェルに180 μlずつ播種した。
- MHB培地で10000 μg/ml ε-Poly-L-lysine (被検物質)を調製し、フィルター滅菌濾過した。10000 μg/ml ε-Poly-L- lysineを約107 CFU/ml菌懸濁液にて5倍希釈し、2000 μg/ml ε-Poly-L-lysine溶液を調製した。2000 μg/ml ε-Poly- L-lysine溶液180 μlを手順 1 の96-well Plate①の一番左端のウェルに入れた。ピペッティングにて混合し、順次倍々希釈して、ε-Poly-L-lysineの 2 倍希釈系列(各ウェルに180 μl)を調製した。96-peg Lidを被せ、37℃で24時間インキュベートした。 (1000, 500, 250, 125, 62.5, 31.2, 15.6, 7.8, 3.9, 1.95, 0.98, 0 μg/ml)
- 96-well Plate② 上で菌を含まないMHB培地を用いて手順 1, 2 と同様のε-Poly-L-lysineの希釈系列(各ウェル に180 μl)を調製し、手順 2 の96-peg Lidを被せ、37℃でさらに72時間インキュベートした。
- 96-well Plate③上でMHB培地を用いて手順 3と同様にε-Poly-L-lysine希釈系列(180 μl/ well)を調製し、手順 3 の96-peg Lidを被せ、37℃でさらに24時間インキュベートした。
- 96-well Plate④、96-well Plate⑤の各ウェルに滅菌生理食塩水200 μlを入れた。96-well Plate⑥の各ウェルに Crystal Violet Solution 200 μlを入れた。
- 手順 4 の96-peg Lidを96-well Plate④、96-well Plate⑤に順次浸して、2回洗浄した。続けて96-well Plate⑥ に96-peg Lidを被せ、室温で30分静置した。
- 96-well Plate⑦、96-well Plate⑧の各ウェルに滅菌生理食塩水200 μlを入れた。96-well Plate⑨の各ウェルに エタノール 200 μlを入れた。
- 手順 6 の96-peg Lidを96-well Plate⑦、96-well Plate⑧に順次浸して、2回洗浄した。続けて96-well Plate⑨ に96-peg Lidを被せ、室温で15分静置した。
- 96-peg Lidを取り外し、マイクロプレートリーダーを用い590 nmの吸光度を測定した。
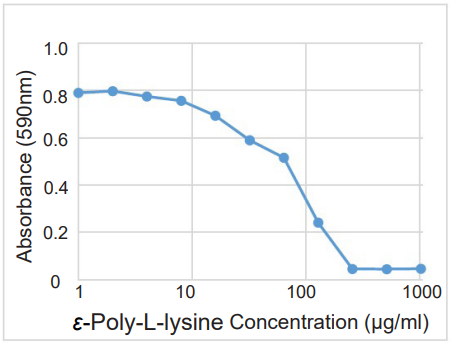
図1 S. aureusバイオフィルム形成阻害
-
ε-Poly-L-lysineのS. aureusバイオフィルムに対するMBIC(最小バイオフィルム形成阻害濃度)が約250 μg/mlであることが確認できた。
| 菌種 | 菌希釈培地 | 接種菌濃度 [CFU/ml] |
培養時間 [h] |
被検物質希釈用培地 | 培養雰囲気 |
| Pseudomonas aeruginosa | Brain heart infusion broth | 106 | 24 | MHB | 好気条件下 |
| Escherichia coil | Brain heart infusion broth | 107 | 24+72+24 | MHB | 好気条件下 |
| Streptococcus mutans | TSB+2%Sucrose | 107 | 24+72 | TSB+2%Sucrose | 嫌気条件下 |
| Porphyromonas gingivalis | Enriched BHI | 107 | 24+72 | Enriched BHI | 嫌気条件下 |
Enriched BHI:hemin 5 μg /ml、 menadione 0.5 μg /ml を含むenriched BHI broth(3.7% brain heart infusion、0.5% yeast extract、0.05% cysteine)
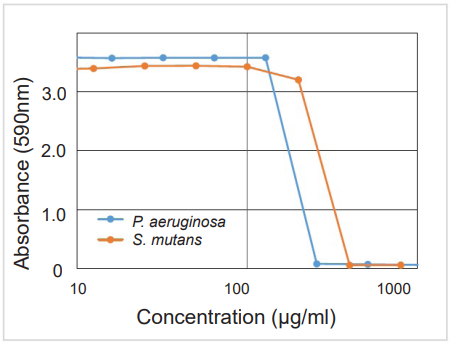
図2 バイオフィルム形成阻害
-
被検物質:P. aeruginosa / Protamine sulfate
S. mutans / 4-Isopropyl-3-methylphenolProtamine sulfateのP. aeruginosaバイオフィルムに対するMBIC(最小バイオフィルム形成阻害濃度)が約250 μg/ml、4-Isopropyl-3-methylphenolのS. mutansバイオフィルムに対するMBICが約400 μg/mlであることが確認できた。
参考文献
- T. Tsukatani, et al., J. Microbiol. Biotech. Food Sci., 2016, 6, 677–680
本キットは福岡県工業技術センター生物食品研究所との共同開発品です。
よくある質問/参考文献
B601: Biofilm Formation Assay Kit
Revised May., 31, 2023


 を押して省略できます。
を押して省略できます。