はじめに
老化細胞を96 ウェルプレートで評価する際には、細胞数に応じたSA-β-gal の変化を確認することで、より信頼性の高い測定値を得ることができます。本プロトコルでは、96 ウェルプレートにて培養した細胞について、小社のCellular Senescence Plate Assay Kit - SPiDER-βGal[製品コード:SG05]及びCell Count Normalization Kit[製品コード:C544]にて評価する際の操作手順を示した96 穴プレート専用のプロトコルです(96 穴プレート以外はご使用になれません)。本プロトコルでの実験の前に、各製品の取扱説明書に記載された取扱い条件や溶液調製、測定操作を必ずご確認ください。
使用製品
キット以外に必要なもの
- Phosphate buffered saline (PBS)
- 96 穴ブラックプレート(透明底)
- インキュベーター(37 ℃ )
- マイクロピペット(100–1000 μl, 20–200 μl)
- Dimethylsulfoxide (DMSO)
- コニカルチューブ
- 蛍光プレートリーダー
- マルチチャンネルピペット (20–200 μl)
操作の概要
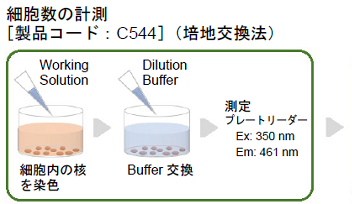
細胞数の計測
Cell Count Normalization Kit を使った評価
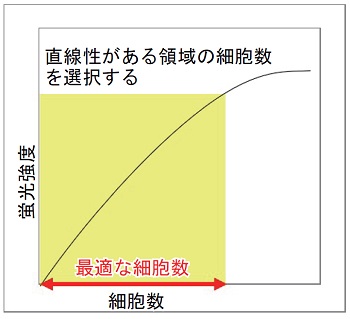
細胞数計測の際は、段階希釈した細胞による検量線(X 軸:細胞数、Y 軸:蛍光強度) を作成し、細胞数と蛍光強度に直線性がある範囲内の細胞数を事前にご確認ください。確認の際は、細胞をプレートに播種後、老化細胞の評価時と同じ培養時間で培養した細胞をお使いください。
細胞数の目安:1,000-30,000 cells/well(付着細胞)、5,000-60,000 cells/well(浮遊細胞)
-
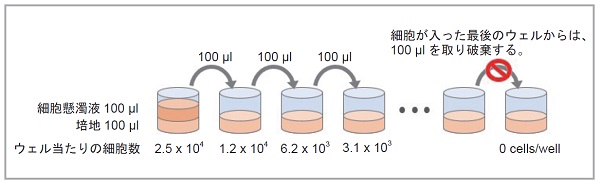
細胞の段階希釈方法
8 チャンネルマルチピペットを用いて、96 穴プレートの各ウェルに培地100 μl を入れる。次に、5 × 105 cells/ml に調製した細胞懸濁液100 μl を細胞数が最大となるウェルに加えてピペッティングする。その後、細胞濃度が半分となった細胞懸濁液100 μl を次のウェルに移して、同様にピペッティングにて混合する。以降、この操作を繰り返す。
-
最適な細胞数の確認方法
得られた蛍光強度を縦軸に、細胞数を横軸にプロットし、細胞数と蛍光強度でプロットし直線性がある領域の細胞数を選択する。
溶液調製
Staining SolutionをDilution Bufffferで500倍希釈しWorking solutionを作成する。
- Working solution は保存できません。その日のうちにお使いください。
- 1 ウェル(96 穴プレート)あたり100 μlのWorking solutionが必要です。
測定法
- 老化誘導した細胞※1およびコントロールの細胞を培地に懸濁後、100 μlをプレートに加え播種し、37 °C、5% CO2インキュベーターで一晩培養する。
また試薬ブランク※2測定のため、細胞を含まない培地100 μlをプレートに添加しておく。 - Working solutionを全てのウェルに100 μlずつ添加する。
- 37 °C、5% CO2インキュベーターで30 分間インキュベートする。
- 上清全量を取り除き、全てのウェルにDilution Bufferを100 μlずつ添加する。
- 蛍光プレートリーダーで測定する。(Ex: 350 nm, Em: 461 nm)
- 老化誘導はディッシュ等で行い、その後、細胞を96 ウェルプレートに移して測定することを推奨します。小社 HP の FAQを参照ください。
また、Doxorubicin 処理により老化誘導した実験例をCellular Senescence Plate Assay Kit - SPiDER-βGal [製品コード:SG05] の取扱説明書( 実験例 2) に掲載しています。 - 細胞数を計測する際、細胞を含むサンプルの蛍光強度から試薬ブランクの蛍光強度を差し引く必要があります。試薬ブランクのウェルではWorking solution添加、上清除去およびDilution Buffffer添加の操作を細胞を含まないウェル中で行ってください。
老化細胞の評価
Cellular Senescence Plate Assay Kit - SPiDER-βGalを使った評価
溶液調製
SPiDER-βGal DMSO stock solutionの調製
SPiDER-βGal を含むチューブに DMSO 125 μl を加え、ボルテックスミキサー等により溶解し、SPiDER-βGal DMSO stock solutionを調製する。
SPiDER-βGal working solutionの調製
SPiDER-βGal DMSO stock solution を Assay Buffffer で 10 倍希釈し、SPiDER-βGal working solution を調製する。
- SPiDER-βGal working solutionは保存できません。その日の内にお使い下さい。
- ウェル(96 穴プレート)あたり SPiDER-βGal working solution 50 μlが必要です。
測定法
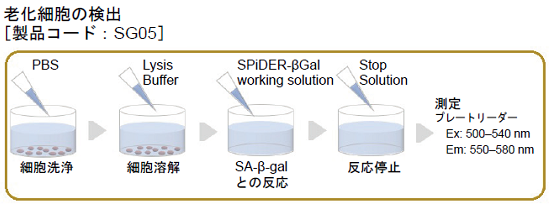
- 「細胞数の計測」の操作 5で測定したプレート中の上清を除去し、PBSで1回洗浄する。
- Lysis Buffer 50 μlを添加し、室温で10分間インキュベートする。
- SPiDER-βGal working solution 50 μlを各ウェルに添加し、37 ℃で30分インキュベート※1する。
- 各ウェルにStop Solution※2 100 μlを添加する。
- 蛍光プレートリーダーで測定する (Ex: 500–540 nm, Em: 550–580 nm)※3。
- コントロール細胞と老化細胞の SA-β-gal 活性の差が見られない場合は、インキュベーション時間を長く(30 分から一晩まで)してください。
- Stop solutionを添加すると反応が止まります。最適なインキュベーション時間決定後にStop solutionをお使い下さい。
- 測定値に差が見られない場合は、励起光の漏れ込みにご注意ください。
老化細胞の算出
化細胞の評価で得られたSPiDER-βGalの蛍光値を、細胞数の計測で得られた核酸染色の蛍光値で補正し、細胞数に応じたSA-β-gal活性を算出する。


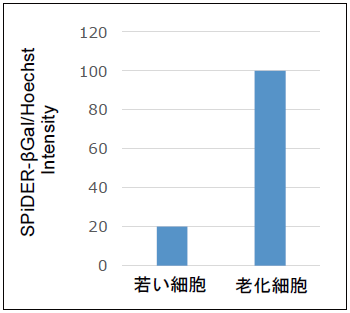
細胞数補正後の老化細胞検出例
C544_SG05: 併用プロトコル Cellular Senescence Plate Assay Kit - SPiDER-βGal Cell Count Normalization Kit
Revised Jun., 27, 2023


 を押して省略できます。
を押して省略できます。