はじめに
エンドサイトーシスは細胞膜由来の小胞(エンドソーム)を介した細胞内取り込み機構です。この過程において、様々な栄養因子を取り入れるだけでなく、細胞内外の不要物をリソソームに輸送し分解することで細胞の恒常性維持に寄与しています。このエンドサイトーシスの破綻が神経変性疾患や免疫疾患と密接に関わっていることが近年明らかとなり、注目を浴びています。生細胞における解析にはエンドサイトーシスで取り込まれるデキストラン等を蛍光標識したプローブが汎用されています。しかしながら、デキストランはその大きさによって取り込まれる経路や細胞内動態が変化することが知られており、より正確にエンドサイトーシス経路を解析できるツールが求められています。
ECGreenは細胞膜非透過性の低分子蛍光色素であり、細胞膜上に滞留します。その後エンドサイトーシスによって取り込まれ、小胞内の酸性環境に応答して蛍光強度が増大します。蛍光標識デキストラン等とは異なり、ECGreenは取り込まれたエンドソーム膜を直接染色するためより正確にエンドサイトーシス経路をライブイメージングすることが可能です。
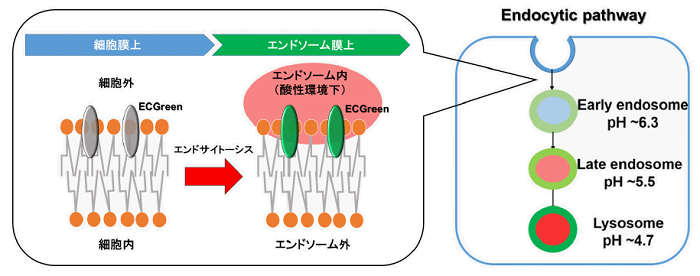
図1. エンドサイトーシス検出機序
蛍光特性
ECGreenの蛍光特性
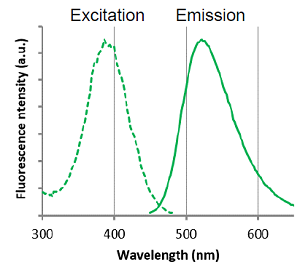 |
λex: 386 nm |
内容
| E296 ECGreen-Endocytosis Detection | 40 μl x 1 (35 mm dish 20枚分) |
保存条件
-20 oCにて保存してください。
必要なもの
- 培地
- HBSSまたはPBS
- マイクロピペット
- マイクロチューブ
溶液調製
ECGreen working solution の調製
ECGreen溶液を培地で1000 – 5000倍希釈し、ECGreen working solutionを調製する。
- 細胞種によって最適濃度が異なります。はじめてご使用される際には最適条件をご検討ください。
- Working solutionは保存できません。調製したその日のうちに、ご使用ください。
操作
- 細胞をディッシュに播種し、5% CO2存在下、37 oCで培養する。
- 培地を取り除き、HBSS、PBSもしくは培地を用いて1回洗浄する。
- ECGreen working solutionを加え、5% CO2存在下、37 oCで10分 – 24時間インキュベートする。
- 上澄みを取り除き、HBSS、PBSもしくは培地を用いて2回洗浄する。
- 培地を加え、蛍光顕微鏡で観察する。
実験例
共焦点蛍光顕微鏡を用いた低温培養によるエンドサイトーシス阻害の観察
- μ-slide 8 well plate (ibidi社) にHeLa細胞(1.0 x 104 cells/well)を播種し、5%CO2存在下、37oCで一晩培養した。
- エンドサイトーシス阻害条件群は染色の前に4oCで30分プレインキュベートを行った。
- PBSで1回洗浄後、10% FBS含有MEM培地で調製したECGreen working solution (1000倍希釈) をwellに200 μl加え、37 ℃ (通常条件) もしくは4oC '阻害条件) で30分インキュベートした。
- 培地を取り除き、PBSで2回洗浄した。
- 新しい10% FBS含有MEM培地をwellに200 μl加え、共焦点蛍光顕微鏡で観察した。
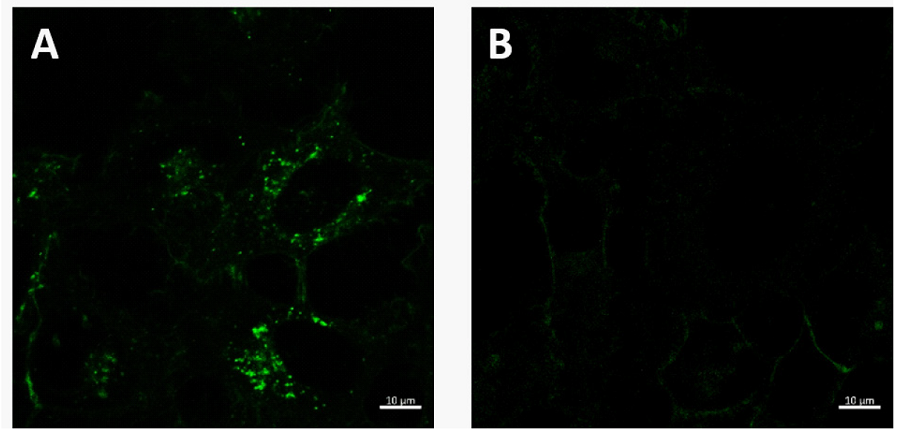
図2. 低温培養下でのエンドサイトーシス変化
A: 通常培養条件 (37℃)、B: エンドサイトーシス阻害条件 (4℃)
ECGreen 検出波長 : 405 nm (Ex), 500 – 560 nm (Em)
よくある質問/参考文献
E296: ECGreen-Endocytosis Detection
Revised Apr., 18, 2023


 を押して省略できます。
を押して省略できます。