はじめに
細胞が分泌する細胞外小胞 (Extracellular vesicle: EV) の一種であるエクソソームは、様々なタンパク質や核酸などを内包しており、エクソソームを介して内包物質が伝達されることで、受け手側の細胞に様々な影響を与えることが明らかとなっております1)。近年ではエクソソームに関する多くの研究が報告されており、がん研究分野におけるがんの悪性化や転移、間葉系細胞由来エクソソームを応用した治療研究、エクソソームの内包物質を分析対象とする診断研究など、多くの研究に関わる非常に重要な研究ツールです。
ExoIsolator Exosome Isolation Kit は超遠心法と同等の回収率で細胞培養上清由来のエクソソームを得ることができるエクソソーム精製キットです。本キットは、培養上清をフィルトレーションするだけでフィルター上にエクソソームがトラップされるため、複雑な操作が必要なく、短時間でのエクソソーム回収が可能です。
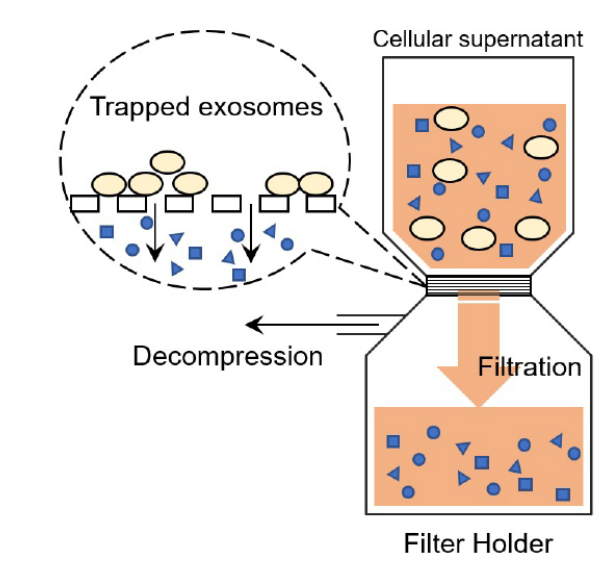
図1 精製の原理
(特許出願中)
キット内容
-
EX10 : ExoIsolater Exosome Isolation Kit Filter Holder x 1 Isolation Filter x 3 ピンセット x 1
-
EX11 : ExoIsolater Isolation Filter Isolation Filter x 10
保存条件
常温で保存してください。
必要なもの (キット以外)
- アスピレーター
- 細胞上清の吸引など、一般的に細胞実験で使用されているアスピレーターをご準備下さい。吸引圧は -25 kPa または-25 kPaよりも弱い吸引圧に設定してください。
- 0.22 μm 滅菌ろ過フィルター
- 細胞培養上清を前処理し、夾雑物を減らす目的で使用します。
- マイクロピペット
- 1.5 ml チューブ
- PBS (-)
使用上のご注意
- ExoIsolator Exosome Isolation Kitに含まれる Filter Holder は滅菌処理されておりません。使用前に洗浄、オートクレーブ滅菌を行ってください。Filter Holder は繰り返し使用することができます。
- Isolation Filter はディスポーザブルです。実験に際し、追加で Isolation Filter が必要な場合は、Isolation Filterを10 枚セットにした ExoIsolator Isolation Filter (EX11)をご購入ください。
- Isolation Filter は非常に薄く破れやすいため、取扱いにご注意ください。Isolation Filter の取扱いには、付属のピンセットをご使用ください。
- Isolation Filter には表裏があり、光沢のある面が表、マットな面が裏です。また青のシート側が表、黄色のシート側が裏となるようにパッケージされています。表を上に、裏を下に向けてご使用ください(図2)。
- 本キットでは、推奨サンプル量を25 ml としております。サンプルのろ過には5~15分程度の時間を要します。サンプル量を増やした場合、フィルトレーションに要する時間が長くなる可能性があります。
- 培養中のエクソソーム量が多い場合、フィルターが目詰まりを起こす可能性があります。このようなサンプルを使う場合は、一度にろ過せず、数回に分けて処理してください。

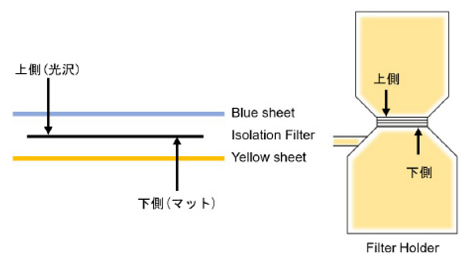
図2 Isolation Filter の向き
操作
- 実験に応じた細胞の培養上清を準備する。
- 推奨サンプル量は 25 ml です。
- 細胞の種類により、また培養方法により分泌されるエクソソームの量は異なります。
- 培養上清を 0.22 μm 滅菌ろ過フィルターに通し、ろ過を行う(サンプルの前処理)。
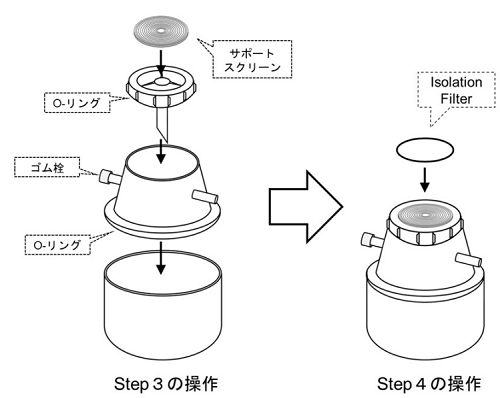
- ファンネル部分を除き、Filter Holder を組み立てる(図3)。
- 本キットにはシリコン製のO-リングが3つ含まれています。密閉性を保つため、O-リングを溝に合わせて正しくセットして下さい。
図3 Filter Holder と Isolation Filter の組み立て図 - Isolation Filter をピンセットでとり、サポートスクリーンに載せる(図4a)。
- Isolation Filter は非常に薄く、静電気等の影響により扱いにくくなっている場合があります。
- Isolation Filter を載せた時、表面にしわができないようにしてください(図4bとc)。
図4 Isolation Filter の載せ方
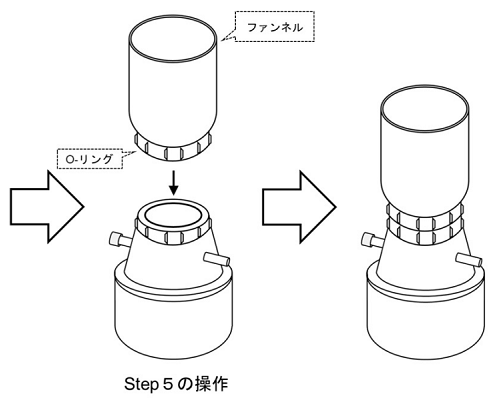
- Filter Holder のファンネルをセットし、Isolation Filterを固定する。
- PBS 4 ml を Isolation Filter の上に載せ、吸引ろ過して PBS を通す(Isolation Filterの親水処理)。
- 前処理したサンプルをIsolation Filter の上に載せ、吸引ろ過してサンプルを通す。
- PBS 2 ml をIsolation Filterの上に載せ、吸引ろ過して PBS を通す。この洗浄操作を3回行う。
- 1000 μl マイクロピペットを使って PBS 250 μl をIsolation Filter表面に当て、Isolation Filter 上のエクソソームを流す。流したPBSをマイクロピペットで吸い、再度フィルターにあてる。この操作を繰り返し、Isolation Filter 上のエクソソームをすべてPBS に懸濁させる(図5)。
- 操作方法の動画をweb公開しています。マニュアルと併せてご覧ください。
- エクソソーム溶液を 1.5 ml チューブに回収する。
- 9-10 の回収操作をもう一度行う (Total 回収量: 500 μl)。
- エクソソーム回収に使うPBSの量を減らした場合、回収するエクソソーム溶液の濃度を上げることができます。しかし、回収に使う PBS 量が減ることで、エクソソームの回収率が下がる可能性があります。

- 1.250 μl のPBS をIsolation Filter の表面に当てて流し、エクソソームを回収する。

- 2.エクソソームを懸濁させた PBS をピペットで回収する。

- 3.回収した PBS を、再度 Isolation Filter の表面に当てて流す。PBS 当てて流し、回収する操作を 20回繰り返す。
図5 Step 9 の操作方法- エクソソームの回収率を上げるため、Isolation Filter の表面すべてにPBSを当てる様に洗浄して下さい。
実験例
HEK293S 細胞の培養上清由来エクソソームの回収
- HEK293S 細胞を無血清培地で 5×105 cells/ml となるように調製し、125 ml バッフル付三角フラスコに 30 ml 入れ、2日間振盪培養した。振盪は 155 rpm で行った。
- フラスコから細胞溶液を 50 ml コニカルチューブに回収し、1500 rpm, 5分間遠心した。
- 培養上清を新しい 50 ml コニカルチューブに回収し、4℃保存した (培養上清①)。細胞のペレットを新しい無血清培地 30 ml に懸濁し、125 ml バッフル付三角フラスコに入れて2日間振盪培養した。振盪は 155 rpm で行った。
- フラスコから細胞溶液を 50 ml コニカルチューブに回収し、1500 rpm, 5分間遠心した。
- 培養上清を新しい 50 ml コニカルチューブに回収した(培養上清②)。
- 培養上清①と②を合わせて、0.22 μmのカップフィルターでろ過した (前処理サンプル)。
- Filter Holder に Isolation Filter をセットした。
- Isolation Filter に PBS 4 ml を載せ、吸引ろ過して親水処理をした。
- Isolation Filter に前処理したサンプル 25 ml を載せ、吸引ろ過した。
- ろ過後、Isolation Filter に PBS 2 ml を載せ、吸引ろ過した。これを 3回行った。
- 1000 μl マイクロピペットで PBS 250 μl を測り取り、Isolation Filter の表面に当てながらIsolation Filter上のエクソソームを PBS に懸濁させた。この操作を繰り返し、Isolation Filter上のエクソソームをすべて回収した。
- エクソソームを懸濁させた PBS を、1.5 ml チューブに回収した。
- Step 11-12 の操作をもう一度行った (Total 回収量 500 μl)。
- 回収したエクソソームをナノ粒子トラッキング解析(NTA法)、ウエスタンブロッティングにて評価した。
超遠心法で精製したエクソソームと ExoIsolator で精製したエクソソームの精製度比較
[超遠心法によるエクソソームの精製]
- HEK293S 細胞の培養上清を0.22 μmの滅菌ろ過フィルターでろ過し、サンプルの前処理を行った。
- 前処理したサンプル 25 ml を遠沈管に移し、100,000 × g、2時間の遠心を行った(himac CP80NX, Hitachi)。
- 遠心後の上清を捨て、ペレットをPBS 6 ml で懸濁した。100,000 × g、2時間の遠心を行った。
- 遠心後の上清を捨て、ペレットを100 μl のPBSで懸濁し、1.5 ml チューブに移した。
- 100 μl のPBSを使って遠沈管を洗い、洗いに使ったPBSを1.5 ml チューブに移した。この操作をさらに2回行った(エクソソーム懸濁液回収量:300 μl)。
- 回収したエクソソーム懸濁液を 10,000 × g、5分間遠心した。上清を新しい1.5 mlチューブに移した。
[NTA法]
エクソソームの粒子数は、Nanosight NS300 (Quantum Design; camera level 13; detect threshold 5) にて測定した。
[ウエスタンブロッティング]
- 精製したエクソソームを還元剤を含まないsample buffer と混ぜ、95℃で5分間インキュベートした。
- 調製したサンプルの SDS-PAGE を行い(SuperSep Ace, 10-20%, 13well; Wako)、続いてPVDF膜(Trans-Blot Turbo Transfer System Transfer Pack;Bio-Rad)に転写した。
- 次の表に示す抗体を使い、エクソソームのマーカーであるCD9、CD63、CD81との抗原抗体反応を行った。
一次抗体 二次抗体 CD9 Monoclonal rabbit anti-CD9 antibody
(diluted 1:1000; cat. no. ab236630; abcam)Polyclonal goat anti-rabbit antibody conjugated with
HRP (diluted 1:2000; cat. no. ab97051; abcam)CD63 Monoclonal mouse anti-CD63 antibody
(diluted 1:1000; cat. no. MEX002-3; MBL)Polyclonal goat anti-mouse antibody conjugated with
HRP (diluted 1:2000; cat. no. ab205719; abcam)CD81 Monoclonal mouse anti-CD81 antibody
(diluted 1:500; cat. no. MEX003-3; MBL)Polyclonal goat anti-mouse antibody conjugated with
HRP (diluted 1:2000; cat. no. ab205719; abcam) - PVDF膜を SuperSignal West Pico PLUS Chemiluminescent Substrate (Thermo Fisher Scientific) で処理した。
- PVDF膜状のバンドをSyngene Pxi (Syngene)を用いて検出した。
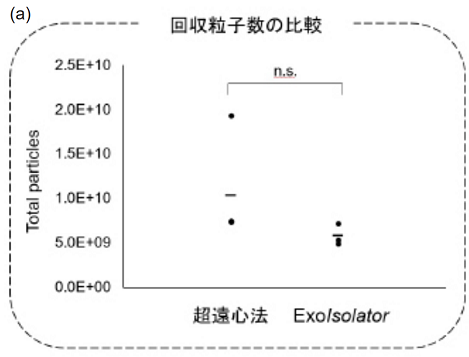
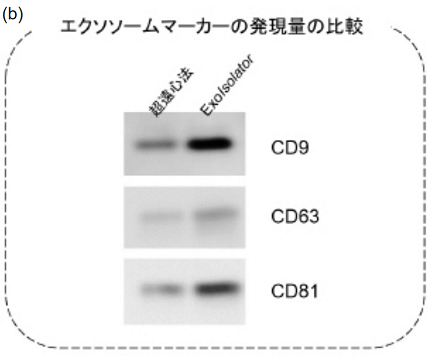
図6 超遠心法と ExoIsolatorの比較
HEK293S 細胞の培養上清 25 ml を使って、それぞれ超遠心法とExoIsolatorでのエクソソーム精製を行った。
(a) ナノ粒子トラッキング解析 (NTA法) にて粒子数を測定し、比較した。
(b) ウエスタンブロッティングにて、エクソソームマーカーの発現量を比較した。
参考文献
- Kalluri, R.; LeBleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 2020,367(6478).
EX10_2: ExoIsolator Exosome Isolation Kit / ExoIsolator Isolation Filter
Revised Jan., 10, 2024


 を押して省略できます。
を押して省略できます。