はじめに
鉄は、生体内で最も多く存在する遷移金属元素であり、様々な生理活性を示すことが報告されています。近年、タンパク非結合型の鉄イオン( 自由鉄) としての存在が注目されており、その高い反応性は細胞損傷や細胞死にも関与していることが示唆されています。自由鉄は安定な化学種である鉄(II) イオン及び鉄(III) イオンとして存在しますが、生細胞内において、細胞内還元的環境、水溶性、トランスポーターの存在等を考慮すると鉄(III) イオンよりも鉄(II)イオンの挙動を知ることが重要であると考えられています。FerroOrange は、細胞内の鉄(II)イオンと選択的に反応し強い蛍光(λex : 543 nm, λem : 580 nm)を発する試薬であり、細胞内鉄(II) イオンのライブセルイメージングに利用することが可能です。
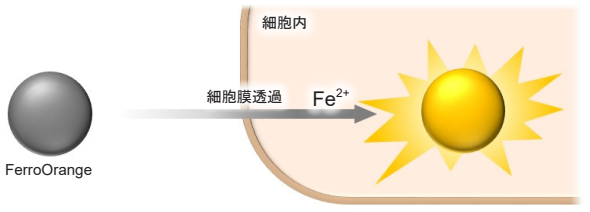
図1 FerroOrange による細胞内鉄(II) の検出
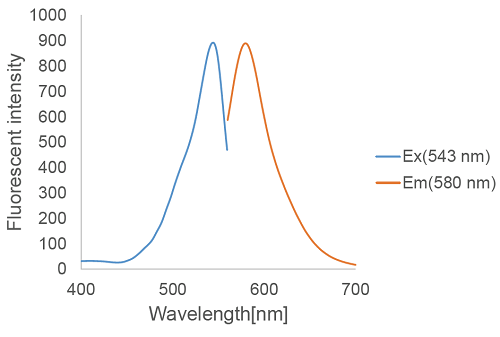
図2 FerroOrange の励起、蛍光スペクトル
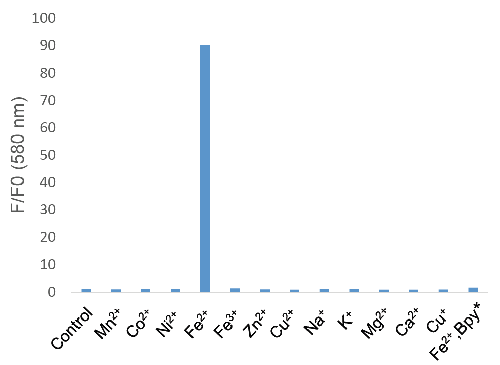
*Bpy; 2,2'-Bipyridyl
図3 FerroOrange の金属イオン選択
内容
| 1 tube | 3 tubes | |
| FerroOrange | 24 μg x 1 | 24 μg x 3 |
保存条件
遮光、冷蔵保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO) 、Dimethylformamide(DMF)またはエタノール
- HBSS
- 無血清培地
- マイクロピペット
溶液調製
1 μmol/l FerroOrange working solution の調製方法
FerroOrange 24 μg を含むマイクロチューブに 35 μl の DMSO を加え、ピペッティングにより溶解し、 1 mmol/l FerroOrange 溶液を調整する。調製した溶液を HBSS で希釈し 1 μmol/l working solution とする。
- DMSO の代わりに DMF もしくはエタノールも使用可能です。調製後の 1 mmol/L FerroOrange 溶液は、製品添付のアルミラミジップに入れ、冷凍で保存していただければ 1 ヶ月間保存可能です。尚、1 μmol/l working solution は不安定なため、細胞試料に添加する直前に調製し、直ちに染色に供して下さい。
- 希釈に用いる HBSS は無血清培地に変更可能です。血清入りの培地はバックグラウンド上昇の原因となるため、使用できません。
- 溶媒溶解時に明らかな着色が見られる場合には、コンタミの可能性があります。使用を中止し、新しい溶媒やチップを用いて、再度調製して下さい。
操作
- 細胞をディッシュに播種し、5% CO2 存在下、37℃ で培養する。
- 培地を取り除き、無血清培地で3 回洗浄する。
- 刺激剤を含む培地を添加し、5% CO2 存在下、37℃ で培養する。
- 刺激の条件に応じてインキュベート時間を設定して下さい。
- 溶液を取り除き、HBSS または無血清培地で3 回洗浄する。
- 1 μmol/l FerroOrange working solution を添加し、5% CO2 インキュベーター内に37℃ で 30 分間静置する。
- 細胞を蛍光顕微鏡で観察する。
- 洗浄せずに観察を行って下さい。
実験例1
FerroOrangeを用いた細胞内鉄(II)の検出
- μ-スライド 8ウェル(ibidi社製)にHeLa細胞(2.0×104 cells/well)を播種し、5% CO2 存在下、37℃で一晩培養した。
- 無血清培地 200 μl で3回洗浄し、無血清培地 200 μl を添加した。
- 10 mmol/l となるように超純水で硫酸アンモニウム鉄(II)溶液を調製した。
- 10 mmol/l 硫酸アンモニウム鉄(II)溶液 2 μl をウェルに添加し(終濃度 100 μmol/l) 、溶液を均一にするため、ウェル内の溶液全量を一度マイクロピペットで吸い上げ、再び同じウェルにゆっくり戻した。
- 硫酸アンモニウム鉄(II)を添加する際は操作4の様に行って下さい。マイクロチューブなどに予め無血清培地で100 μmol/l 硫酸アンモニウム鉄(II)溶液を調製し細胞に添加する方法では、ボルテックスやピペッティングによる混合操作で沈殿が生じる可能性がございます。
- 5% CO2 存在下、インキュベーター内に37℃で 30分静置した後、硫酸アンモニウム鉄(II)溶液を除き、HBSS 200 μl で3回洗浄した。
- FerroOrange (1 μmol/l) 及び 2,2'-bipyridyl (Bpy) (100 μmol/l)を含むHBSS溶液 200 μl を添加し、5% CO2 存在下、37℃で30分間インキュベートした。
- 細胞を共焦点レーザー顕微鏡で観察した。
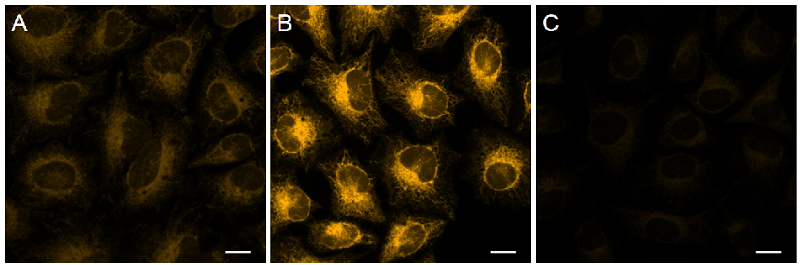
図4 FerroOrangeFerroOrangeを用いた細胞内鉄(II)の検出
| Ex/Em = 561 nm/ 570–620 nm A 未処理のHeLa 細胞 B 硫酸アンモニウム鉄(II) 処理のみ C 硫酸アンモニウム鉄(II) 及び Bpy 処理 Scale bars 20 μm |
硫酸アンモニウム鉄(II)添加群で蛍光強度が増大し、Bpy 添加により蛍光強度が低下したことから、FerroOrangeが細胞内鉄(II)と反応していることを確認した。
実験例2
FerroOrangeを用いた内在性の細胞内鉄(II)の検出
- 1. μ-スライド 8ウェル(ibidi社製)にHeLa細胞(2.0×104 cells/well)を播種し、5% CO2 存在下、37℃で一晩培養した。
- 2. HBSS 200 μlで3回洗浄した。
- 3. FerroOrange (1 μmol/l ) 及び Bpy (100 μmol/l) のHBSS溶液 200 μlを添加し、5% CO2 存在下、37℃で30分間インキュベートした。
- 4. 細胞を共焦点レーザー顕微鏡で観察した。
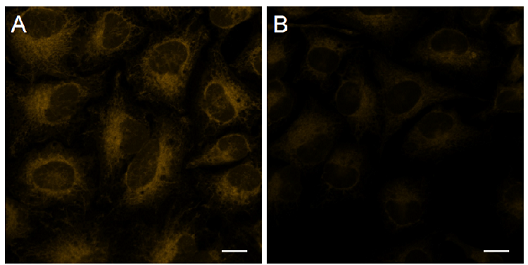
図5 FerroOrangeFerroOrangeを用いた内在性の細胞内鉄(II)の検出
| Ex/Em = 561 nm/ 570–620 nm A 未処理のHeLa 細胞 B Bpy 処理 Scale bars 20 μm |
Bpy 添加によりFerroOrangeの蛍光強度が低下したことから、未処理のHeLa細胞で観察された蛍光が内在性の細胞内鉄(II)由来であることが示唆された。
本製品は、岐阜薬科大学薬化学研究室 永澤秀子先生、平山祐先生のご指導の下、製品化しました。
よくある質問/参考文献
F374: FerroOrange
Revised Jun., 07, 2024


 を押して省略できます。
を押して省略できます。