はじめに
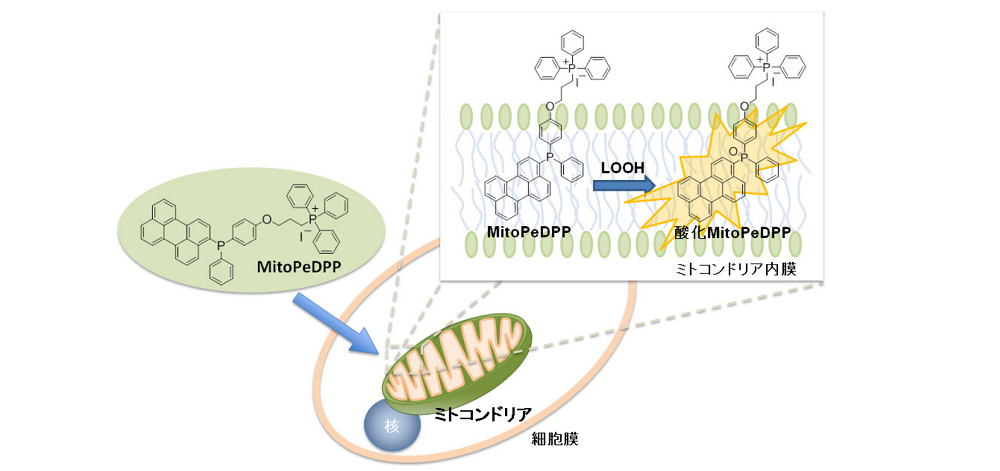
MitoPeDPPは、分子内にミトコンドリアに局在化するトリフェニルホスホニウム基を持つため、細胞膜を透過してミトコンドリアに集積します。ミトコンドリアに集積したMitoPeDPPは、膜中の脂溶性過酸化物によって特異的に酸化され蛍光を発します。酸化MitoPeDPPの励起および蛍光波長はそれぞれ452 nm、470 nmで、測定試料への光によるダメージや試料由来の自家蛍光の影響を軽減できることから、蛍光顕微鏡を用いた脂溶性過酸化物のイメージングが可能です。
本製品は福岡大学理学部の塩路准教授らにより開発された製品です。
内容
MitoPeDPP 5 μg x 3
- 内容物が少量のため目視では確認しにくい場合があります。MitoPeDPPのDMSO溶液が黄色になることを確認ください。
保存条件
遮光、0-5℃にて保存してください。
- アルミラミジップ開封後、未使用のMitoPeDPPはアルミラミジップに入れたままチャックをしっかりと閉め、0-5℃で保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- Hanks’ HEPES buffer
- PBS
- マイクロピペット
溶液調製
0.1 mmol/l MitoPeDPP DMSO solution の調製
MitoPeDPP 5 μg を含むチューブに50 μlのDMSOを加えピペッティングにより溶解する。
- MitoPeDPP (DMSO) 溶液は不安定なため、調製後は遮光して、その日のうちにご使用ください。
MitoPeDPP working solutionの調製
最終濃度が0.1 - 0.5 μmol/lになるようにMitoPeDPP DMSO solutionを Hanks' HEPES buffer等で希釈する。
- 細胞の状態を維持するためHanks' HEPES bufferをお勧めします。
- MitoPeDPPは自動酸化を受けやすいのでworking solutionは細胞試料に添加する直前に調製してください。
操作
- 細胞を準備する。
- 培地を取り除き、Hanks' HEPES bufferまたはPBSで2回洗浄する。
- 調製したMitoPeDPP をworking solutionを添加する。
培養器材 working solutionの量 35-mm ディッシュ 2000 μl 96 well プレート 100 μl - 遮光下で37℃、15分間インキュベートする。
- 上澄みを除去し、Hanks' HEPES buffer またはPBSで2回洗浄する。
- 刺激剤を含むHanks' HEPES bufferまたはPBSを加え蛍光顕微鏡で観察する。
- Filter (wavelength/band pass): 470/40 (Ex), 525/50 (Em)
- 細胞種または刺激剤等により脂溶性過酸化物の生成時間が異なるため、刺激剤添加後はMitoPeDPPの蛍光強度の変化を経時的に観察してください。
注意点
一般的な使用方法を記載しております。MitoPeDPPの終濃度、刺激剤添加後の暴露時間など最適条件をご検討ください。
補足資料
Rotenoneを用いた脂溶性過酸化物の検出例
HeLa細胞をμ-Slide 8 well (Ibidi)に播種し37℃、CO2 インキュベーターにて一晩培養した。培地を取り除き、200 μl のHanks’ HEPES bufferで細胞を2回洗浄後、Hanks’ HEPES bufferで希釈した0.1 μmol/lのMitoPeDPPを添加し37℃で15分インキュベートした。上澄みを除去し、Hanks’ HEPES bufferで2回洗浄した後、200 μlのHanks’ HEPES buferを加え蛍光顕微鏡にセットした。Hanks' HEPES bufferで希釈した2 μmol/l のRotenone溶液を200 μl加え、蛍光顕微鏡で3時間経時撮影した(終濃度 1 μmol/l)。
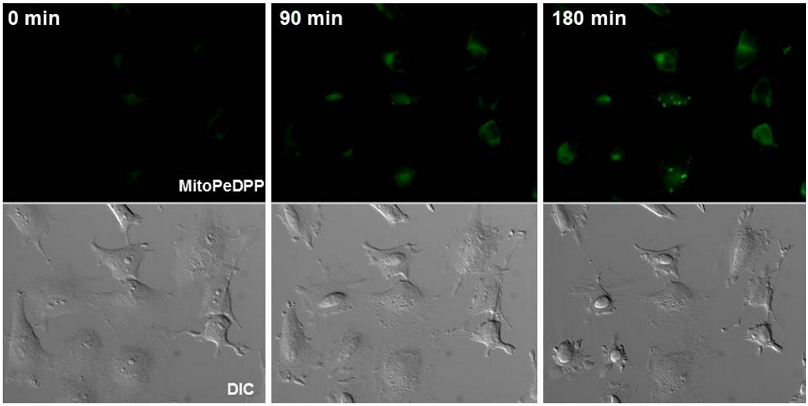
図1 Rotenone添加後のHeLa細胞の蛍光画像
左)Rotenone添加直後、中)Rotenone添加90分後、右) Rotenone添加180分後
各種ROS (reactive oxygen species)、RNS (reactive nitrogen species) とのMitoPeDPPの反応選択性
MitoPeDPPは均一系ではH2O2、t-BHP、ONOO-などの過酸化物と反応性を示したが、細胞内でのミトコンドリアに集積したMitoPeDPPは脂溶性過酸化物により参加を受けて蛍光を発した(図2. A)。一方、細胞内では他のROS、RNSとの反応性は低いことが確認された (図 2. B)。
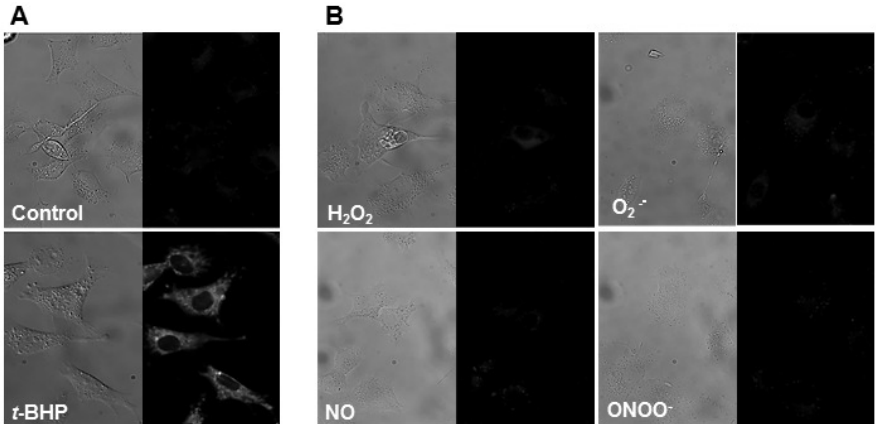
図2.
A) HepG2細胞中でMitoPeDPPを15分インキュベート後、100 μmol/l t-BHPを添加。15分インキュベート後、顕微鏡画像取得。写真はt-BHPを添加した系、添加していない系の位相差画像(左)と蛍光画像(右)を示している。
B) HepG2細胞中でMitoPeDPPをインキュベート後、各種ROS、RNS発生剤を添加。H2O2, NO, ONOO-は各発生剤の濃度を100 μmol/lで使用。O2-・はPMAにより発生させ10 μmol/lの濃度で使用。
- t-BHP (tert-Butylhydroperoxide), PMA (Phorbol myristate acetate), SIN-1 [3-(Morpholinyl)sydnoimine, hydrochloride], NOC 7 [1-Hydroxy-2-oxo-3-(N-methyl-3-aminopropyl)-3-methyl-1-triazene] Filter (wavelength/band pass): 470/40 (Ex), 525/50 (Em)
参考文献
- K. Shioji et al., ‘’Synthesis and properties of fl uorescence probe for detection of peroxides in mitochondria’’, Bioorg. Med. Chem. Lett., 2010, 20, 3911.
- K. Shioji et al., ‘’Fluorescence imaging of accumulated lipid peroxidation in mitochondria by oxidative stress’’, Bioorg. Med. Chem., submitted.
よくある質問/参考文献
M466: MitoPeDPP
Revised Aug., 22, 2023


 を押して省略できます。
を押して省略できます。