はじめに
ミトコンドリアはエネルギー産生の場として知られ、細胞内で重要な機能を持つオルガネラの一つです。近年では、アルツハイマー病やパーキンソン病の原因の一つに不良化したミトコンドリアの蓄積が報告され、マイトファジーがその中で重要な役割をもった機構であることが明らかになってきています。マイトファジーは酸化ストレスやDNA損傷等により不良化したミトコンドリアを選択的に除去するシステムであり、不良ミトコンドリアはオートファゴソームにより隔離され、リソソームと融合し消化されます。
本キットはマイトファジーを検出するMtphagy DyeとLyso Dyeで構成されています。Mtphagy Dyeは細胞内の正常なミトコンドリアに集積し、化学結合により固定化されますが、その状態では蛍光強度は低くなっています。一方、マイトファジーが誘導されミトコンドリアがリソソームと融合すると、Mtphagy Dyeの蛍光強度が増大します。またリソソーム選択的な染色色素であるLyso Dyeとの共染色により、マイトファジーを検出することが可能です。
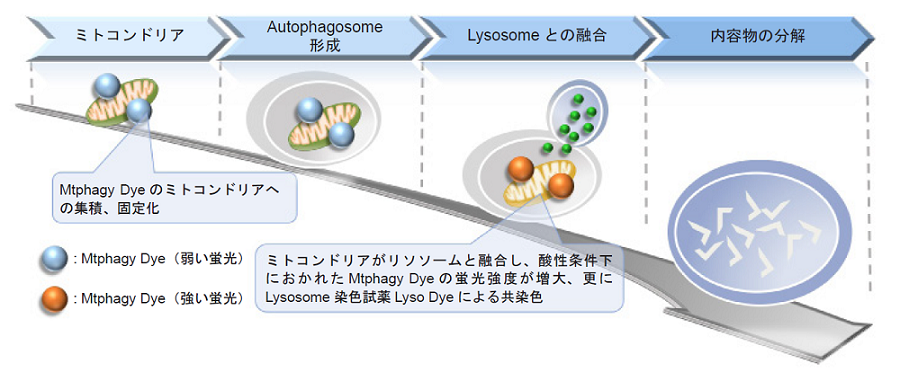
Fig. 1 Mtphagy Dyeによるmitophagy検出機構
内容
| Mtphagy Dye | 5 μg× 1 |
| Lyso Dye | 30 μg× 1 |
保存条件
遮光、0-5°Cにて保存してください。
必要なもの
- Dimethyl sulfoxide(DMSO)
- Hanks’ HEPES buffer or serum-free medium
- Micropipettes
溶液調整
100 μmol/l Mtphagy Dye DMSO stock solutionの調製
Mtphagy Dye 5 μgを含むチューブに50 μlのDMSOを加えピペッティングにより溶解する。
- 調製後は-20℃で保存してください。調製後1か月間安定です。
1 mmol/l Lyso Dye DMSO stock solutionの調製
Lyso Dye 30 μgを含むチューブに55 μlのDMSOを加えピペッティングにより溶解する。
- 調製後は-20℃で保存してください。調製後1か月間安定です。
100 nmol/l Mtphagy Dye working solutionの調製
最終濃度が100 nmol/lになるようにMtphagy Dye DMSO stock solutionをHanks’ HEPES bufferまたは血清不含培地で希釈する。
- 本色素は血清成分と干渉するため、血清不含培地またはHanks’ HEPES bufferで希釈してください。
1 μmol/l Lyso Dye working solutionの調製
最終濃度が1 μmol/lになるようにLyso Dye DMSO stock solution をHanks’ HEPES bufferまたは血清不含培地で希釈する。
- 本色素は血清成分と干渉するため、血清不含培地またはHanks’ HEPES bufferで希釈してください。
蛍光特性
Mtphagy Dye とLyso Dye の励起、蛍光スペクトル
- Mtphagy Dye
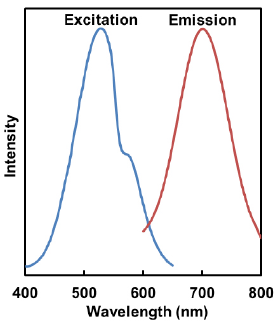
λex:530 nm
λem:700 nm<推奨フィルター>
励起:500-560 nm
蛍光:670-730 nm
- Lyso Dye
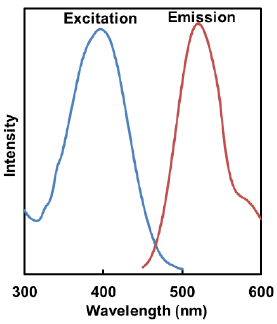
λex:398 nm
λem:525 nm<推奨フィルター>
励起:350-450 nm
蛍光:500-560 nm
操作
- 固定化した細胞では、Mtphagy Dyeがミトコンドリアに集積することができません。
また染色後に細胞を固定化すると、リソソームと融合したミトコンドリアは酸性に保たれず、Mtphagy Dyeの蛍光は増大しません。
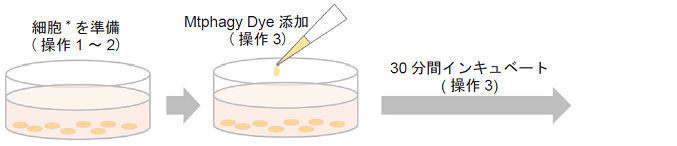
- 細胞をディッシュに播種し培養する。
- 培地を除去後、Hanks’ HEPES bufferまたは血清不含培地で2回洗浄する。
- 調製した100 nmol/l Mtphagy Dye working solutionを添加し、37℃で30分間インキュベートする。
- 上澄みを除去後、Hanks’ HEPES bufferまたは血清不含培地で2回洗浄する。
- マイトファジー誘導刺激剤を含む培地を加え37℃で適切な時間インキュベートする。蛍光顕微鏡にて誘導を確認する。
- Mtphagy DyeとLysosomeの共局在を観察するため、1 μmol/l Lyso Dye working solutionを加え37℃で30分間インキュベートする。
- 上澄みを除去後、Hanks’ HEPES bufferまたは血清不含培地で2回洗浄し、蛍光顕微鏡にて観察する。
実験例
Parkin発現HeLa細胞を用いたcarbonyl cyanide m-chlorophenyl hydrazone (CCCP)によるマイトファジー誘導
- μ-slide 8 well (Ibidi)に細胞を播種し37℃、CO2インキュベーターにて一晩培養した。
- HilyMax [Code#:H357]を用いてParkinプラスミドを細胞に導入し、さらに一晩培養した。
- Hanks’ HEPES bufferで2回洗浄後、100 nmol/l MitoBright Deep Red [Code#:MT08]を含む100 nmol/l Mtphagy Dye working solutionを添加し30分インキュベートした。
- Hanks’ HEPES buffer で2回洗浄後、10 μmol/l CCCP含む培養培地で24時間培養した。
- 蛍光顕微鏡でマイトファジーが起きていることを確認後、CCCP含有培地を取り除き、1 μmol/l Lyso Dye working solutionを加え30分インキュベートした。
- Hanks’ HEPES bufferで2回洗浄後、共焦点レーザー顕微鏡でMtphagy Dye、Lyso Dye、MitoBright Deep Red が染色されている事を確認した。
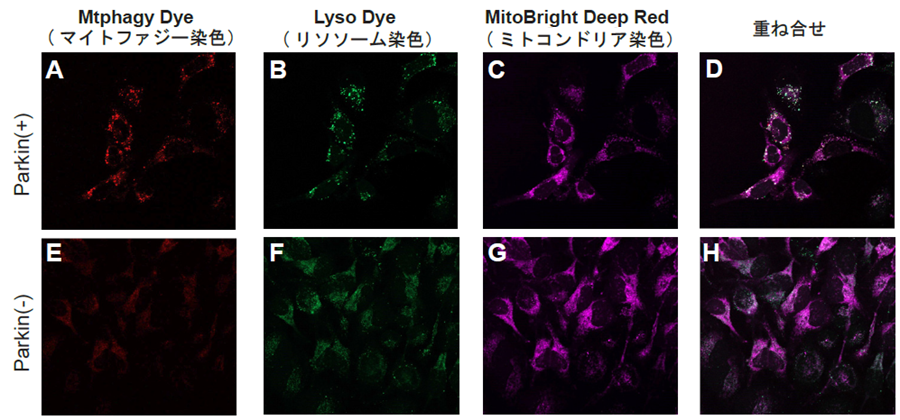
Fig. 2. Parkin発現HeLa細胞(上段写真)と未発現HeLa細胞(下段写真)を用いたマイトファジー観察
A, E) Mtphagy Dyeの蛍光画像、B, F) Lyso Dyeの蛍光画像、
C, G) MitoBright Deep Redの蛍光画像、D, H)共染色蛍光画像
- Mtphagy Dye: 561 nm (Ex)、LP 650 nm (Em)
- Lyso Dye: 488 nm (Ex)、502-554 nm (Em)
- MitoBright Deep Red: 640 nm (Ex)、656-700 nm (Em)
よくある質問/参考文献
MD01: Mitophagy Detection Kit
Revised Aug., 30, 2023


 を押して省略できます。
を押して省略できます。