はじめに
生体内の早期の細胞毒性や酸化ストレス、アポトーシスを議論する上で、ミトコンドリアは重要なオルガネラの一つです1)。ミトコンドリアは酸素を利用しATPを合成することで生体に必要なエネルギーを産出しており、ミトコンドリア活性の低下や機能障害は、癌や老化、アルツハイマー病やパーキンソン病等の神経変性疾患などと密接に関わることが知られています2), 3)。
ミトコンドリア膜電位を観察する際に良く使用されている低分子蛍光色素JC-1は、ミトコンドリアの膜電位によりミトコンドリアへ集積します。また、ミトコンドリア膜電位依存的に蓄積が起こることで、JC-1の蛍光特性が緑色(約530 nm)から赤色(約590 nm)へ変化します。ミトコンドリアの膜電位が高い場合、ミトコンドリア内での色素濃度が上昇し色素が凝集を起こすことで、赤色の蛍光を発し、ミトコンドリアの膜電位が低い場合、色素濃度が低くJC-1がmonomerで存在するため、緑色の蛍光を発します。
JC-1 MitoMP Detection Kitは、ミトコンドリア膜電位を測定できるキットです。従来、JC-1は染色溶液調製の際、溶けづらい等の課題がありますが、本キットは溶液調製方法によりそれを克服しております。さらに、本キットに含まれるImaging Bufferを用いることにより、蛍光バックグラウンドを抑えながら細胞にダメージを与えにくい状態で、細胞を観察することができます。
キット内容
| JC-1 Dye | 100 nmol x 1 |
| Imaging Buffer (10x) | 11 ml x 1 |
保存条件
0–5 ℃で保存して下さい。
必要なもの (キット以外)
- Dimethyl sulfoxide (DMSO)
- 培地またはHBSS
- マイクロピペット
- マイクロチューブ
溶液調製
Imaging Buffer solution の調製
Imaging Buffer (10x)を、超純水を用いて10倍に希釈する。必要量は、表1を参照してください。
- 使用する当日に必要な分量を調製して下さい。
- Imaging Buffer solutionは、その日の内にご使用ください。
表 1 容器別Imaging Bufferの推奨使用量
| 容器 | 35 mmdish | ibidi 8 well plate |
| 必要量 | 2 ml/dish | 200 μl/well |
| 容器 | 96 well plate | Sample tube (Flow Cytometry) |
| 必要量 | 100 μl/well | 0.5 ml/sample |
JC-1 DMSO stock solution (2 mmol/l) の調製
JC-1 Dyeを含むチューブに DMSO を50 μl加え、ピペッティングにより溶解し、2 mmol/l JC-1 DMSO stock solutionを調製する。溶解後は-20 ℃で保存してください。
- DMSO stock soltuionは、使用時以外はできるだけ光を避け冷凍にて保存を行うと一ヶ月間使用可能です。
JC-1 working solution の調製
JC-1 DMSO stock solutionをマイクロピペットを用いてマイクロチューブに量り取る。
その後、必要量の培地をマイクロピペットにて前述のマイクロチューブに移し、即座にピペッティングを10 回行い、溶液を均一にする。染色時のJC-1の終濃度が1–15 μmol/lとなる様に調製を行ってください。
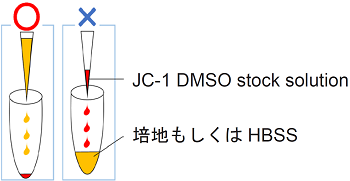
- working solutionを調製する際に使用するJC-1 DMSO stock solution及び培地は、 室温に戻して使用して下さい。
- 調製したDMSO stock solutionを培地に添加すると、色素が析出する可能性があります。必ず上記操作手順にて調製して下さい(DMSO stock solutionに培地を加える)。
- 蛍光強度が弱い場合は、working solutionの使用濃度や染色時間の検討を行ってください。
- 調製したworking solutionは、その日の内にご使用ください。
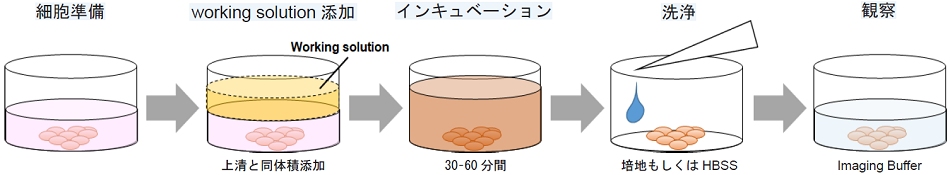
操作
- 細胞を準備する。
- 調製したJC-1 working solutionを添加する。※1
- 5% CO2インキュベーター内で30–60 分間インキュベートする。
- 上澄み液を除去し、HBSSもしくは培地で細胞を2回洗浄する。※2
- Imaging Buffer solutionを加え蛍光顕微鏡にて細胞を観察する。※3
- 脱分極剤(e. g. CCCP, FCCP)で処理を行った細胞を洗浄すると、ミトコンドリア膜電位が変化する可能性があります。脱分極後の細胞は洗浄せずに染色を行ってください。
- PBSを用いて細胞を洗浄すると細胞が剥れてしまう可能性がありますのでお勧めしません。ご使用の培地もしくはHBSSを用いて細胞を洗浄してください。
- 励起光を照射し続けると蛍光の退色が起こる可能性があります。できる限り素早く観察を行ってください。
染色例:JC-1終濃度2 μmol/lで染色する場合
2 mmol/lのDMSO stock solutionをマイクロチューブに2 μl量り取り、そこへ1 mlの培地を添加する。
添加直後にピペッティングを10 回行い、溶液を均一にし4 μmol/l JC-1 working solutionを調製する。
細胞上清と同体積のworking solutionを添加し、染色を行う。
実験例1
Carbonyl cyanide m-chlorophenyl hydrazone (CCCP)で処理したHeLa細胞を用いたミトコンドリア膜電位の検出
- 200 μlのHeLa細胞懸濁液(2.4x105 cells/ml, MEM, 10% fetal bovine serum,1% penicillin-streptomycin)をμ-slide 8 wellに添加し、5% CO2インキュベーターで37 ℃、一晩培養した。
- 培地を取り除き、MEM培地で希釈した0, 100 μmol/lのCCCP溶液を200 μl添加し、5% CO2インキュベーターで1.5 時間インキュベートした。
- 上澄み液を100 μl取り除き、MEM培地で希釈したJC-1 working solution (4 μmol/l)を100 μl添加し、5% CO2インキュベーター(37 ℃)にて30 分間インキュベートした。
- 上澄みを除去し、200 μlのHBSSで細胞を2 回洗浄した。
- 200 μlのImaging Buffer solutionを加え、蛍光顕微鏡で観察した。
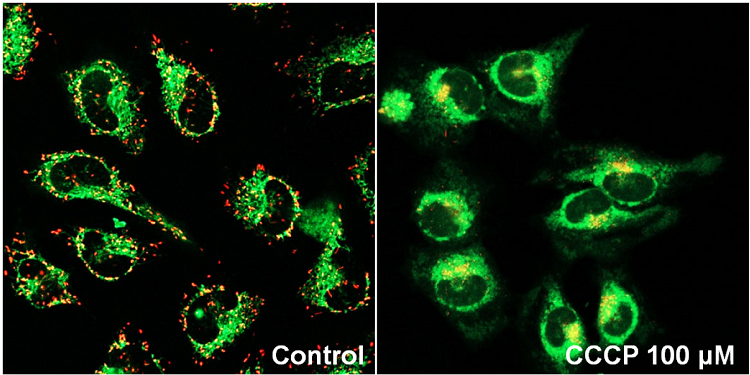
| <検出条件> Green 488 nm (Ex), 500–550 nm (Em) Red 561 nm (Ex), 560–610 nm (Em) |
図1 JC-1によるHeLa細胞のミトコンドリア膜電位検出
実験例2
Carbonyl cyanide p-trifluoromethoxyphenyl hydrazone (FCCP)で処理したHeLa細胞を用いたミトコンドリア膜電位の検出
- 200 μlのHeLa細胞懸濁液(2.4x105 cells/ml, MEM, 10% fetal bovine serum,1% penicillin-streptomycin)をμ-slide 8 wellに添加し、5% CO2インキュベーターで37 ℃、一晩培養した。
- 培地を取り除き、MEM培地で希釈した0, 100 μmol/lのFCCP溶液を200 μl添加し、5% CO2インキュベーターで30 分間インキュベートした。
- 上澄み液を100 μl取り除き、MEM培地で希釈したJC-1 working solution (4 μmol/l)を100 μl添加し、5% CO2インキュベーター(37 ℃)にて30 分間インキュベートした。
- 上澄みを除去し、200 μlのHBSSで細胞を2 回洗浄した。
- 200 μlのImaging Buffer solutionを加え、蛍光顕微鏡で観察した。
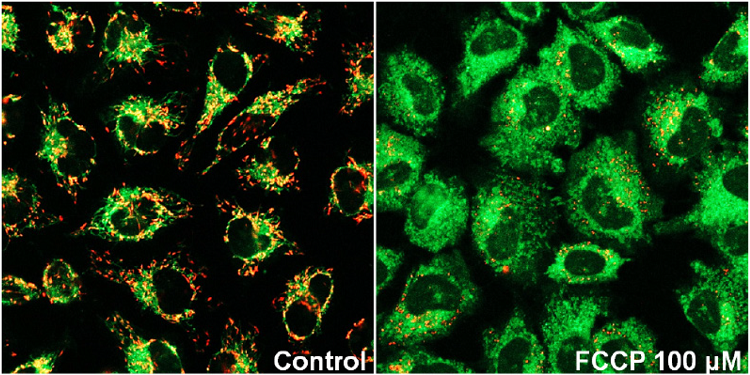
| <検出条件> Green 488 nm (Ex), 500–550 nm (Em) Red 561 nm (Ex), 560–610 nm (Em) |
図 2 FCCPで処理したHeLa細胞のJC-1によるミトコンドリア膜電位の検出
実験例3
アポトーシス誘導におけるJurkat細胞を用いたミトコンドリア膜電位の検出
- 2 mlのJurkat細胞懸濁液(1.0x106 cells/ml, RPMI, 10% fetal bovine serum、1% penicillin-streptomycin)を5 mlチューブに加えた。
- 培地を取り除き、RPMI培地で希釈した0, 2.5 μg/mlのStaurosporine溶液を2 ml添加し、5% CO2インキュベーターで2.5 時間インキュベートした。
- RPMI培地で希釈したJC-1 working solution (4 μmol/l)を2 ml添加し、5% CO2インキュベーター(37 ℃)にて30 分間インキュベートした。
- 培地を除去し、2 mlのHBSSで細胞を2 回洗浄した。
- 2 mlのImaging Buffer solutionを加え、蛍光顕微鏡、プレートリーダー、フローサイトメーターで観察した。
蛍光イメージング
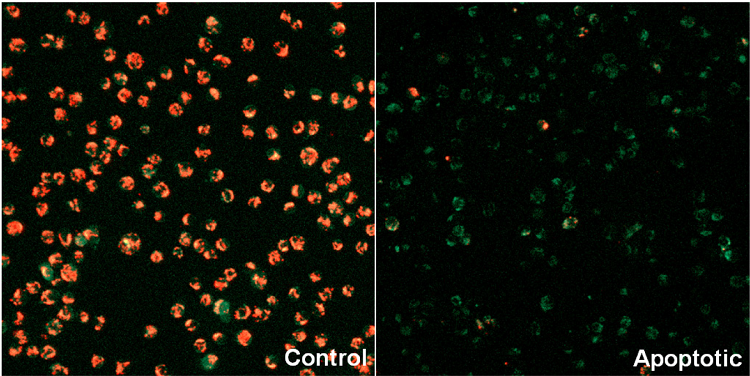
| <検出条件> Green 488 nm (Ex), 500–550 nm (Em) Red 561 nm (Ex), 560–610 nm (Em) |
図3 蛍光顕微鏡を用いたJurkat細胞のミトコンドリア膜電位検出
蛍光プレートリーダーを用いた検出
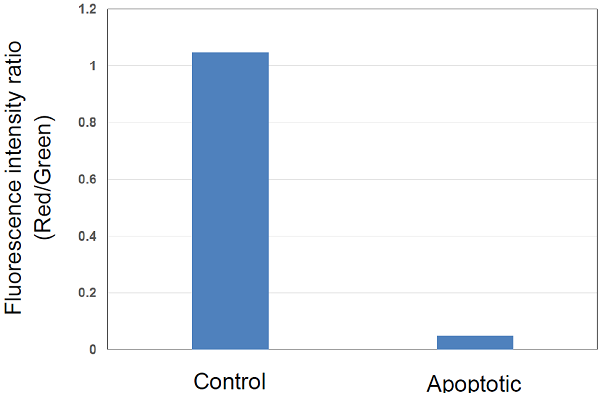
| <検出条件> Green 485 nm (Ex), 525–545 nm (Em) Red 535 nm (Ex), 585–605 nm (Em) <使用したプレート> NuncTM MicroWellTM 96-Well Optical Bottom Plates with Polymer Base (cat# 165305) |
図4 プレートリーダーを用いたミトコンドリア膜電位検出
フローサイトメーターを用いた検出
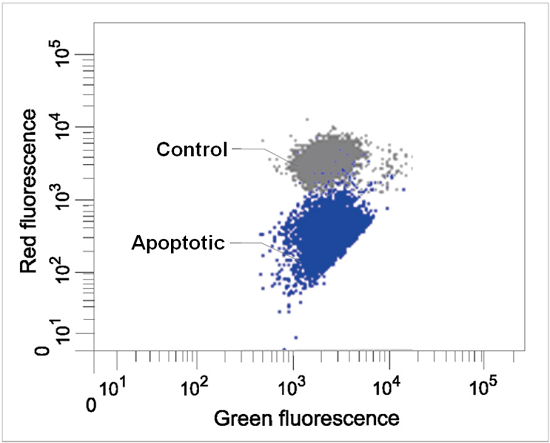
| <検出条件> Green 488 nm (Ex), 515–545 nm (Em) Red 488 nm (Ex), 564–604 nm (Em) |
図5 フローサイトメーターを用いたミトコンドリア膜電位検出
参考文献
- Ferri, K. F. et al., J. Exp. Med., 2000, 192, 1081–1092.
- Matsuda, N. et al., J. Cell Biol., 2010, 189, 211.
- Wang, J. L. et al., PNAS, 2000, 97, 7124–7129.
- Birju, P. S. et al., ACSNano, 2014, 8, 9, 9379–9387.
- Cristiana, F. et al., JID, 2000, 115, 5, 835–841.
よくある質問/参考文献
MT09: JC-1 MitoMP Detection Kit
Revised May., 22, 2023


 を押して省略できます。
を押して省略できます。