はじめに
細胞内には様々な器官が存在し、各々が生命活動に必要な役割を担っています。中でもミトコンドリアは、酸化的リン酸化による ATP 産生の場であるだけでなく、癌や老化、アルツハイマーやパーキンソン病等の神経変性疾患などと密接に関連する非常に重要な細胞内オルガネラの一つです。
通常、ミトコンドリアの形態や動態、量を観察する際には、低分子色素を用いてミトコンドリアをラベル化するか、蛍光タンパク質をミトコンドリアに遺伝子発現する方法が使用されます。蛍光タンパク質の遺伝子発現方法は、安定的に遺伝子を発現させることが難しいため、簡便な低分子色素を用いる方法が広く使われています。既存の市販されている低分子色素の中で、クロロメチル基を有する低分子色素が最も一般的に使用されています。しかし、これらの色素は長期間観察ができないことや、染色時血清入り培地を使えない点、染色後の高いバックグラウンド蛍光があるという点で課題があります。
MitoBright LT 色素は、これらの課題を克服した色素であり、長期間ミトコンドリアに局在し、場合によっては一週間滞留することが可能です。また、既存のクロロメチル基を有する低分子ミトコンドリア染色色素に比べ、より明るくミトコンドリアを染色します。本製品は、DMSO 溶液品となっており、ミトコンドリアを簡便に染色することができます。蛍光色は、Green、Red、Deep Red を取り揃えており、多重染色等、様々な用途に適応可能です。
内容
| 容量 | 400 µl |
| MT10 : MitoBright LT Green |
使用可能枚数 (35 mm dish) |
| MT11 : MitoBright LT Red | |
| MT12 : MitoBright LT Deep Red |
保存条件
| MT10 : MitoBright LT Green | -20℃ にて、保存して下さい。 |
| MT11 : MitoBright LT Red | 遮光、-20℃ にて、保存して下さい。 |
| MT12 : MitoBright LT Deep Red | 遮光、-20℃ にて、保存して下さい。 |
必要なもの
- 培地または HBSS
- マイクロピペット
溶液調製
MitoBright LT working solution の調製
0.1 mmol/l MitoBright LT solution を培地で希釈し、0.1 μmol/l MitoBright LT working solution を調製する。
- Working solution は保存できません。調製したその日の内に、ご使用ください。
操作
- 細胞をディッシュに播種し、5% CO2存在下、37℃ で培養する。
- 培地を取り除き、培地または HBSS を用いて1回洗浄する。
- 0.1 μmol/l MitoBright LT working solutionを添加し、5% CO2インキュベーター内に37℃で15 分間静置する。
- 上澄みを取り除き、培地または HBSS を用いて2 回洗浄する。
- 培地もしくは HBSS を添加し、細胞を蛍光顕微鏡で観察する。
実験例
蛍光顕微鏡による HeLa 細胞を用いたミトコンドリアの経過観察
- μ-slide 8 well plate (ibidi)にHeLa細胞 (2.4 x 105 cell/ml)を播種し、37℃、5% CO2インキュベーター内で一晩培養した。
- 培地を取り除き、MitoBright LT working solution (0.1 μmol/l, 200 μl) を添加し、37℃で30分間インキュベートした。
- 上澄みを取り除き、200 μlの MEM 培地 (10% FBS含有)を用いて2回洗浄した。
- 200 μlのMEM 培地( フェノールレッド不含 ) 添加し、蛍光顕微鏡で細胞の経過観察を行った。
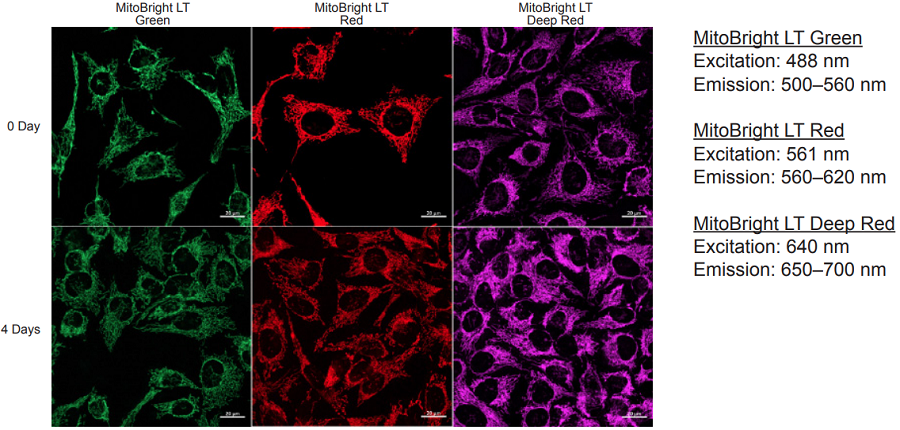
図1 染色直後および 4 日後の HeLa 細胞の染色画像
フローサイトメーターによる Jurkat 細胞を用いたミトコンドリアの経過観察 (0、2、4 日 )
- Jurkat 細胞 (3.2 x 105cells/ml) を RPMI 培地 (10% fetal bovine serum, 1% penicillin-streptomycin) で 5 cm ディッシュに播種し、37℃、5% CO2 インキュベーター内で一晩培養した。
- 培地を取り除き、MitoBright LT working solution (0.1 μmol/l, 5 ml) を添加し 37℃ で 30 分間インキュベートした。
- 溶液を取り除き、5 ml の RPMI 培地を用いて 2 回洗浄した。
- RPMI 培地を添加し、細胞培養を継続し、その細胞を 2 日毎にフローサイトメーターで解析した。
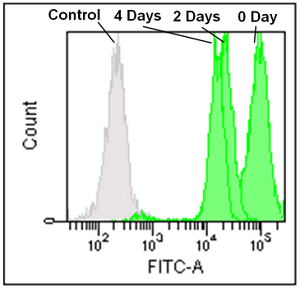
MitoBright LT Green
Ex: 488 nm
Em: 515 nm–545 nm
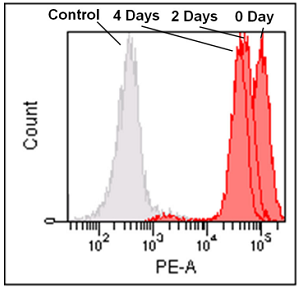
MitoBright LT Red
Ex: 488 nm
Em: 564–604 nm
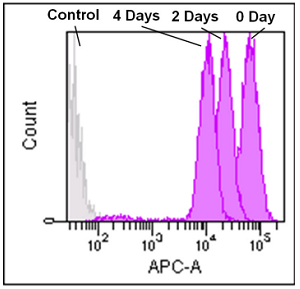
MitoBright LT Deep Red
Ex: 633 nm
Em: 650–670 nm
図 2 MitoBright LT で染色した Jurkat 細胞のフローサイトメーターによる解析
MitoBright LT 色素の蛍光特性
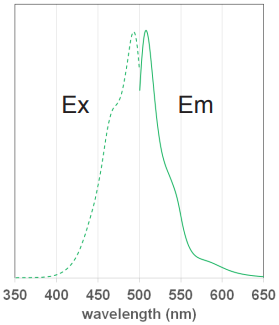
図 3 MitoBright LT Green の
励起、蛍光スペクトル
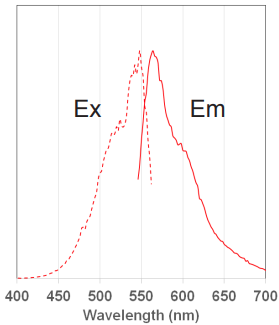
図 4 MitoBright LT Red の
励起、蛍光スペクトル
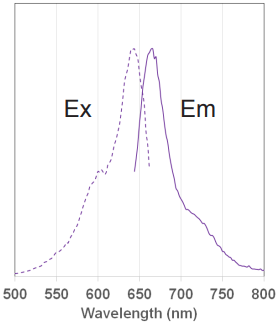
図 5 MitoBright LT Deep Red の
励起、蛍光スペクトル
MitoBright LT 色素を用いたミトコンドリア形態の観察
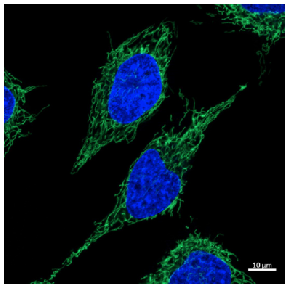
色素濃度 : 0.1 μmol/L
細胞種 : HeLa cells
励起波長 : 488 nm
蛍光波長 : 500-560 nm
核染色 : Hoechst 33342
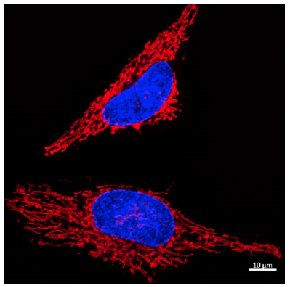
色素濃度 : 0.1 μmol/L
細胞種 : HeLa cells
励起波長 : 561 nm
蛍光波長 : 560-620 nm
核染色 : Hoechst 33342
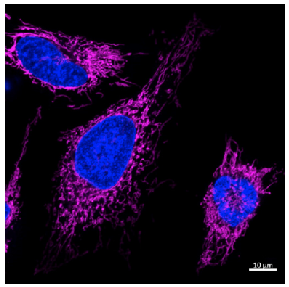
色素濃度 : 0.1 μmol/L
細胞種 : HeLa cells
励起波長 : 640 nm
蛍光波長 : 650-700 nm
核染色 : Hoechst 33342
図 6 共焦点レーザー顕微鏡を用いた HeLa 細胞の染色画像
MT10_MT11_MT12: MitoBright LT Green / Red / Deep Red
Revised Jun., 21, 2023


 を押して省略できます。
を押して省略できます。