はじめに
細胞は細胞内小器官(オルガネラ)を有し、それらの働きによりエネルギー産生やタンパク質の合成、分解などを行っています。オルガネラを代表するものとして、核、ミトコンドリア、小胞体及びリソソームなどがあります。以前よりそれらオルガネラの機能に関する研究は盛んに行われてきましたが、超解像イメージング技術など昨今のイメージング技術の発展により、各オルガネラの機能だけではなく各オルガネラ同士の連携も重要であることが分かってきました。その一つの例として、ミトコンドリアと小胞体の接点である mitochondria-associated ER membrane (MAM)があり、MAMに何らかの異常が起きるとミトコンドリアが機能不全となりアルツハイマー病に引き起こすことを示唆する報告もあります。ミトコンドリアと他のオルガネラの連携を観るためには、対象となるミトコンドリアの可視化が必要となります。その方法として、蛍光タンパク質によるラベル化、免疫染色及びミトコンドリア選択的低分子蛍光色素が一般的に用いられております。現在それらの方法にはそれぞれ課題があります。蛍光タンパク質によるラベル化は遺伝子導入が必要であり、免疫染色は一次抗体の動物種によって多重染色ができない場合があります。また、市販されているミトコンドリア選択的低分子蛍光色素は滞留性に乏しく、免疫染色との併用が難しいなどの課題があります。
滞留性の低いミトコンドリア選択的低分子蛍光色素の課題を克服するため、弊社ではタンパク質などと共有結合能を持つ新たなミトコンドリア選択的低分子蛍光色素MitoBright IM Redを開発しました。MitoBright IM Redは優れた滞留性を持っているため免疫染色との併用が可能です。
内容
| 1 Tube | 3 Tubes | |
| MitoBright IM Red for Immunostaining | 20 μl x 1 | 20 μl x 3 |
保存条件
-20°Cにて保存して下さい。
必要なもの(キット以外)
- 培地またはHBSS (Hanks balanced salt solution)
- マイクロピペット
溶液調製
MitoBright IM Red working solutionの調製
1 mmol/l MitoBright IM Red for Immunostainingを無血清培地で希釈し、1 μmol/l MitoBright IM Red working solutionを調製する。
- Working solutionは保存できません。調製したその日の内に、ご使用ください。
操作
- 細胞をディッシュに播種し、5% CO2存在下、37°Cで培養する。
- 培地を取り除き、培地またはHBSSを用いて1回洗浄する。
- 1 μmol/l MitoBright IM Red working solutionを添加し、5% CO2インキュベーター内に37°Cで30分間静置する。
- 上澄みを取り除き、培地またはHBSSを用いて2回洗浄する。
- 蛍光免疫染色を行う。
- 蛍光顕微鏡にて細胞を観察する。
実験例
Hela細胞を用いたミトコンドリアマーカーTom20との多重染色
- μ-slide 8 well plate (ibidi)にHela細胞(2.4 x 105 cell/ml, 200 μl)を播種し、37°C、5% CO2インキュベーター内で一晩培養した。
- 培地を取り除き、200 μlのMEM培地を用いて1回洗浄した。
- MitoBright IM Red working solution (1 μmol/l, 200 μl)を添加し、37°Cで30 分間インキュベートした。
- 上澄みを取り除き、200 μlのMEM培地を用いて2回洗浄した。
- 200 μlの4% パラホルムアルデヒド/PBSを添加し、15分間室温でインキュベートした。
- 上澄みを取り除き、200 μlのPBSを用いて3回洗浄した。
- 200 μlの0.1% Triton X-100/PBSを添加し、10分間室温でインキュベートした。
- 上澄みを取り除き、200 μlの10% Blocking One-P/PBSを添加し、1時間室温でインキュベートした。
- 上澄みを取り除き、200 μlの1 μg/ml anti-Tom20抗体を添加し、1時間室温でインキュベートした。
- 上澄みを取り除き、200 μlのPBSを用いて3回洗浄した。
- 200 μlの2 μg/ml Alexa647標識anti-Mouse IgGを添加し、1時間室温でインキュベートした。
- 上澄みを取り除き、200 μlのPBSを用いて2回洗浄した。
- 共焦点レーザー蛍光顕微鏡(LSM 800, Zeiss)で観察を行った。
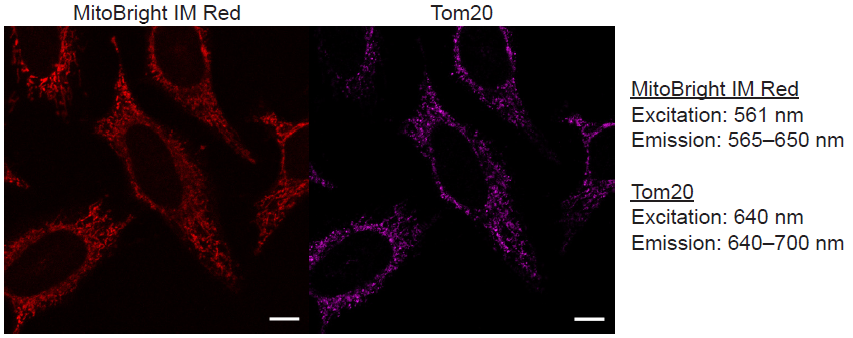
図1 MitoBright IM RedとTom20との多重染色画像
Hela細胞を用いた小胞体マーカーKDELとの多重染色
- μ-slide 8 well plate (ibidi) にHela細胞 (2.4 x 105 cell/ml, 200 μl) を播種し、37°C、5% CO2インキュベーター内で一晩培養した。
- 培地を取り除き、200 μlのMEM培地を用いて1回洗浄した。
- MitoBright IM Red working solution (1 μmol/l, 200 μl)を添加し、37°Cで30 分間インキュベートした。
- 上澄みを取り除き、200 μlのMEM培地を用いて2回洗浄した。
- 200 μl の4% パラホルムアルデヒド/PBSを添加し、15分間室温でインキュベートした。
- 上澄みを取り除き、200 μlのPBSを用いて3回洗浄した。
- 200 μl の0.1% Triton X-100/PBSを添加し、10分間室温でインキュベートした。
- 上澄みを取り除き、200 μl の 10% Blocking One-P/PBS を添加し、1時間室温でインキュベートした。
- 上澄みを取り除き、200 μl の 1 μg/ml anti-KDEL 抗体を添加し、一晩4°Cでインキュベートした。
- 上澄みを取り除き、200 μl のPBSを用いて3回洗浄した。
- 200 μlの2 μg/ml Alexa488 標識 anti-Mouse IgG を添加し、1時間室温でインキュベートした。
- 上澄みを取り除き、200 μl の PBS を用いて2回洗浄した。
- 共焦点レーザー蛍光顕微鏡 (LSM 800, Zeiss) で観察を行った。
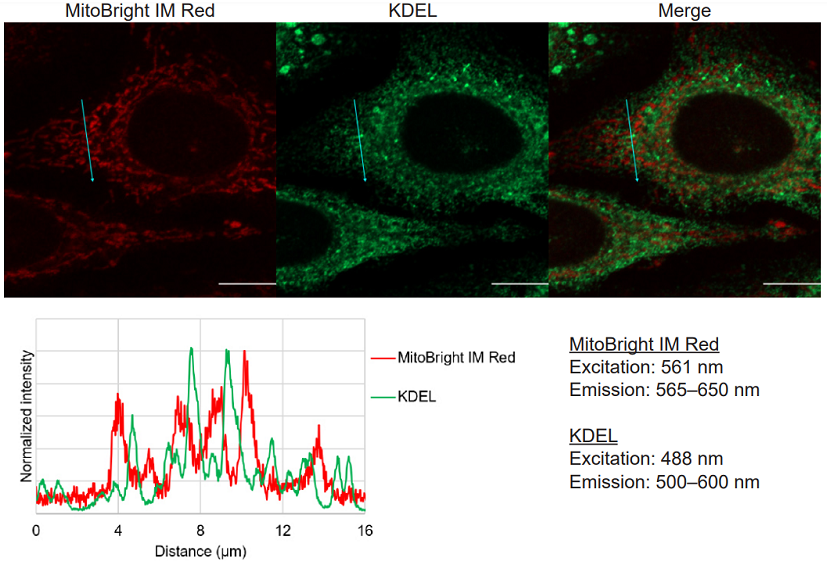
図2 MitoBright IM RedとKDELとの多重染色画像及びラインプロファイル
補足情報
MitoBright IM Red色素の蛍光特性
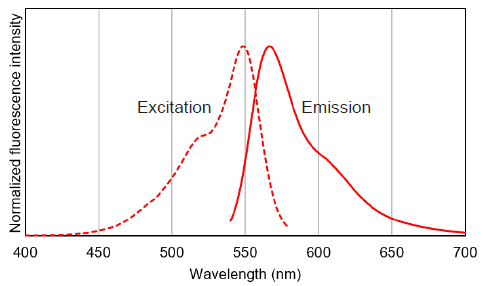
図 3 MitoBright IM Redの励起、蛍光スペクトル
よくある質問/参考文献
MT15: MitoBright IM Red for Immunostaining
Revised May., 31, 2023


 を押して省略できます。
を押して省略できます。