はじめに
ニコチンアミドアデニンジヌクレオチド(NAD)は、解糖系や電子伝達系、TCA回路など、細胞内の主要な代謝経路での酸化還元反応に関与する重要な補酵素です。NADは細胞内において、酸化型のNAD+と還元型のNADHとして存在していますが、これらの量を適切な状態で維持することが細胞機能には必須となっています。また、最近の研究では、NAD+量の低下と老化との関連も明らかにされており1)、老化関連疾患に対する研究における指標の1つとしてもよく用いられています。
NAD/NADH Assay Kit-WSTは、細胞内の総NAD+/NADH量、NADH量およびNAD+量の定量および、NAD+とNADHの比率を測定することができるキットです。本キットに含まれる抽出バッファーを用いて調製した細胞ライセートを加熱処理することにより、細胞内NADH量のみを定量することができ、別途測定した総NAD+/NADH量からNADH量を差し引くことで、細胞内NAD+量を求めることが可能です。
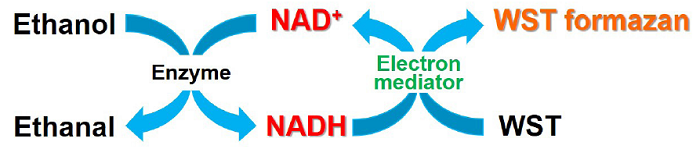
図1 NAD/NADH Assay Kit-WSTによる測定原理
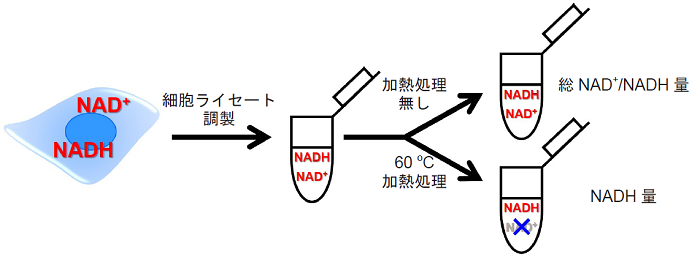
図2 NAD/NADH Assay Kit-WSTを用いた総NAD+/NADH量、NADH量およびNAD+量の検出方法
キット内容
| NAD/NADH Extraction Buffer | 20mL x 1 |
| NAD/NADH Control Buffer | 20mL x 1 |
| Standard Buffer | 10mL x 1 |
| Assay Buffer | 5.5mL x 1 |
| Dye Mixture (赤キャップ) | 550μL x 1 |
| Enzyme (緑キャップ) | x 1 |
| Standard (青キャップ) | x 1 |
| Filtration Tube | x 12 |
- 本キットでは、n=3の測定で標準サンプル8点と測定用サンプル12サンプル分の測定が可能です。そのため、Filtration Tubeは12サンプル分を同梱しております。12サンプル以上の測定試料を調製する際は、別途Filtration Tube(ナノセップ遠心ろ過デバイス(10K)([OD010C33]、PALL社))をご準備頂く必要があります。
保存条件
0-5℃で保存して下さい。
必要なもの (キット以外)
- プレートリーダー(450 nmの吸光フィルター)
- 96穴マイクロプレート
- インキュベーター(37℃、60℃)
- 20-200 μLのマルチチャンネルピペット
- 100-1000 μL、20-200 μL、2-20 μLマイクロピペット
使用上のご注意
- キットの中の試薬は、室温に戻してからご使用下さい。
- 輸送中の振動等により、内容物がアシストチューブ壁面やキャップ裏面に付着している場合がありますので、開封前に振り落としてからご使用下さい。
- 正確な測定値を得るために、1つの測定試料につき複数(n=3以上)のウェルをご使用下さい。
- Working solutionをサンプルに加えると直ちに発色が始まります。各ウェル間のタイムラグによる測定誤差を少なくするためにマルチチャンネルピペットをご使用ください。
- 測定試料は、検量線範囲内に入るように希釈したものを数種類調製し、測定に用いて下さい。
溶液調製
Enzyme stock solutionの調製
EnzymeにPBS 35 μLを加え、ピペッティングにより溶解する。
- 内容物がチューブ底面から外れ、チューブ壁面やキャップ裏面に付着している場合があります。開封前に内容物を底面に落としてからご使用下さい。
- Enzyme stock solutionは氷浴上で使用し、溶解後は冷蔵保存(0-5 ℃)して下さい(2ヶ月間安定)。
Standard stock solution (10 mmol/L)の調製
Standardに超純水 20 μLを加え、ピペッティングにより溶解する。
- 内容物がチューブ底面から外れ、チューブ壁面やキャップ裏面に付着している場合があります。開封前に内容物を底面に落としてからご使用下さい。
- Standard stock solutionは氷浴上で使用し、溶解後は冷蔵保存(0-5℃)して下さい(2ヶ月間安定)。
Working solutionの調製
- コニカルチューブにDye Mixtureを加え、Assay Bufferで希釈する。
- 操作(1)で調製した溶液にEnzyme stock solutionを加える。
- Working solution調製における各溶液使用量は、表1を参照して下さい。
- Working solutionは光に不安定であるため、使用直前に調製し、調製後はアルミホイルで覆うなどして遮光して下さい。また、調製後のWorking solutionは保存できません。その日のうちにお使い下さい。
表1 Working solution調製例 48ウェル分 96ウェル分 Dye Mixture 270 μL 540 μL Assay Buffer 2.43 mL 4.86 mL Enzyme stock solution 13.5 μL 27 μL
操作
1. 測定用サンプルの調製
- 細胞(2.5-10×105 cells)を1.5 mLマイクロチューブに準備する。
- 300×gで5分間遠心し、上清を除去する。
- PBS 500 μLを加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去する。
- NAD/NADH Extraction Buffer 300 μLを加え、ピペッティングにより細胞を溶解した後、12,000×gで5分間遠心する。
- ピペッティング後、溶液の粘性が高いと遠心後の分離が困難になる場合があります。その際は、シリンジに25G程度の細い針を付け、サンプル溶液をシリンジでスムーズに出し入れができるまで(20-30回)混合してお使い下さい。
- 上清250 μLをMWCO 10Kフィルトレーションチューブに移し、12,000×gで10分間遠心する。
- 測定用サンプルは、総NAD+/NADH量およびNADH量の両方を測定する場合、合計200 μL以上は必要です。
- 遠心後の濾液が200 μL以上ない場合は、遠心時間を延長して下さい。
- 得られた濾液を、1.5 mLマイクロチューブ2本に100 μLずつ移し、総NAD+/NADH量およびNADH量測定試料とする(図3参照)。
- NADH量測定試料を60℃で60分間インキュベートする。
- 本操作により、NADH量測定試料中に含まれるNAD+を分解します。
- 総NAD+/NADH量測定試料は測定までの間、氷浴中で保存して下さい。
- インキュベート後、測定試料を室温まで冷却する。
- 操作 6. および操作 8. で調製した、総NAD+/NADH量およびNADH量測定試料が入ったチューブそれぞれに、NAD/NADH Control Buffer 100 μLを加えたものを測定に用いる(Sample)。
- 測定試料は1ウェルあたり50 μL必要です。
- 測定試料は、検量線範囲内に入るようにNAD/NADH Control Bufferで希釈したものを数種類調製してから測定して下さい。
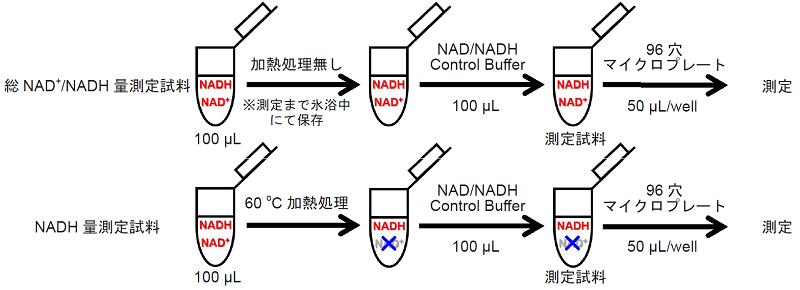
図3 測定サンプルの調製方法
2. Standard solutionの調製
- 10 mmol/L Standard stock solution 2 μLを超純水198 μLで希釈し、100 μmol/L Standard solutionを調製する。
- 操作 1. で調製した100 μmol/L Standard solution 10 μLをさらにStandard Buffer 490 μLで希釈し、2 μmol/L Standard solutionを調製する。さらに順次2倍希釈していき、標準液(2, 1, 0.5, 0.25, 0.125, 0.0625, 0.0313, 0 μmol/L)とする(図4参照)。
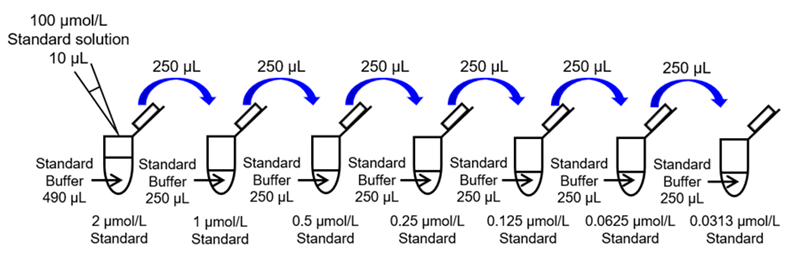
図4 Standard solutionの調製方法
3. 測定
-
- Standard solutionおよびSampleを50 μLずつ、各ウェルに入れる(図5参照)。
- 正確な測定値を得るために、1つの測定試料につき複数(n=3以上)のウェルをご使用下さい。
- Working solution 50 μLを各ウェルに入れる。
- Working solutionを加えると直ちに発色が始まります。各ウェル間のタイムラグを少なくするためにマルチチャンネルピペットをご使用下さい。
- 37℃で60分間インキュベートする。
- インキュベートする際は、溶液の揮発を防ぐため、マイクロプレート用シール等をご使用下さい。
- プレートリーダーを用いて450 nmの吸光度を測定する。
- 測定試料(Sample)中の総NAD+/NADH量およびNADH量を検量線より求める。
- これにより求められた値は、調製した測定試料溶液中の濃度です。希釈前の試料中に含まれる濃度は、得られた測定値と試料の希釈倍率より算出して下さい。
NAD+量=総NAD+/NADH量-NADH量
- Standard solutionおよびSampleを50 μLずつ、各ウェルに入れる(図5参照)。
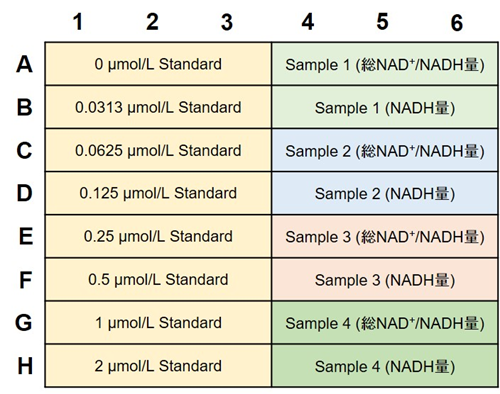
図5 Standard solutionとサンプルのプレートレイアウト例(n=3)
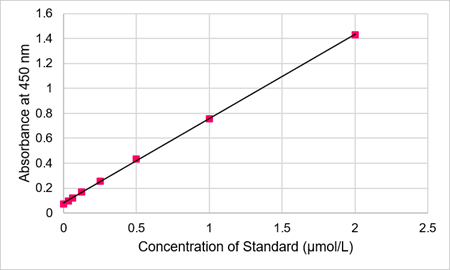
図6 Standard検量線の例
実験例
HeLa細胞中総NAD+/NADH量、NAD+量、NADH量、NAD+/NADH比の解析
- HeLa細胞(2.5および5.0×105 cells/tube)をそれぞれ1.5 mLマイクロチューブに回収した。
- 300 x gで5分間遠心し、上清を除去した。
- PBS 500 μLを加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去した。
- NAD/NADH Extraction Buffer 300 μLを加え、ピペッティングにより細胞を溶解した後、12,000×gで5分間遠心した。
- 上清250 μLをMWCO 10Kフィルトレーションチューブに移し、12,000×gで10分間遠心した。
- 得られた濾液をそれぞれ1.5 mLマイクロチューブ2本に100 μLずつ移し、総NAD+/NADH量およびNADH量の測定試料とした。総NAD+/NADH量測定試料は測定まで氷浴中にて保存した。
- NADH量測定試料を60℃で60分間インキュベートし、室温まで冷却した。
- 総NAD+/NADH量およびNADH量測定試料が入ったチューブに、NAD/NADH Control Buffer 100 μLをそれぞれ加え、測定試料とした。
- Standard solutionを調製し、標準液を調製した(Standard solutionの調製参照)。
- 調製した測定試料およびStandard solutionを50 μLずつ、96穴プレートに入れた。
- 調製したWorking solution 50 μLを各ウェルに加えた。
- 37℃で60分間インキュベートした。
- プレートリーダーを用いて450 nmの吸光度を測定し、測定試料中総NAD+/NADH量およびNADH量を検量線より求めた。NAD+量は、求めた総NAD+/NADH量からNADH量を引くことにより算出した。
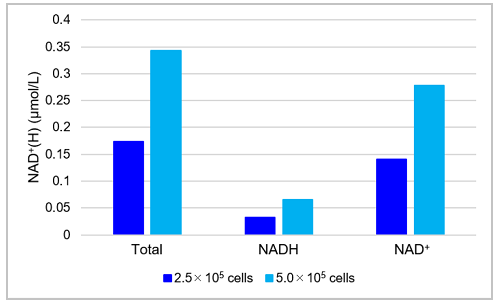
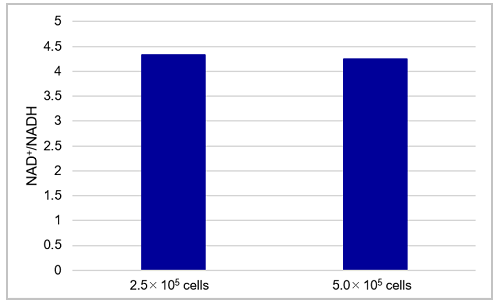
図7 HeLa細胞中総NAD+/NADH量、NAD+量、NADH量およびNAD+/NADH比
参考文献
- S.Imai, et al., Trends Cell Biol., 2014, 24, 464.
よくある質問/参考文献
N509: NAD/NADH Assay Kit-WST
Revised Oct., 26, 2023


 を押して省略できます。
を押して省略できます。

