はじめに
細胞膜は細胞の内外を隔てる役割を担っており、細胞の移動や伸張、神経シグナル伝達などの細胞機能に関係している。そのため、細胞膜の異常は細胞の状態やチャネル病のような様々な疾患と密接に関連しており、非常に重要なバイオマーカーの一つとして考えられています 1) 。
細胞膜の形態や動態を観察する際には、低分子色素を用いたラベル化、遺伝子導入による蛍光タンパク質の発現及び抗体を用いた免疫染色が使用されます。しかしながら、これらの方法は蛍光タンパク質の安定的な発現の難しさや、固定化細胞に限定される欠点があります。一方、低分子色素を用いる方法は簡便な操作方法かつ生細胞で使用できるため、最も広く使われています 2)。既存の低分子色素は細胞膜への滞留性が低いため、長時間の形態観察に課題があります。さらに、色素の水溶性が低いため特殊な溶液を用いて希釈する必要があります 2, 3)。 PlasMem Bright 色素は、これらの課題を克服した色素です。
PlasMem Bright 色素を用いて細胞膜の観察を行った場合、染色後一日以上細胞膜を染色し続けることが可能です。また、既存試薬に比べ水溶性に優れているため、ご使用の培地を用いて染色することが可能です。本製品は、DMSO 溶液品として提供しており、細胞膜を簡便に染色することができます。2 色 ( 緑色、赤色 ) の蛍光色を取り揃えており、多重染色など様々な用途に適用可能です。
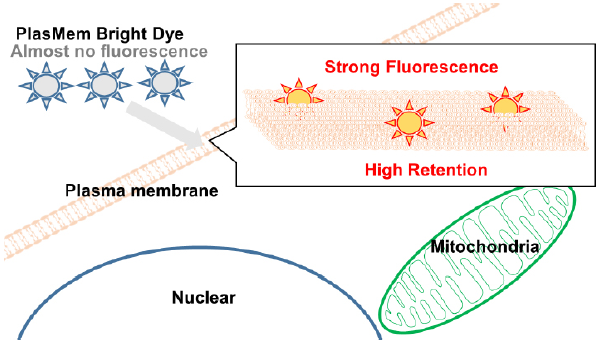
図 1 PlasMem Bright 色素の染色メカニズム
PlasMem Bright 色素の蛍光特性
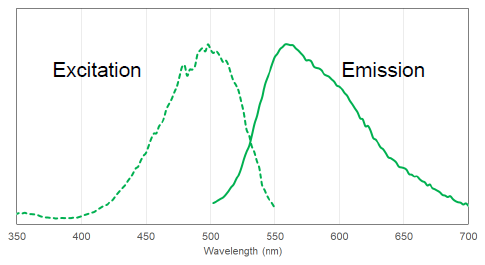
図 2 PlasMem Bright Green の励起、蛍光スペクトル
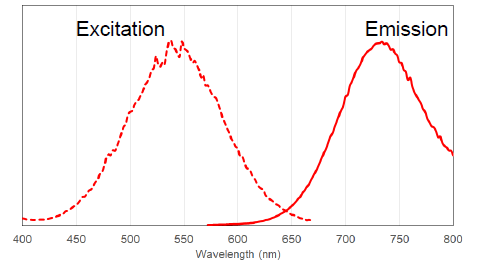
図 3 PlasMem Bright Red の励起、蛍光スペクトル
内容
| P504 PlasMem Bright Green | 100 µl x 1 |
| P505 PlasMem Bright Red | 100 µl x 1 |
必要なもの
- 培地または HBSS
- マイクロピペット
- マイクロチューブ
溶液調製
PlasMem Bright working solution の調製
- PlasMem Bright Green 溶液を培地で 200 倍希釈し、PlasMem Bright working solution を調製する。
- PlasMem Bright Red 溶液を培地で 100 倍希釈し、PlasMem Bright working solution を調製する。
- PlasMem Bright Red は保存期間中に色素が析出する可能性があります。色素が析出している場合、加温 (37oC) を行い色素を完全に溶解させることを推奨します。
- Working solution は保存できません。調製したその日のうちにご使用ください。
- Working solution 調製後もできる限り遮光にて( アルミラミジップに入れ) 使用して下さい。
- 染色時の蛍光強度が弱い場合は、染色濃度を検討してください。
( 推奨濃度 Green:100 ~ 200 倍希釈、Red: 50 ~ 100 倍希釈 )
操作
- 細胞をディッシュに播種し、5% CO2存在下、37 oC 設定のインキュベーター内で培養する。
- 培地を取り除き、PlasMem Bright working solution を添加し、インキュベーター内 (37 oC、5% CO2存在下 ) に 5 分間静置する。
- 細胞を蛍光顕微鏡で観察する。
- 長期間細胞を観察する場合は、細胞を HBSS にて洗浄後ご使用の培地に置換し、観察を行ってください。
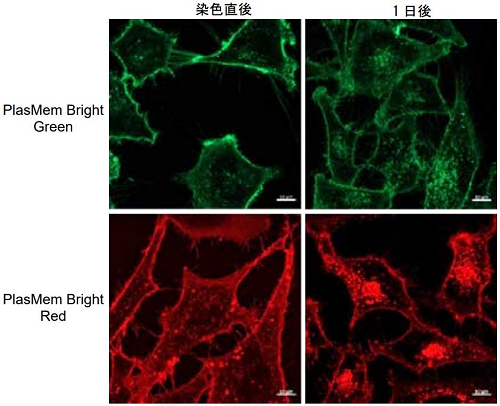
HeLa 細胞を用いた細胞膜の経過観察
- µ-slide 8 well plate (ibidi) に HeLa 細胞 (2.4x105 cells/ml, MEM, 10% fetal bovine serum, 1% penicillin-streptomycin) を播種し、インキュベーター内 (37 oC、5% CO2存在下 ) で一晩培養した。
- 培地を取り除き、PlasMem Bright working solution(200 µl) を添加し、37 oC で 5 分間インキュベートした。
- 上澄みを除去し、200 µl の MEM 培地に置換し、共焦点レーザー顕微鏡で観察した。
-
<検出条件>
・PlasMem Bright Green
(染色濃度: 200倍希釈)
(Ex: 488 nm, Em: 500–560 nm)
・PlasMem Bright Red
(染色濃度: 100倍希釈)
(Ex: 561 nm, Em: 560–700nm)
図 4 染色直後および 1 日後における HeLa 細胞の染色画像
分化誘導した SH-SY5Y 細胞を用いた軸索中のミトコンドリアの観察
- µ-slide 8 well plate (ibidi) に SH-SY5Y 細胞 (2.4x105 cells/ml, DMEM/F11, 10% fetal bovine serum, 1% penicillin-streptomycin) を播種し、インキュベーター内 (37oC、5% CO2存在下 ) で一晩培養した。
- 培地を取り除き、DMEM/F11 培地 (10 µmol/l Retinoic acid, 1% FBS) を添加し、二日おきに培地を入れ替え、 7 日間培養し分化誘導した。
- 染色液 (Hoechst 33342: 2 µg/ml, PlasMem Bright Green: 200 倍希釈 or PlasMem Bright Red: 100 倍希釈 , MitoBright LT: 0.1 µmol/l) 200 µl を添加し、37oC で 15分間インキュベートした。
- 上澄み液を取り除き、HBSSで細胞を 2回洗浄した。
- DMEM/F11培地を200 µl添加し、共焦点レーザー顕微鏡で細胞の観察を行った。
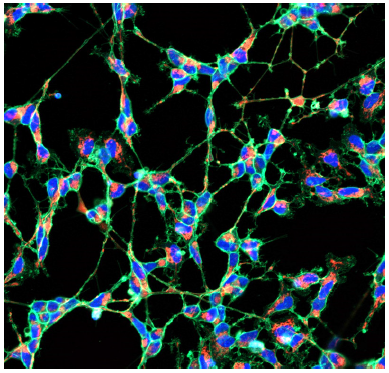
-
<検出条件>
(青) Hoechst 33342: 405 nm (Ex), 400-450 nm (Em)
(緑) PlasMem Bright Green: 488 nm (Ex), 500–560 nm (Em)
(赤) MitoBright LT Red: 561 nm (Ex), 560–620 nm (Em)
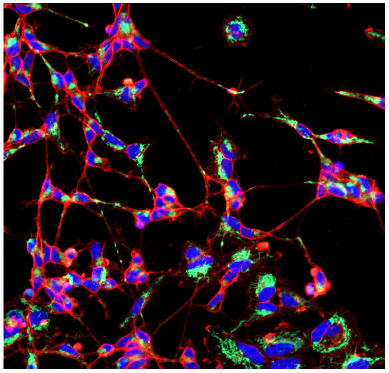
-
<検出条件>
(青) Hoechst 33342: 405 nm (Ex), 400-450 nm (Em)
(緑) MitoBright LT Green: 488 nm (Ex), 500–560 nm (Em)
(赤) PlasMem Bright Red: 561 nm (Ex), 560–700 nm (Em)
図 5 分化誘導した SH-SY5Y 細胞の細胞膜とミトコンドリア染色画像
参考文献
- Shi, L., et al., Angewandte Chem. Int. Ed., 2020, 59, 9962-9966.
- Collot, M., et al., Bioconjugate Chem., 2020, 31(3), 875-883.
- Shimomura, T., et al. bioRxiv, 2020, doi: https://doi.org/10.1101/2020.02.02.931295.
P504_P505: PlasMem Bright Green/PlasMem Bright Red
Revised Jun., 26, 2023


 を押して省略できます。
を押して省略できます。