はじめに
ROS (Reactive oxygen species)は主にミトコンドリアでのATP合成過程で発生する反応性の高い酸素種です。情報伝達のシグナル物質としての役割や、マクロファージなどの免疫機能の一部として重要である一方、DNAやタンパク質に対し酸化剤として作用することで様々な疾病や老化を引き起こす要因となります。
細胞内のROSを検出するには、細胞内に取り込まれた後にROSによって酸化され発蛍光するDCFH-DAが広く使われています。しかし、この色素は感度が低い、染色後に細胞から漏れ出てしまう点、観察光によって自動酸化され発蛍光してしまう1)点で課題があります。
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-は、これらの課題を克服した製品です。既存のDCFH-DAより感度が高く、細胞内に取り込まれた後にタンパク質と共有結合するため細胞外に漏れ出ることはありません。また、観察光による自動酸化が抑えられているため詳細にROSの検出が可能です。さらには、キット付属のBufferを使って染色することで、より細胞にダメージを与えにくい状態でROSを検出することができます。
キット内容
| Photo-oxidation Resistant DCFH-DA Dye | 100 nmol×1 |
| Loading Buffer (10x) | 1 ml×1 |
保存条件
0–5℃ にて保存して下さい。
必要なもの (キット以外)
- 蛍光検出器 (蛍光顕微鏡、蛍光プレートリーダーもしくはフローサイトメーター)
- インキュベーター(37℃)
- マイクロピペット(100–1000 μl, 20–200 μl, 1–10 μl)
- コニカルチューブ
- Hanks' Balanced Salt Solution (HBSS)
- Dimethyl Sulfoxide (DMSO)
使用上のご注意
- キット中の試薬は使用前に室温に戻してからご使用下さい。
- 輸送中の振動等により、内容物がマイクロチューブ壁面やスクリューキャップ裏面に付着している場合がありますので、開封前に内容物を底面に落としてからご使用ください。
- 検出器毎の推奨測定波長は表1を参照してください。
表1 検出器別の推奨測定波長
| 検出器 | 蛍光プレートリーダー | 蛍光顕微鏡 | フローサイトメーター |
| 測定波長 | Excitation: 490–520 nm Emission: 510–540 nm |
・共焦点レーザー顕微鏡 Ex/Em: 488/500–550 nm ・落射型顕微鏡 GFPもしくはFITCフィルター |
FITCフィルター |
溶液調製
Loading Buffer Solutionの調製
Loading Buffer (10x)を超純水を用いて10倍に希釈する。容器毎の必要量は表2を参照してください。
- 希釈したLoading Buffer solutionは使用する当日に必要な分量を調製し、その日の内にご使用ください。残ったLoading Buffer (10x)は4℃で保存してください。
表2 容器別 Loading Buffer solutionの推奨使用量
| 容器 | 35-mm dish | ibidi 8-well plate | 96-well black plate (clear bottom) | Sample tube (Flow Cytometer) |
| 必要量 | 2 ml/dish | 200 μl/well | 100 μl/well | 0.5 ml/sample |
Photo-oxidation Resistant DCFH-DA Dye DMSO Stock Solutionの調製
Photo-oxidation Resistant DCFH-DA Dye 100nmolを含むチューブに10 μlのDMSOを加えピペッティングにより溶解し、10 mmol/l DMSO stock solutionを調製する。
- Photo-oxidation Resistant DCFH-DA Dyeはチューブに無色フィルム状で付着しており、目視では確認しづらい状態となっております。
- 調製後は遮光し、-20℃で保存して下さい (1ヶ月間安定)
Photo-oxidation Resistant DCFH-DA Dye Working Solutionの調製
Photo-oxidation Resistant DCFH-DA Dye DMSO Stock SolutionをLoading Buffer Solutionで1000倍希釈し、10 μmol/l working solutionを調製する。
- working solutionは保存できません。調製したその日の内にご使用ください。
操作
- 表3を参考に細胞をディッシュまたはプレートに播種し、5% CO2存在下、37℃設定のインキュベーター内で 一晩培養する。
- 培地を取り除き、HBSSを用いて細胞を2回洗浄する。
表3 検出器別 細胞播種容器
検出器 蛍光プレートリーダー 蛍光顕微鏡 フローサイトメーター 容器 96-well black plate (clear bottom) 96-well black plate (clear bottom)
ibidi 8-well plate
35 mm dish6-well plate - 上澄みを液を除去し、調製したworking solutionを添加し、インキュベーター(37℃, 5% CO2存在下)で30分間インキュベートする。
- working solutionを除去し、HBSSを用いて細胞を2回洗浄する。
- 上清除去後、薬剤等で処理する。
- 上清を吸引除去しHBSSを用いて細胞を2回洗浄後、HBSSを加え検出器で測定する。
- 薬剤処理後に色素で染色することも可能です。その場合は操作3.と操作5.の順番を逆にしてください。
- 接着細胞の種によっては染色後の洗浄操作により細胞が剥がれやすくなる場合があります。その場合は細胞播種後の培養時間を延ばしてください。
実験例1
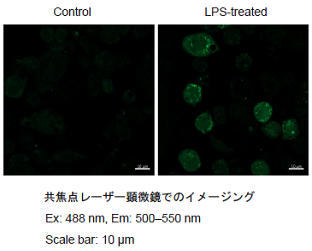
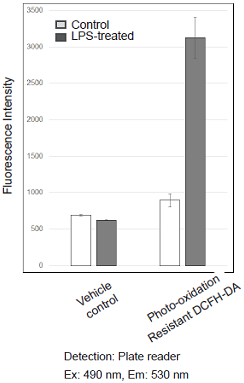
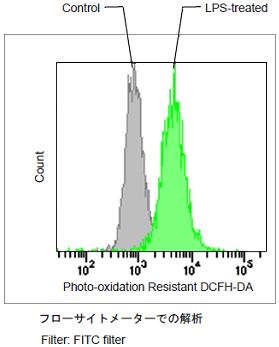
Lipopolysaccharide (LPS)処理したRAW264.7細胞のROS検出
- 96-well black plateもしくは6-well plateにRAW264.7細胞 (2×105 cells/ml, 100 μl, DMEM, 10% fetal bovine serum,1% penicillin-streptomycin)を播種し、インキュベーター内 (37℃、5% CO2存在下)で一晩培養した。
- 培地を取り除き、DMEM培地で希釈した500 ng/ml濃度のLPS/DMEMを加え、インキュベーター内(37℃、5%CO2存在下)で24時間培養した。
- 上清を取り除きHBSSで細胞を2回洗浄後、Photo-oxidation Resistant DCFH-DA Dye Working Solutionを 100 μl 添加し、インキュベーター内 (37℃、 5% CO2存在下)で30分間インキュベートした。
- working solutionを除去し、HBSSを用いて細胞を2回洗浄後HBSSを加え各検出器で蛍光強度を測定した。
|
|
図1 各検出系におけるRAW264.7細胞のROSの検出
実験例2
HeLa細胞を用いたミトコンドリアマーカーTom20との多重染色
- μ-Slide 8-well plate (ibidi)にHeLa細胞 (2×105 cells/ml, 200 μl, MEM, 10% fetal bovine serum, 1% penicillin-streptomycin)を播種し、インキュベーター内 (37℃、5% CO2存在下)で一晩培養した。
- 培地を取り除きHBSSで細胞を2回洗浄後、Photo-oxidation Resistant DCFH-DA Dye Working Solutionを200 μl 添加し、インキュベーター内 (37℃、5% CO2存在下)で30分間インキュベートした。
- 上澄みを取り除き、HBSSを用いて細胞を2回洗浄した。
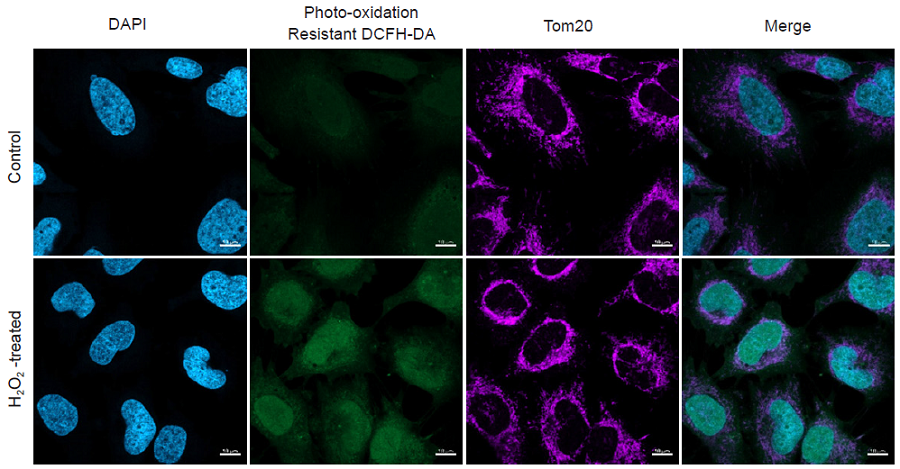
- 上清除去後、100 μmol/lの過酸化水素/HBSS溶液を加えインキュベーター内 (37℃、5% CO2存在下)で30分間インキュベートした。
- 上澄みを取り除き、HBSSを用いて細胞を2回洗浄した。
- 上澄みを取り除き、200 μlの4% PFA/PBSを加え、室温で15分間インキュベートし細胞を固定化した。
- 上澄みを取り除き、PBSを用いて細胞を3回洗浄した。
- 上澄みを取り除き、200 μlの0.1% Triton X-100/PBSを添加し、室温で10分間インキュベートした。
- 上澄みを取り除き、PBSを用いて細胞を3回洗浄した。
- 上澄みを取り除き、200 μlのblocking solutionを添加し、室温で20分間インキュベートした。
- 上澄みを取り除き、200 μlの1 μg/ml anti-Tom20 antibody (sc-17764, Santa Cruz Biotechnology, Inc.)/blocking solutionを添加し、4℃で一晩インキュベートした。
- 上澄みを取り除き、PBS-Tを用いて細胞を3回洗浄した。
- 上澄みを取り除き、200 μlのAlexa 647 (2 μg/ml) 標識anti-Mouse IgGと1 μg/ml DAPI/blocking solutionを添加し、室温で一時間インキュベートした。
- 上澄みを取り除き、PBS-Tを用いて細胞を2回洗浄した。
- 共焦点レーザー蛍光顕微鏡 (LSM800, Zeiss)で観察した。
- blocking solution: 10% Blocking One/PBS-T
|
検出器: 共焦点レーザー顕微鏡 |
図2 蛍光顕微鏡による過酸化水素処理したHeLa細胞の観察
実験例3
Lipopolysaccharide (LPS)処理によるRAW264.7細胞のROS検出(タイムラプスイメージング)
- 96-well black plateにRAW264.7細胞 (2×105 cells/ml, 100 μl, DMEM, 10% fetal bovine serum, 1% penicillin-streptomycin)を播種し、インキュベーター内 (37℃、5% CO2存在下)で一晩培養した。
- 培地を取り除きHBSSで細胞を2回洗浄後、Photo-oxidation Resistant DCFH-DA Dye Working Solutionを 100 μl 添加し、インキュベーター内 (37℃、5% CO2存在下)で30分間インキュベートした。
- 上澄みを取り除き、HBSSを用いて細胞を2回洗浄した。
- 上清を取り除き、DMEM培地で希釈した500 ng/ml濃度のLPS/DMEMを加え蛍光顕微鏡でタイムラプスイメージングを行った。
- 時間毎の蛍光輝度を算出し数値化した。
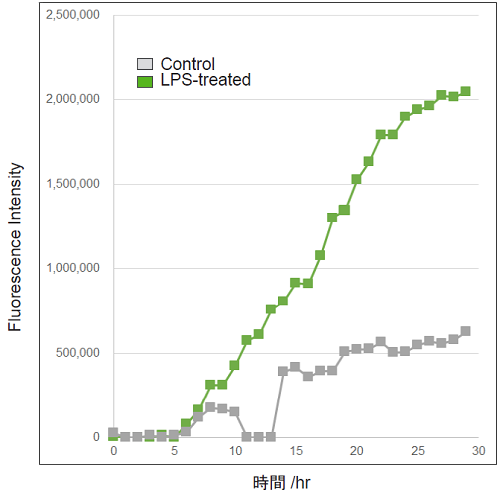
図3 LPS刺激によるRAW264.7細胞内のROS発生量の経時的変化
参考文献
- M. Afzal, et al., BBRC, 2003, 304, 619–624
よくある質問/参考文献
R253: ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-
Revised Sep., 11, 2023


 を押して省略できます。
を押して省略できます。