はじめに
Superoxide dismutase(SOD) 活性を測定する方法には、シトクロムc法、NBT法、エピネフリン法および亜硝酸法などがあります。このうちキサンチン/キサンチンオキシダーゼをスーパーオキシド生成系とし、テトラゾリウム塩の還元反応を利用したNBT 法は操作が簡便な方法ですが、生成するホルマザンが水に溶けにくいことや、NBTがキサンチンオキシダーゼと直接反応するため100%SOD阻害率が測定できない等の問題をかかえています。
SOD Assay Kit - WSTは高水溶性のホルマザンを生成するテトラゾリウム塩WST-1を使用しているため、ホルマザンの析出がありません。またWST-1はキサンチンオキシダーゼと直接反応しないため、100%SOD阻害率を測定できます。96 穴マイクロプレートに対応していますので、一度に多検体の測定が可能です。
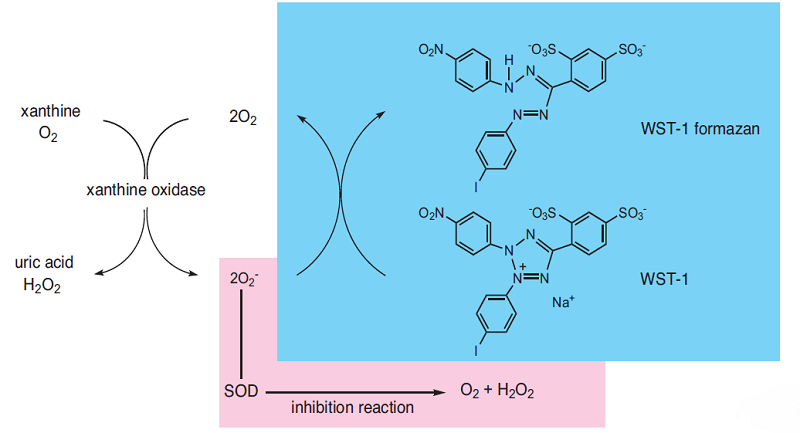
図1. SOD Assay Kit - WST の測定原理
キット内容
| WST solution | 5 ml x 1 本 |
| Buffer solution | 100 ml x 1 本 |
| Enzyme solution | 100 μl x 1 本 |
| Dilution buffer | 50 ml x 1 本 |
保存条件
0 ~ 5℃で保存してください。
必要なもの ( キット以外)
- プレートリーダー (450 nm フィルター)
- 2-20 μl と20-200 μl のマルチチャンネルピペット
- 96 穴 プレート
- インキュベーター(37℃ )
使用上のご注意
- サンプルの希釈には添付のDilution buffer もしくは生理食塩水をお使いください。
- Enzyme solution は酵素の懸濁液ですので、静置しておくと酵素が沈殿します。チューブを良く振るかピペッティングにより均一な懸濁液にしてご使用ください。
- 正確な測定値を得るために、1 つのサンプルにつき複数(n=3 以上)のウェルをお使いください。( 図3 参照).
- Enzyme working solution を加えると直ちにスーパーオキシドの発生が始まりますので、ウェル間の反応時間差を少なくするためにマルチチャンネルのピペットをお使いください。
測定前処理
- サンプルの前処理につきましては、弊社ホームページ、「プロトコル・SOD 様活性を測定したい」をご覧ください。
(http://www.dojindo.co.jp/technical/protocol.html)
溶液調整
96 well プレート一枚分
WST working solution
WST solution 1 ml をBuffer solution 19 ml で希釈する。
- 希釈後0 ~ 5℃保存で2 ヶ月使用できます。
Enzyme working solution
Enzyme solution をピペッティング操作などにより、均一な懸濁液とする。15 μl を取り、Dilution buffer 2.5 mlで希釈する。
- 希釈後0 ~ 5℃保存で3 週間使用できます。
Sample solution
前処理したサンプル溶液をDilution buffer または生理食塩水で希釈する。
例)希釈率:1( 希釈なし), 1/5, 1/52, 1/53, 1/54, 1/55, 1/56
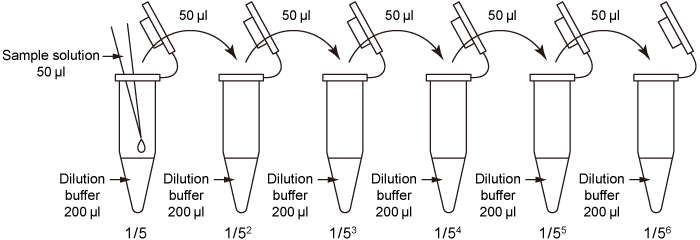
図2. サンプル溶液調製例
溶液添加
| sample | blank1 | blank2 | blank3 | |
| サンプル溶液 | 20 μl | - | 20 μl | - |
| 純水 | - | 20 μl | - | 20 μl |
| WST working solution | 200 μl | 200 μl | 200 μl | 200 μl |
| Dilution buffer | 20 μl | 20 μl | ||
| Enzyme working solution | 20 μl | 20 μl | - | - |
blank 1 : 阻害なしの全発色、blank 2 : sample blank、blank 3 : 試薬blank
- 着色の強いサンプルの場合は、サンプルの希釈ごとにblank 2 を測定してください。
SOD assay 操作
- 各ウェルにサンプル溶液(sample, blank 2)もしくは純水(blank 1, blank 3)を20 μl ずつ入れる。
- 各ウェルにWST working solution を200 μl ずつ加え、ピペッティングまたはプレートミキサーでよく混ぜる。
- blank 2 とblank 3 のウェルにDilution buffer を20 μl ずつ加える。
- サンプル溶液を入れたウェルとblank 1 のウェルにEnzyme working solution を20μl ずつ加える。
- Enzyme working solution を加えるとすぐにスーパーオキシドの発生が始まります。ウェル間の反応時間差を少なくするためにマルチチャンネルのピペットをお使いください。
- 37℃で20 分間インキュベートする。
- プレートリーダーで450 nm の吸光度を測定する。
- SOD 活性値( 阻害率%) を下記の計算式により求める。
SOD 活性値( 阻害率%) = [(Ablank 1 - Ablank 3) - (Asample - Ablank 2)] / (Ablank 1 - Ablank 3) x 100
活性値は吸光度変化量からも求めることができます(kinetic assay)。吸光度が直線的に上昇する領域で測定してください。
15 ~ 20 分の間では良好な直線性が得られます。
活性値は下記の計算式により求められます。
SOD 活性( 阻害率%) = [(S1 - S3) - (SS - S2)] / (S1 - S3) x 100
S1: blank1 の傾き, S2: blank2 の傾き, S3: blank3 の傾き, SS: sample の傾き
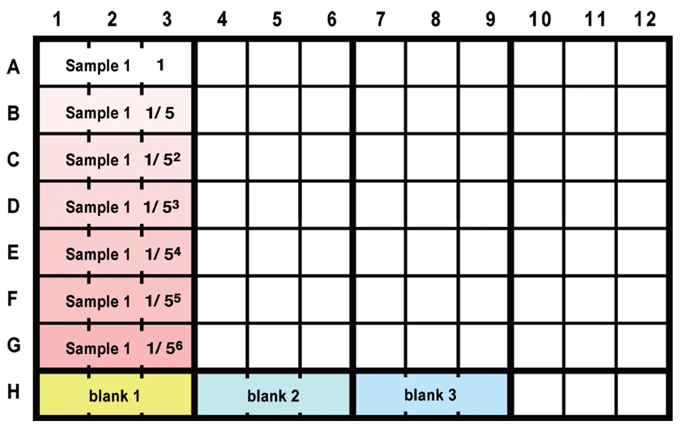
図3 プレートレイアウト例(n=3の場合)
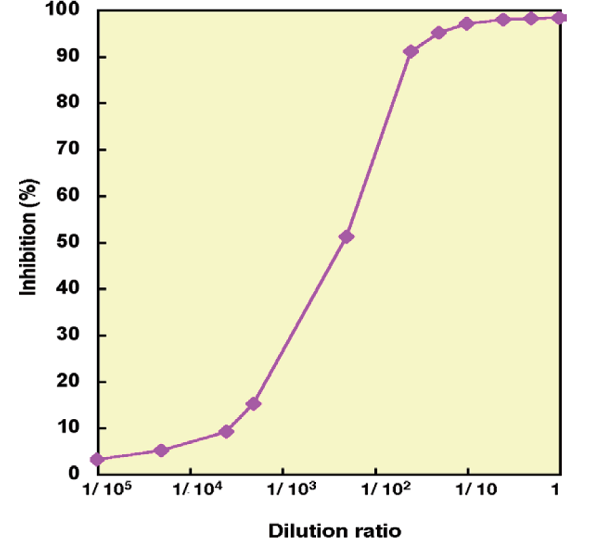
図4 阻害曲線の例
阻害曲線
SOD Assay Kit - WST を使って作成した阻害曲線の例を図4. に示す。阻害率100% が測定できている。
ユニット(U) 定義
『 WST 還元の50% 阻害を示すサンプル溶液20 μl に含まれるSOD を1 単位(U) とする 』
WST 法によるユニット定義はCytochrome c 法によるユニット定義とは異なりますのでご注意ください。
ユニット(U) の求め方
- 阻害曲線より阻害率50%(IC50) の時の希釈率を求める。
- 阻害率50%(IC50) を示す点が1 ユニット(U) であるため、ここに希釈倍率を掛けることで元のサンプルのSODユニットが算出できる。( 容量あるいは質量などに換算して、濃度として算出できる。)
-
ユニット(U)規定例:赤血球
(前処理にて1/108希釈)
- 阻害曲線(図5)よりIC50値を求める。サンプルのIC50値の希釈率は「1/1.8」となる。
- 『1/1.8希釈された液、「20 μL中」に存在する SOD が1ユニットである』ことから、希釈前サンプルは「1.8 U」となる。
- アッセイで添加したサンプル溶液は20 μL (0.02 mL)であるので、サンプル 1 mLあたりのunit数を計算する。
1.8 / 0.02 = 90.0 U/mL - 元々の試料にはSOD抽出過程(前処理)での希釈があるため、この希釈(1/108)を考慮して血液中のユニット数を計算する。
108 x 90.0 = 9,720 U/mL of blood- ここでは容量に換算しています。タンパク質や質量(mg)に換算したい場合は、さらに別途換算してください。
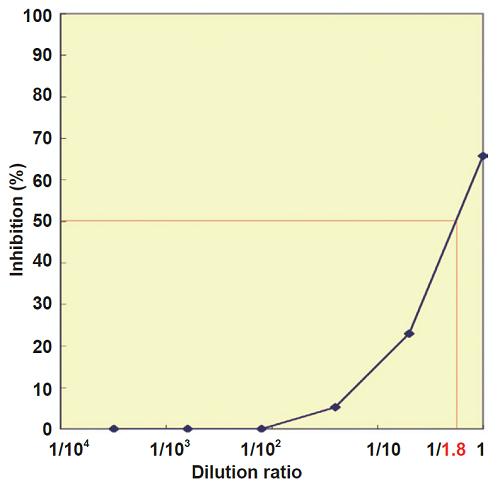
図5 赤血球サンプルを用いた阻害曲線
Mn-SOD 活性の 求め方
Cu,Zn-SOD とextracellular-SOD の活性を阻害するシアン化カリウム( KCN; 終濃度 1 mmol/l) あるいはDiethyldithiocarbamate(DDC; 終濃度 1 mmol/l) をサンプルに添加し、Mn-SOD の活性を求める。
妨害物質
表2. の試薬は測定に影響を与えます。サンプル中にこれらの試薬を含む場合は、表示の濃度値以下になるようサンプルを希釈してください。
- 還元物質である2-Mercaptoethanol、Dithiothreitol については大きな正誤差を与えるため、使用しないで下さい。
- サンプルに界面活性剤および還元物質を含む場合は、表以下の濃度であっても、blank 2 を必ず測定して下さい。
| 界面活性剤 | 溶媒 | 還元物質 | その他 | ||||
| SDS | 0.05% | Ethanol | 25% | Glutathione reduced form | 1.25 mmol/l | EDTA | 2 mmol/l |
| Tween 20 | 0.5% | DMSO | 5% | Ascorbic acid | 0.1 mmol/l | BSA | 1 %(w/v) |
| NP-40 | 0.5% | ||||||
S311_500tests: SOD Assay Kit - WST (500 tests)
Revised Aug., 30, 2023


 を押して省略できます。
を押して省略できます。