はじめに
タンパク質のチオール基修飾は、代表的な翻訳後修飾の一つであり、生体内のレドックス変化に応答して生じます。チオール基の翻訳後修飾によるタンパク質の機能制御を理解するためには、個々のチオール基の酸化還元状態を検出することが必要不可欠です。
-SulfoBiotics- Protein Redox State Monitoring Kit Plusを用いて、タンパク質のチオール基の数を電気泳動法により可視化することが可能です。マレイミド基を有する Protein-SHifter Plusはタンパク質のチオール基と結合し、1分子のProtein-SHifter Plusが結合することで、ラベル化されたタンパク質は分子質量約15 kDa増加したバンドとして分離・検出されます。更に、Protein-SHifter Plusは光分解機能を有するため、電気泳動後のゲルにUV光を照射することで、ラベル化されたタンパク質から切り離されます。そのため、ラベル化する前と同様にウェスタンブロットに適用できます。
- ラベル化の操作は動物細胞用に最適化されています。
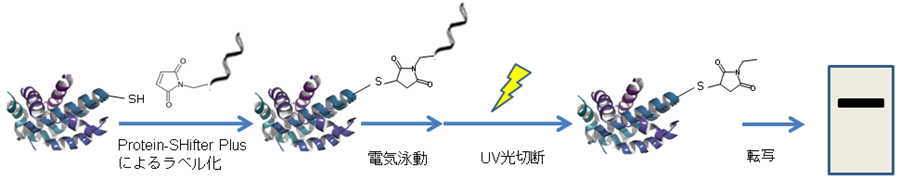
図1 Protein-SHifter Plusによるチオールの修飾および分離・転写イメージ
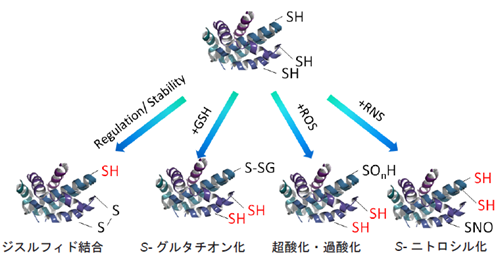
図2 タンパク質のSHのレドックス変化
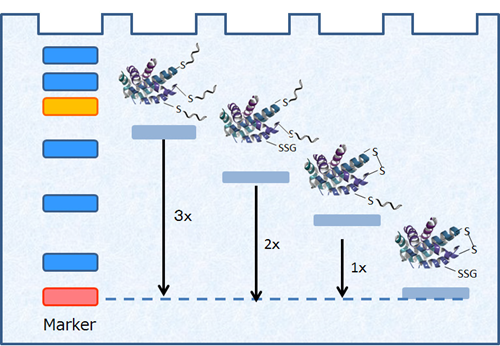
図3 電気泳動によるタンパク質SH基数の可視化
タンパク質のSH基にProtein-SHifter Plusが結合すると、タンパク質SH基あたり泳動度が分子質量約15 kDa増加します。
キット内容
| 20 samples | |
| Lysis Buffer | x 20 |
| Protein-SHifter Plus | x 4 |
| Reaction Buffer A | x 4 |
| Reaction Buffer B | x 4 |
保存条件
0 - 5 °Cにて保存してください。
必要なもの (キット以外)
- マイクロピペット(10 μlμl、100-200 μl)
- マイクロチューブ(1.5 ml)
- 10 (w/v) % TCA (トリクロロ酢酸) 水溶液
- 電気泳動関連試薬類[ゲル、Loading Buffer、タンパク質染色試薬(CBB:Coomassie Brilliant Blueなど)]
- ウエスタンブロット関連試薬類[転写装置、PVDF膜、光切断装置(トランスイルミネーター)など]
- PBS 、遠心装置(サンプル調製用)
- 70 (v/v) % EtOH水溶液
- アセトン
- インキュベーター(37 °C)
使用上のご注意
- 輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合がありますので、遠心してからご使用ください。
- Reaction Buffer BReaction Bは内容物が析出している場合があります。その際は、40-5040-50℃で加温溶解して使用してください。
- ラベル化の操作は動物細胞用に最適化されています。
使用方法
サンプル調製方法 (付着細胞用)
- 細胞数として5 - 10 x105 cells/well (6-well プレート) を用意する。
- サンプルのタンパク質濃度は0.1 - 1 mg/ml、またはチオール濃度として100 μmol/l 以下を推奨します。推奨範囲を超える場合には十分なラベル化ができない可能性があります。
- DTNBを用いたチオール濃度の定量方法は、ホームページ(SB12のQ&A[使用するサンプルの濃度])をご参照ください。
- 培地を吸引除去し、冷却した PBS 500 μl/well で 2 回洗浄する。
- 冷却した 10 % TCA 水溶液 を 500 μl/well 加え、プレートを氷浴上で 30 分間静置する。
- 本操作により、タンパク質チオール基の酸化防止および小分子チオール化合物(グルタチオンなど)の除去を行います。
- スクレーパーで細胞を剥がし、チューブに回収する。
- 1,000 x g、3 分間遠心し、上清を除去する。
- 冷却したアセトン 500 μl/tube を加え、再度 1,000 x g、3 分間遠心し、上清を除去する。(2 回行う。)
- 冷却した 70% EtOH 水溶液を 500 μl/tube 加え、再度 1,000 x g、3 分間遠心し、上清を除去する。
- Lysis Buffer 100 μl/tube を加え、超音波により細胞ペレットを溶解する。
- 細胞溶解に用いるLysis Bufferは実験系に応じてプロテアーゼインヒビターを加えてください。
- 溶解後のサンプルはすぐにProtein-SHifter Plusによるラベル化反応に使用してください。
サンプル調製方法 (浮遊細胞用)
- 細胞数として5 - 10 x 105 cells/tube を用意する。
- サンプルのタンパク質濃度は0.1 - 1 mg/ml、またはチオール濃度として100 μmol/l 以下を推奨します。推奨範囲を超える場合には十分なラベル化ができない可能性があります。
- DTNBを用いたチオール濃度の定量方法は、ホームページ(SB12のQ&A[使用するサンプルの濃度])をご参照ください。
- 1,000 x g、3分間遠心し、上清を除去する。
- 冷却した500 μl PBSを加え、ピペッティングで撹拌後1,000 x g、3 分間遠心し、上清を除去する。
- 冷却した10% TCA水溶液 を500 μl 加え、ピペッティングで撹拌後、チューブを氷浴上で30分間静置する。
- 本操作により、タンパク質チオール基の酸化防止および小分子チオール化合物(グルタチオンなど)の除去を行います。
- 1,000 x g 、3分間遠心し、上清を除去する。
- 冷却したアセトン500 μlを加え、再度1,000 x g、3分間遠心し、上清を除去する。(2回行う)
- 冷却した70 % EtOH水溶液を500 μl/tube加え、再度1,000 x g、3分間遠心し、上清を除去する。
- Lysis Buffer 100 μl/tube を加え、超音波により細胞ペレットを溶解する。。
- 細胞溶解に用いるLysis Bufferは実験系に応じてプロテアーゼインヒビターを加えてください。
- 溶解後のサンプルはすぐにProtein-SHifter Plusによるラベル化反応に使用してください。
ラベル化及び解析方法
- Protein-SHifter Plus に Reaction Buffer A を 4 μl 加え、ピペッティングでよく混合する。
- Protein-SHifter PlusをReaction Buffer A,Bで溶解すると、マレイミド基の分解が進みます。
溶解後はすぐにラベル化操作を行ってください。
- Protein-SHifter PlusをReaction Buffer A,Bで溶解すると、マレイミド基の分解が進みます。
- 上記で調製したサンプル 2 μl を加え、ピペッティングでよく混合する。
- Reaction Buffer B を 4 μl 加え、ピペッティングでよく混合する。
- Reaction Buffer Bを混合することで白濁することがあります。その場合、40-50°Cで加温溶解してください。
- 溶液が泡立った場合は、 7,000 × g, 1 - 2分間遠心にかけて消泡してください。
- 37°C、30 分間反応させる。
- ラベル化したサンプルはすぐに電気泳動実験にご使用ください。
- 操作4のサンプル溶液にLoading bufferを適量添加し、ゲル電気泳動に使用する。
- Loading bufferLoading bufferは本キットに含まれていません。(5x) Loading buffer(bufferを使用する場合には、サンプル溶液 10 μl に対し、 (5x) Loading buffer 2 μlを添加後、全量をゲルにアプライしてください。
- ゲルをトランスイルミネーターで10分間UV(302 nm)光を照射する。
- ゲルが乾燥しないように、ガラスに挟んだ状態で操作を行ってください。
- 操作6のゲルをPVDF膜に転写した後、抗体を用いて目的タンパク質を検出する。
実験例
HeLa 細胞中 GAPDH (Glyceraldehyde 3-phosphate dehydrogenase) の酸化剤に対する応答
- HeLa 細胞を6-well プレートに5 x 105 cell/well播種し、37°C、5% CO2インキュベーターで一晩培養した。
- 培地を吸引除去し、PBS(37 °C)500 μl/wellを加え洗浄し、吸引除去した。
- 1 mmol/l Diamide [1,1'-Azobis(N,N-dimethylformamide)] または H2O2 を 500 μl/well 添加し、37°Cで 10 分間静置した。
- 溶液を吸引除去し、冷却した 10% TCA 水溶液を 500 μl/well 加え、プレートを氷浴上で 30 分間静置した。
- スクレーパーで細胞を剥がし、1.5 ml マイクロチューブに回収した。
- 1,000 x g、 3 分間遠心し、上清を除去した。
- 冷却したアセトンを 500 μl/tube 加え、 1,000 x g、3 分間遠心し、上清を除去した。
- 操作7をもう一度繰り返した。
- 冷却した 70 %EtOH 水溶液を 500 μl/tube 加え、再度 1,000 x g、3 分間遠心し、上清を除去した。
- Lysis Buffer (1% プロテアーゼインヒビター含 ) 100 μl を加え、超音波により細胞ペレットを溶解した。
- Protein-SHifter Plus に Reaction Buffer A を 4 μl 加え、ピペッティングでよく混合した。
- 操作10 の溶液 2 μl を操作11の溶液に加え、ピペッティングでよく混合した。
- Reaction Buffer B 4 μl を操作12の溶液に加え、ピペッティングでよく混合した。
- 37 °C、30 分間反応させた。
- Loading Buffer (10 (w/v) % sodium dodecyl sulfate (SDS) , 50 (v/v) % glycerol, 0.2 mol/l Tris-HCl (pH 6.8), 0.05 (w/v) % bromophenol blue) 2 μl を操作14の溶液に加え、ピペッティングでよく混合した。
- 操作15の溶液をSDS-ポリアクリルアミドゲル(15%)電気泳動に使用した。
- 電気泳動後のゲルをトランスイルミネーターで 10 分間UV (302 nm) 照射した。
- ゲル中のタンパク質をPVDF 膜に転写した。
- PVDF膜に転写されたGAPDHを抗GAPDH抗体を用いて検出した。
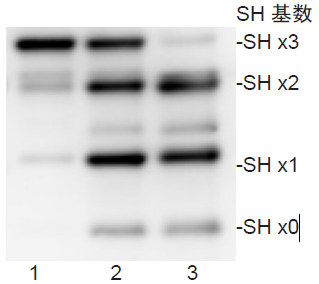
- 1. 未処理,ラベル化
2. Diamide 酸化, ラベル化
3. H2O2 酸化, ラベル化
一次抗体: ウサギ 抗GAPDH抗体
二次抗体: ペルオキシダーゼ標識ヤギ 抗ウサギ抗体
検出方法: 化学発光法
図4 HeLa 細胞中のGAPDHタンパク質のSH状態の可視化
参考文献
- Satoshi Hara, Tatsuya Nojima, Kohji Seio, Masasuke Yoshida, Toru Hisabori, "DNA-maleimide: An improved maleimide compound for electrophoresis-based titration of reactive thiols in a specific protein" Biochim. Biophys. Acta, 2013, 1830(4) 3077.
- Satoshi Hara, Yuki Tatenaka, Yuya Ohuchi, Toru Hisabori, "Direct determination of the redox status of cysteine residues in proteins in vivo", Biochem. Biophys. Res. Commun., 2015, 456(1) 339.
よくある質問/参考文献
SB12: -SulfoBiotics- Protein Redox State Monitoring Kit Plus
Revised Apr., 05, 2024


 を押して省略できます。
を押して省略できます。