はじめに
タンパク質のチオール基修飾は、代表的な翻訳後修飾の一つであり、生体内のレドックス変化に応答して生じ ます。チオール基の翻訳後修飾によるタンパク質の機能制御を理解するためには、個々のチオール基の酸化還元 状態を検出することが必要不可欠です。
-SulfoBiotics- PEG-PCMal は、タンパク質中のチオール基の数を電気泳動を用いたゲルシフトアッセイ法によっ て可視化するための試薬です。マレイミド基を有する PEG-PCMal はタンパク質のチオール基と結合し、1 分子 の PEG-PCMal が結合することで、ラベル化されたタンパク質は約 5kDa 増加したバンドとして分離・検出され ます。一般的に、PEG-Maleimide がゲルシフトアッセイ法に用いられていますが、ウエスタンブロット解析の際に、 タンパク質にラベル化された PEG 鎖が原因でメンブレンへの転写効率や抗体認識能の低下を引き起こすことが 知られています。本試薬は、光切断可能な PC(photo cleavable)リンカーを有するため、電気泳動後のゲルに UV 光を照射することで、ラベル化されたタンパク質から PEG 鎖を切り離すことができます。そのため、PEG 鎖の影響を受けることなく、目的タンパク質をウエスタンブロットで検出することが可能です。
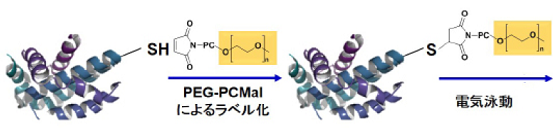
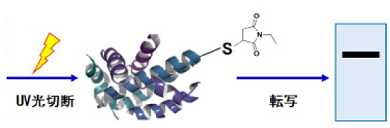
図 1 PEG-PCMal によるチオールの修飾および分離・転写イメージ
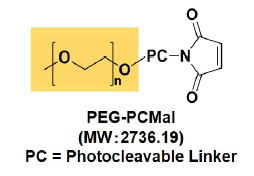
図 2 PEG-PCMal の構造
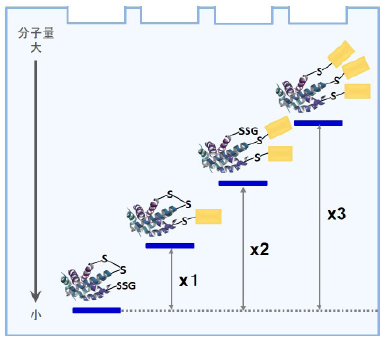
図 3 電気泳動によるタンパク SH 基数の可視化
内容
| -SulfoBiotics- PEG-PCMal | 1 mg/tube |
保存条件
遮光、冷蔵(0-5 ℃)にて保存してください。
必要なもの
- インキュベーター(37 ℃)
- マイクロピペット(20 µl、200 µl、1000 µl)
- 遠心装置(サンプル調製用)
- 1.5 ml マイクロチューブ
- 電気泳動関連試薬類[ゲル、Loading Buffer、タンパク質染色試薬(CBB:Coomassie Brilliant Blue など)]
- ウェスタンブロット関連試薬類[転写装置、PVDF 膜、光切断装置(トランスイルミネーター)など]
使用方法
実験系に応じて適当なバッファーや水、DMSO などに溶解し、ご使用下さい。
- 10 mmol/l PEG-PCMal DMSO 溶液調製後、遮光し、-20 ℃で保存した場合、1 ヶ月間安定です。10 mmol/l PEG-PCMal 水溶 液の場合、-20 ℃で 2 週間安定です。
実験方法
-


操作 1
タンパク質を含むサンプル溶液にPEG-PCMal 溶液を 添加1)操作 2
37℃でインキュベート2)
(ラベル化)操作 3
ゲル電気泳動3)
-


操作 4
電気泳動後のゲル(ガラスプレート付)にUV 照射(トランスイルミネーター)4)操作 5
メンブレンに転写後、抗体を用いてタンパク質を検出
※注意事項
- 終濃度が 1 ~ 5 mmol/l となるように PEG-PCMal 溶液を添加してください。
- 37℃で 30 分間あるいは室温で 1 時間以上インキュベートしてください。ラベル化したサンプルはすぐに電気泳動に使用してください。
- CBB などのゲル内染色によってタンパク質を検出する場合は、操作 4 に進まずゲル内染色の操作に移ってください。
- ガラス板に挟んだ状態でトランスイルミネーター上の光源(302 nm, 15W) に載せ、10 分間光照射してください。
弊社で光切断実績のある機器は以下の 2 種です。光切断操作には同等の装置をご使用ください。
・トランスイルミネーター (メーカー:UVP、型番:NTM-15、切断条件:302 nm 15W で 10 分)
・ハンディ UV ランプ(メーカー:アズワン、型番:SLUV-4、切断条件:365 nm 4W で 30 分)
254 nm 光照射(ハンディ UV ランプまたはクリーンベンチの殺菌灯など)では十分な光切断ができません。
実験例
HeLa 細胞中 TRX(Thioredoxin)のレドックス状態の解析
-
- HeLa 細胞を 96-well プレートに 1×105 cell/well 播種し、37 ℃、5% CO2 イン キュベーターで一晩培養した。
- 培地を吸引除去し、PBS(37℃) 500 μl/well を加え洗浄し、吸引除去した。
- PEG-PCMal 1 mg を含むチューブに Lysis buffer 360 μl を加え、ピペッティ ングにより溶解した(1 mmol/l PEG-PCMal)。
- 1 mmol/l PEG-PCMal 溶液 10 μl を操作2の well に加え、ピペッティングで よく混合し、細胞を溶解した。
- 操作 4 の溶液 10 μl を 1.5 ml マイクロチューブに入れ、37 ℃で 30 分間静置 した。
- 操作 5 のサンプル溶液に Loading buffer 2 μl を加え、よく混合した。
- 操作 6 の溶液を SDS- ポリアクリルアミドゲル(15%)電気泳動に使用した。
- 電気泳動後のゲルをトランスイルミネーターで 10 分間 UV(302 nm)照射し た。
- ゲル中のタンパク質を PVDF 膜に転写し、抗体を用いて TRX を検出した。
-
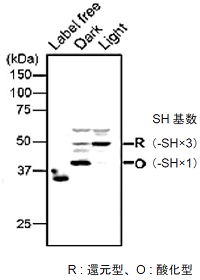
図4 HeLa細胞中TRXのレドックス状態の可視化
シロイヌナズナの葉に含まれる光応答性タンパク質(ATP 合成酵素 γ サブユニット)のレドックス状態の解析
-
- シロイヌナズナの葉を凍結粉砕するために、乳鉢と乳棒を液体窒素であらかじめ冷却した。
- 切り離したシロイヌナズナの葉 1 枚(約 50 mg)を、暗所もしくは光環境下に 5 分おき、その環境下で液体窒素で凍結させ、乳鉢にて粉砕した。
- 粉砕した葉 ( 各サンプル ) に、4 mmol/l PEG-PCMal 溶液 180 µl を加え(瞬時 に凍る)、乳鉢でさらに粉砕した。
- 4 mmol/l PEG-PCMal 溶液は、PEG-PCMal(1 mg/tube)2 本に、SDS sample buffer[62.5 mmol/l Tris-HCl(pH7.5), 2% SDS, 7.5% glycerol, 0.01% bromophenol blue](90 µl/tube) を 加えて調製した。
- 1.5 ml マイクロチューブに粉砕物を回収し、遮光下、室温で 1 時間静置した。
- 95 ℃で 5 分間ボイルした後、15,000 rpm で 10 分間遠心した。
- 上清をタンパク質サンプルとし、電気泳動に使用した。
- 電気泳動後のゲルをトランスイルミネーターで 10 分間 UV(302 nm)照射した。
- ゲル中のタンパク質を PVDF 膜に転写し、抗体を用いて ATP 合成酵素 γ サブ ユニットを検出した。
-

図5 シロイヌナズナ中のATP 合成酵素γサブユニットのレドックス状態の可視化
技術指導
東京工業大学 科学技術創成研究院 化学生命科学研究所 久堀 徹教授
東京工業大学 科学技術創成研究院 化学生命科学研究所 吉田 啓亮助教
東京工業大学 生命理工学院 原 怜助教
よくある質問/参考文献
SB20: -SulfoBiotics- PEG-PCMal
Revised Aug., 22, 2023


 を押して省略できます。
を押して省略できます。

