はじめに
近年、硫化水素 (H2S)が血管拡張や細胞保護、インスリン分泌や神経伝達調節など様々な生理活性を示すことが明らかにされ、一酸化窒素 (NO) や一酸化炭素 (CO) に続く重要なシグナル分子として注目されています。硫化水素は、NOやCOと同様にガス状分子として認知されていますが、そのpKaは約7であり生理的pHでは約80%が硫化水素イオン (HS-)の状態で存在します。また、硫化水素イオンは、生体内で様々な結合形態や構造をとるため、その作用機序の詳細に関しては未だ不明であり、硫化水素を中心とした硫黄の生体内機能の解明が待ち望まれています。
-SulfoBiotics- HSip-1 DAは、細胞膜透過型で細胞イメージング用として細胞内硫化水素を蛍光モニターできます。
-
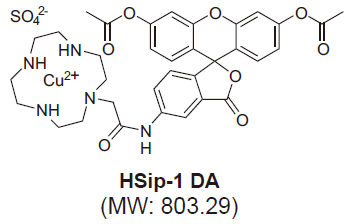
図1 HSip-1 DAの構造
-
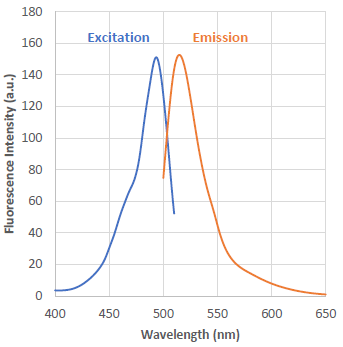 λex : 491 nm
λex : 491 nm
λem : 516 nm
<推奨フィルター>
励起:470 ~ 500 nm
蛍光:500 ~ 550 nm図2 硫化水素と反応後のHSip-1の励起・蛍光スペクトル
内容
| 50 μg x 1 |
保存条件
-20℃にて保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- 無血清培地
- HBSS
- マイクロピペット
溶液調製
1 mmol/l HSip-1 DA stock solutionの調製
HSip-1 DA 50 μgを含むチューブにDMSO 62 μlを添加し、ピペッティングにより溶解する。
- 溶解後は、-20 ℃以下で保存してください。調製後は1か月間安定です。
実験例
HSip-1 DAを用いた細胞内硫化水素蛍光イメージング
- μ-slide 8 well (Ibidi) にHeLa 細胞を播種し37oC、CO2 インキュベーターにて一晩培養した。
- 上清を除去した後、無血清培地 (MEM)で細胞を2回洗浄した。
- 調製した1 mmol/l HSip-1 DA stock solutionを無血清培地 (MEM)で希釈し、5 μmol/l HSip-1 DA working solutionを調製した。
- 細胞種により最適濃度が異なります。最適条件をご検討ください。
- 5 μmol/l HSip-1 DA working solution 200 μlをウェルに添加し、CO2インキュベーター(37oC)内で30分間静置した。
- 上清を除去した後、HBSSで細胞を2回洗浄した。
- 200 μmol/l 硫化ナトリウム(-SulfoBiotics- Sodium Sulfide(Na2S))を含むHBSS 200 μlを各ウェルに添加し、CO2インキュベーター(37oC)内で20分間静置した。
- 上清を除去した後、HBSSで細胞を2回洗浄した。
- HBSS 200 μlをウェルに添加した後、共焦点顕微鏡を用いて細胞を観察した。
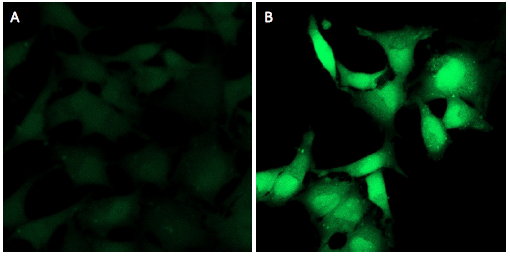
図3 Na2S処理したHeLa細胞のHSip-1 DAによる硫化水素の検出
(A: 未処理、B: 200 μmol/l Na2S処理)
本製品は、東京大学大学院 薬学系研究科 長野哲雄先生、花岡健二郎先生のご指導の下、製品化しました。
参考文献
- K. Sasakura, K. Hanaoka, N. Shibuya, Y. Mikami, Y. Kimura, T. Komatsu, T. Ueno, T. Terai, H. Kimura, and T. Nagano, “Development of a Highly Selective Fluorescence Probe for Hydrogen Sulfide”, J. Am. Chem. Soc., 2011, 133, 18003.
よくある質問/参考文献
SB22: -SulfoBiotics- HSip-1 DA
Revised Aug., 10, 2023


 を押して省略できます。
を押して省略できます。