はじめに
細胞はさまざまな栄養素を取り込み、細胞内代謝を介してエネルギーを産生しています。このような栄養代謝は細胞外環境や細胞の状態、細胞の種類などによって異なっており、近年このような栄養代謝が単なるエネルギー産生だけでなく、遺伝子発現を含むさまざまな細胞機能制御にも関与していることが明らかとなっています。
グルコースは、主要な栄養素の一つであり、グルコースの取り込みや代謝を理解することは細胞機能を解明する上で非常に重要となります。細胞のグルコース取り込み能力を評価する方法として、放射性同位体標識グルコースを用いた方法が古くから用いられています。しかし、放射性化合物であるため、操作が煩雑であり汎用性に欠けます。また2-Deoxy-D-glucose (2-DG) を用いた酵素サイクリング法は比色あるいは蛍光によるプレートアッセイが可能ですが、細胞のイメージングやフローサイトメトリーには適用できません。そのため最近では蛍光標識グルコース誘導体 2-NBDG を用いた方法が広く利用されています1) 。しかしながら、2-NBDG は蛍光強度が弱く感度が低いという課題があります。また、細胞内に取り込まれた2-NBDG が細胞外に漏出しやすいことも課題として挙げられます。
新たに開発した蛍光標識グルコース誘導体 Glucose Uptake Probe は、2-NBDG に比べて高感度に細胞のグルコース取り込み能力を測定することができます。さらに、本キットに含まれるWashing and Imaging (WI) Solution を用いることで細胞からのプローブの漏出を抑制し、再現性の高いデータを取得することが可能です。
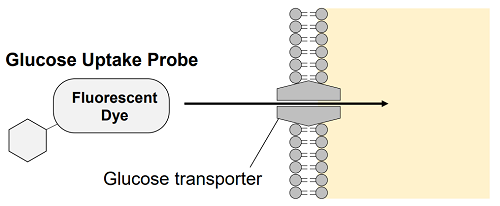
図1 Glucose Uptake Assay Kit の測定原理
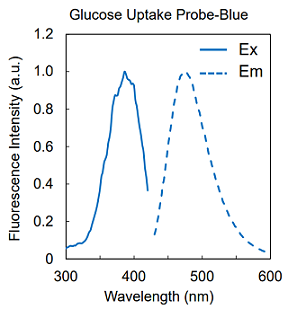
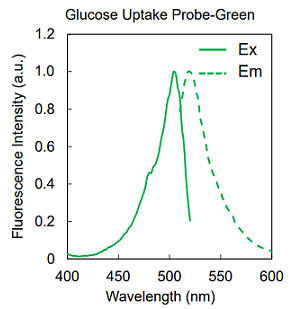
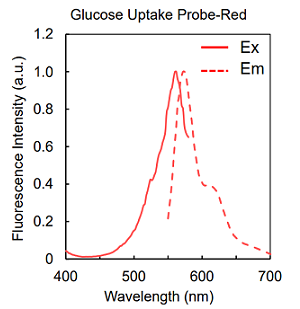
図2 Glucose Uptake Probe の蛍光特性
キット内容
| UP01 | Glucose Uptake Probe-Blue | ×1 |
| WI Solution (50x) | 5 ml ×1 | |
| UP02 | Glucose Uptake Probe-Green | ×1 |
| WI Solution (50x) | 5 ml ×1 | |
| UP03 | Glucose Uptake Probe-Red | ×1 |
| WI Solution (50x) | 5 ml ×1 |
保存条件
0 - 5 ℃で保存してください。
必要なもの (キット以外)
- マイクロピペット
- Dimethylsulfoxide (DMSO)
- HBSS (Hanks' Balanced Salt Solution)
- グルコース不含無血清培地
- 1.5 mlマイクロチューブ
使用上の注意
輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合がありますので、遠心してからご使用ください。
Glucose Uptake Assay Kit-Blueは、プレートリーダーによる測定はできません。
溶液調製
1. Probe stock solutionの調製
Glucose Uptake ProbeにDMSO 40 μlを加え、ボルテックス及びピペッティングで溶解する。
- 調製後は、遮光下-20℃で保存してください。調製後は1ヶ月間安定です。
2. Probe solutionの調製
Probe stock solutionをグルコース不含無血清培地で500倍※希釈する。
- 細胞種によってProbe solutionの最適濃度が異なります。製品HPに記載している使用実績のある細胞種を参照して、最適濃度をご検討ください。(希釈域:250 - 1000 倍)
| 付着細胞 | 浮遊細胞 | ||||
|
培養器材 |
6-well (1.5 ml/well) |
24-well (0.3 ml/well) |
96-well |
35 mm-dish (1.5 ml/well) |
1.5 mlmicrotube |
| 培地量 | 1500 μl | 300 μl | 150 μl | 1500 μl | 500 μl |
| Probe stock solution | 3 μl | 0.6 μl | 0.3 μl | 3 μl | 1 μl |
3. WI Solution (1x) の調製
WI Solution (50x)をHBSSで50倍希釈する。
| 付着細胞 | 浮遊細胞 | ||||
|
培養器材 |
6-well (1.5 ml/well) |
24-well (0.3 ml/well) |
96-well |
35 mm-dish (1.5 ml/well) |
1.5 mlmicrotube |
| HBSS | 6000 μl | 1200 μl | 600 μl | 6000 μl | 2000 μl |
| WI Solution (50x) | 120 μl | 24 μl | 12 μl | 120 μl | 40 μl |
- 上記は細胞の洗浄(3回)およびイメージングに使用する量を想定しています。
予備実験
測定条件の最適化
グルコース取り込み能力は細胞の種類によって異なるため、測定条件の最適化をお勧めします。
「本製品を初めて使用する」または「細胞種を変更する」場合、以下に示した一般的な方法をご参考ください。
・グルコース取り込みの競合阻害(実験例1参照)※1
・トランスポーターの阻害(実験例2参照)※2
- 細胞種によっては、グルコーストランスポーターの発現量や種類の違いによりグルコースでの競合阻害ができない場合があります。本製品ウェブページのよくある質問 [グルコースでの競合阻害ができない場合の対処法はありますか?]をご参照ください。
- トランスポーター阻害剤の実績は本製品ウェブページのよくある質問をご参照ください。
操作
- 細胞をディッシュまたはマイクロプレートに播種し、5% CO2インキュベーター(37℃)内で一晩培養する。
- 培地を除去した後、加温したグルコース不含無血清培地※1にて2回洗浄する。
- 加温したグルコース不含無血清培地※1を添加し、5% CO2インキュベーター(37℃)内で15分間静置する。
- 上清を除去した後、加温したProbe solution※1 を添加し、5% CO2インキュベーター(37℃)内で15分間※2静置する。
- 上清を除去した後、冷却したWI Solution (1x) で2回洗浄する。
- 上清を除去した後、冷却したWI Solution (1x) を添加し、室温で5分間静置する。※3
- 上清を除去した後、冷却したWI Solution (1x) を添加する。
- 蛍光顕微鏡で観察する。※4, ※5
- 培地やProbe solutionの温度が細胞のグルコース取り込み能力に影響を与える場合があります。あらかじめインキュベーター(37℃)内で加温してください。
- 細胞種によって最適な染色時間が異なります。製品HPに記載している使用実績のある細胞種を参照して、最適時間をご検討ください。
(時間:15分 - 1時間程度) - 十分な洗浄を行うために必要な操作です。洗浄が不足するとバックグラウンドが上昇する恐れがあります。
- フローサイトメーターで付着細胞を使用する場合には、Trypsin処理やセルスクレーパーなどで細胞を剥離してください。
- バックグラウンドが高い場合は、操作6 - 7を繰り返してください。
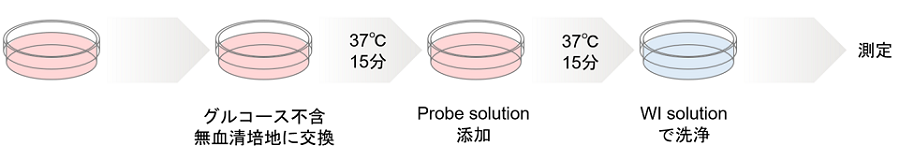
図3 キットの操作手順
実験例1
D-グルコース競合によるGlucose Uptake Probeの取り込み阻害(A549細胞)
1-1. 蛍光顕微鏡観察およびプレートリーダー測定
- MEM培地 (10% FBS) で調製したA549細胞 (1.0 × 105 cells/ml, 150 μl)を96-well マイクロプレート (ib89626 : ibidi社) に播種し、5% CO2インキュベーター(37℃)内で一晩培養した。
- 上清を除去した後、DMEM (glucose-free、serum-free、37℃) 150 μlで2回洗浄した。
- DMEM (glucose-free、serum-free、37℃) 150 μlを各ウェルに添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、DMEM (glucose-free、serum-free、37℃) またはDMEM (high-glucose、serum-free、37℃) を用いて調製したProbe solution 150 μlを添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、WI Solution(1x、4℃) 150 μlで3回洗浄した。
- 蛍光顕微鏡 (機種 : KEYENCE社BZ-X700) 観察およびプレートリーダー(機種 :TECAN社 Infinite m200 PRO、ボトムリーディング)測定を行った。
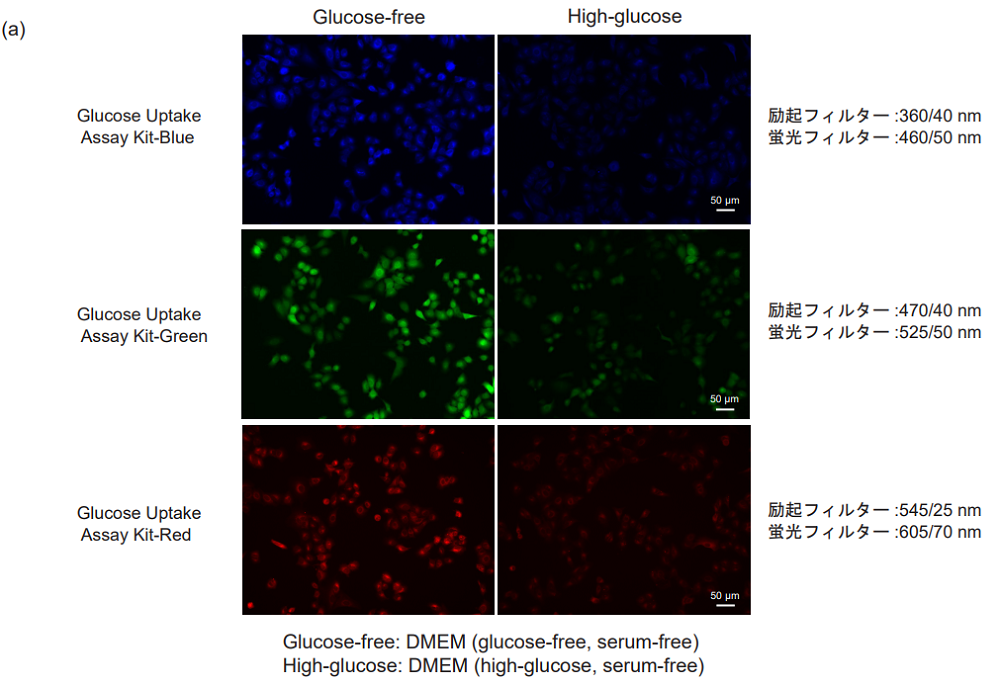
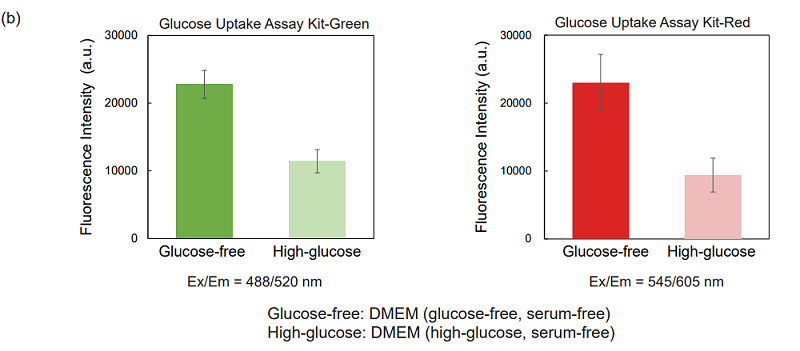
図4 グルコース競合によるA549細胞のGlucose Uptake Probeの取り込み阻害
(a)蛍光イメージング、 (b) プレートリーダー測定
1-2. フローサイトメーター測定
- MEM培地 (10% FBS)で調製したA549細胞 (1.33 × 105 cells/ml, 1.5 ml) を6-well マイクロプレート (3810-006 : AGCテクノグラス社) に播種し、5% CO2インキュベーター(37℃)内で一晩培養した。
- 上清を除去した後、DMEM (glucose-free、serum-free、37℃) 1.5 mlで2回洗浄した。
- DMEM (glucose-free、serum-free、37℃) 1.5 mlを添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、DMEM (glucose-free、serum-free、37℃)またはDMEM (high-glucose、serum-free、37℃) を用いて調製したProbe solution 1.5 mlを添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、WI Solution(1x、4℃) 1.5 mlで3回洗浄した。
- WI Solution(1x、4℃) 1.5 mlを添加し、セルスクレーパーで細胞を剥離した。
- 細胞は測定まで氷浴で保存した。
- フローサイトメーター (機種 :Becton Dickinson社 LSR-Fortessa X-20) で測定した。
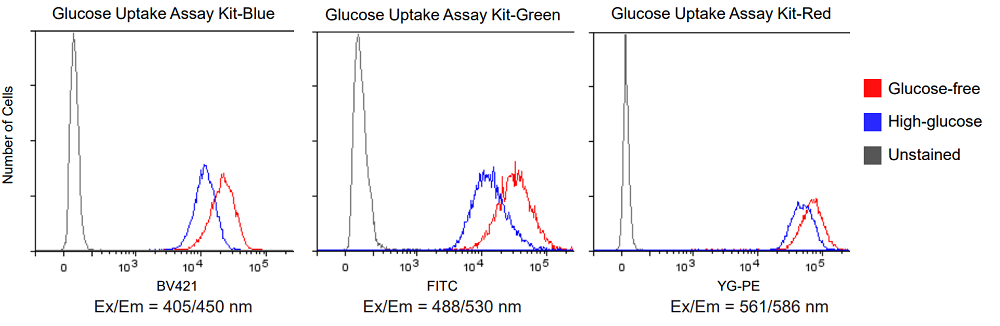
Glucose-free: DMEM (glucose-free, serum-free)
High-glucose: DMEM (high-glucose, serum-free)
図5 グルコース競合によるA549細胞のGlucose Uptake Probeの取り込み阻害(フローサイトメーター測定)
実験例2
Cytochalasin BによるGlucose Uptake Probe取り込み阻害(HepG2細胞)
- MEM培地 (10% FBS) で調製したHepG2細胞 (3.0 × 105 cells/ml, 150 μl) を96-well マイクロプレート (ib89626 : ibidi社) に播種し、5% CO2インキュベーター(37℃)内で一晩培養した。
- 上清を除去した後、0 μmol/lまたは5 μmol/l Cytochalasin Bを含むMEM (10% FBS、37℃) 150 μlを添加し、5% CO2インキュベーター(37℃)内で一晩培養した。
- 上清を除去した後、DMEM (glucose-free、serum-free、37℃) 150 μlで2回洗浄した。
- DMEM (glucose-free、serum-free、37℃) 150 μlを各ウェルに添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、DMEM (glucose-free、serum-free、37℃)を用いて調製したProbe solution 150 μlを添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、WI Solution(1x、4℃) 150 μlで3回洗浄した。
- 蛍光顕微鏡 (機種 : KEYENCE社BZ-X700) 観察およびプレートリーダー(機種 :TECAN社 Infinite m200 PRO、トップリーディング)測定を行った。
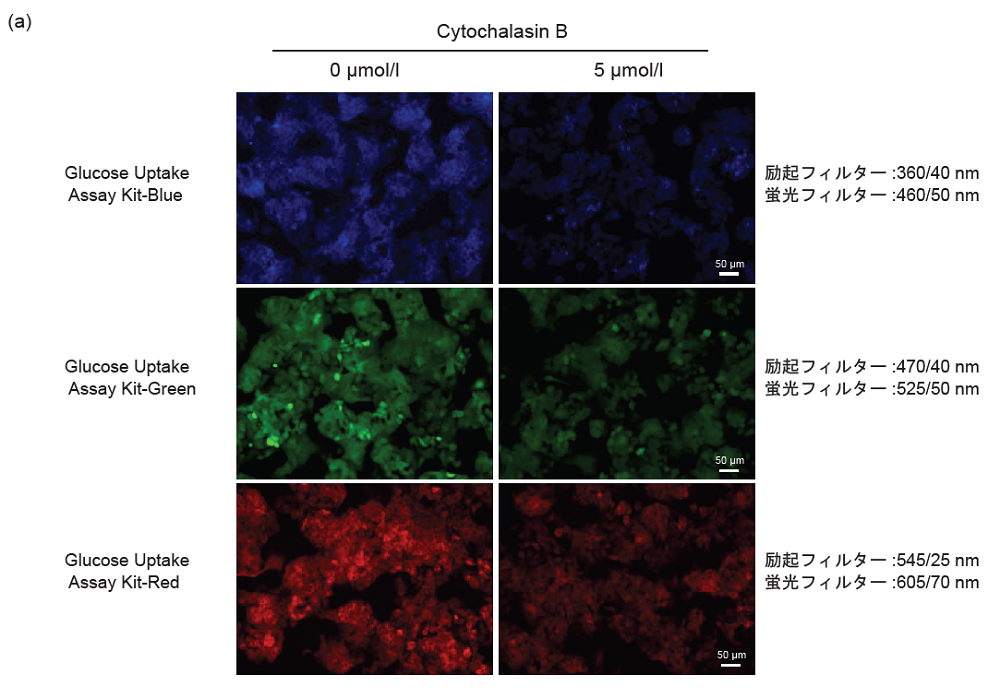
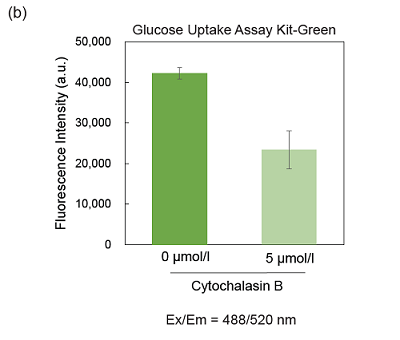
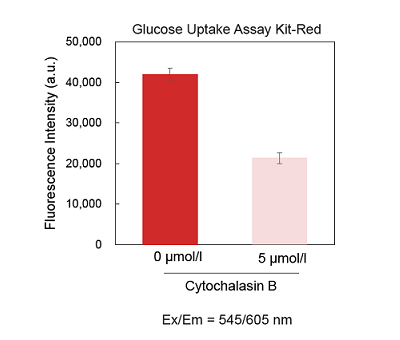
図6 Cytochalasin BによるHepG2細胞のGlucose Uptake Probeの取り込み阻害
(a)蛍光イメージング、 (b) プレートリーダー測定
実験例3
脂肪細胞への分化誘導によるGlucose Uptake Probe取り込みの増加の確認
-脂肪細胞への分化-
- DMEM (5.5 mmol/l glucose、10% FBS)で調製した3T3-L1細胞 (1.0 × 105 cells/ml, 150 μl) を96-well マイクロプレート (ib89626 : ibidi社) へ播種し、5% CO2インキュベーター(37℃)内で培養した。
- 培養はコンフルエントに達するまで継続し、2日に1回培地交換を行った。
- 下記の操作3及び4を行わず得られた細胞を前駆脂肪細胞とした。
- 1 μmol/l dexamethasone、0.5 mmol/l 3-isobutyl-1-methylxanthineを含むDMEM (5.5 mmol/l glucose、10% FBS) 150 μlに交換し2日間5% CO2インキュベーター(37℃)内で培養した。
- 上清を除去した後、1.72 μmol/l insulinを含むDMEM (5.5 mmol/l glucose、10% FBS) 150 μlを加え2日間5% CO2インキュベーター(37℃)内で培養した。
- 上清を除去した後、DMEM (5.5 mmol/l glucose、10% FBS) 150 μlを加えて6日間5% CO2インキュベーター(37℃)内で培養し、2日に1回培地交換を行った。作製した前駆脂肪細胞と脂肪細胞をグルコース取り込み実験に使用した。
-前駆脂肪細胞と脂肪細胞のGlucose Uptake Probe取り込み能の比較-
- 上記で準備したマイクロプレートの各ウェルの上清を除去した後、DMEM (glucose-free、serum-free、37℃) 150 μlで2回洗浄した。
- DMEM (glucose-free、serum-free、37℃) 150 μlを添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、DMEM (glucose-free、serum-free、37℃)を用いて調製したProbe solution 150 μlを添加し、5% CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、WI Solution(1x、4℃) 150 μlで3回洗浄した。
- 蛍光顕微鏡 (機種 : KEYENCE社BZ-X700) で観察した。
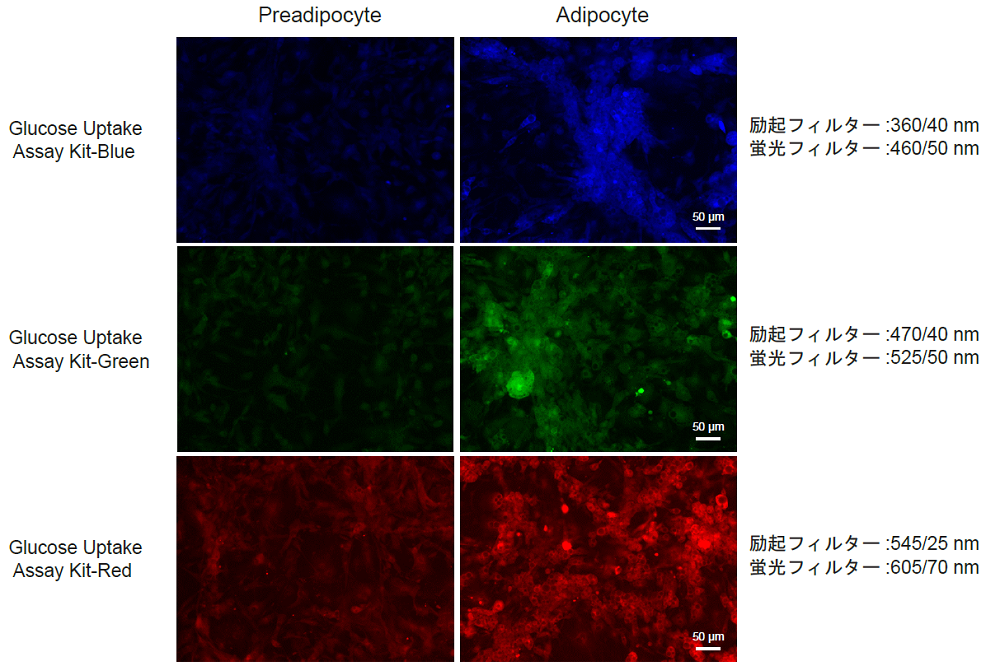
図7 分化誘導によるグルコース取り込み能力の促進
参考文献
- Yoshioka, K.; Takahashi, H.; Homma, T.; Saito, M.; Oh, B. K.; Nemoto, Y.; Matsuoka, H. "A novel fluorescent derivative of glucose applicable to the assessment of glucose uptake activity of Escherichia coli. Biochim" Biophys. Acta, 1996, 1289, 5-9.
よくある質問/参考文献
UP01_UP02_UP03: Glucose Uptake Assay Kit-Blue/Green/Red
Revised Oct., 23, 2023


 を押して省略できます。
を押して省略できます。







