はじめに
がん細胞は、細胞増殖と亢進した細胞内代謝を維持するために、糖、アミノ酸、脂肪酸などの栄養素を大量に取り込んでいます。そのため、栄養素の取り込みを担うトランスポーターはがんの診断や創薬ターゲットとして注目されており、アミノ酸トランスポーターの一つである L-type amino acid transporter 1 (LAT1) は、多くのがん細胞で特異的に発現しているトランスポーターとして近年盛んに研究されています。このアミノ酸トランスポーター活性を測定するため、古くから放射性同位体標識したアミノ酸を用いた取り込みアッセイ法が行われていますが、放射性同位体は厳しい管理により使用が制限されています。
Amino Acid Uptake Assay Kit は、蛍光法によってアミノ酸トランスポーターの活性を簡便に測定できるキットです。本キットに含まれているBPA(Boronophenylalanine) は、がんの治療法の一つであるホウ素中性子補足療法 (BNCT) に用いられるアミノ酸類似体であり、アミノ酸トランスポーターを介して細胞内に取り込まれることが知られています。細胞内に取り込まれた BPA に対し、キット付属の蛍光プローブを用いることで特異的な蛍光検出 (Ex: 360 nm, Em: 460 nm) が可能です。本キットは、蛍光イメージング、プレートリーダー測定、フローサイトメトリーに対応しているため、細胞のアミノ酸取り込み能力を可視化および数値化することが可能であり、アミノ酸取り込み能力の評価やアミノ酸トランスポーター阻害剤のスクリーニングに有用です。
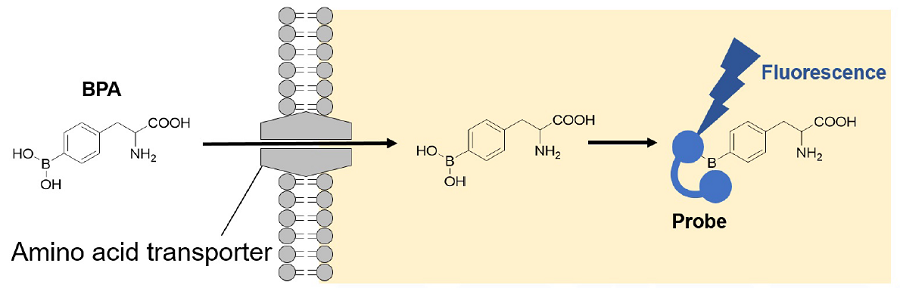
図1 アミノ酸取り込み能力の原理
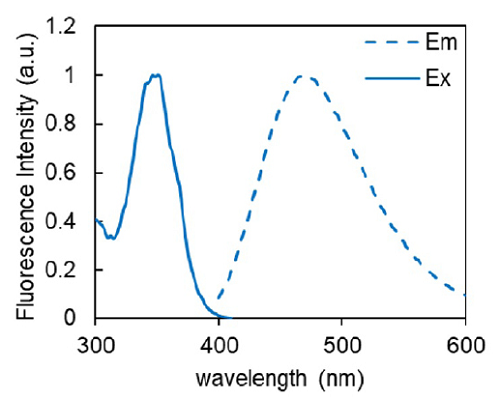
図2 Probe-BPA 複合体の蛍光特性
キット内容
| 20 tests | 100 tests | |
| BPA Solution | 35 μl x 1 | 175 μl x 1 |
| BPA Dilution Buffer | 35 μl x 1 | 175 μl x 1 |
| Probe Solution | 15 μl x 1 | 75 μl x 1 |
保存条件
遮光、-20℃にて保存してください。
必要なもの (キット以外)
- 蛍光測定用マイクロプレート
- 使用するマイクロプレートの種類によっては測定できない場合があります。
推奨のマイクロプレートの種類と、 結果への影響については FAQ をご参照ください。
- 20–200 μl のマルチチャンネルピペット
- 15 ml コニカルチューブ
- 1.5 ml マイクロチューブ
- Hanks’ Balanced Salt Solution (HBSS) または 0.1% glucose/ PBS(+)
使用上のご注意
・輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合がありますので、遠心してからご使用ください。
溶液調製
BPA uptake solutionの調製
BPA Solution を同量の BPA Dilution Buffer で希釈し、HBSS で 50 倍希釈する。
| 付着細胞 | 浮遊細胞 | ||||
| 培養機材 (添加量) |
6-well (1.5 ml/well) |
24-well (0.3 ml/well) |
96-well (0.15 ml/well) |
35-mm Dish (1.5 ml/well) |
1.5 ml microtube (0.5 ml/well) |
| HBSS | 1500 μl | 300 μl | 150 μl | 1500 μl | 500 μl |
| BPA Solution | 15 μl | 3 μl | 1.5 μl | 15 μl | 5 μl |
| BPA Dilution Buffer |
15 μl | 3 μl | 1.5 μl | 15 μl | 5 μl |
- 溶液調製に用いる HBSS は、0.1% glucose/PBS(+) で代用可能です。
- 調製後の BPA uptake solution は保存できません。その日のうちにお使い下さい。
working solutionの調製
Probe Solution を HBSS で 250 倍希釈し、ピペッティングもしくはボルテックスで混合する。
| 付着細胞 | 浮遊細胞 | ||||
| 培養機材 (添加量) |
6-well (1.5 ml/well) |
24-well (0.3 ml/well) |
96-well (0.15 ml/well) |
35-mm Dish (1.5 ml/well) |
1.5 ml microtube (0.5 ml/well) |
| HBSS | 1500 μl | 300 μl | 150 μl | 1500 μl | 500 μl |
| Probe Solution | 6 μl | 1.2 μl | 0.6 μl | 6 μl | 2 μl |
300 x g, 3 min遠心し、上清を新しいチューブに移す。
- Probe SolutionをHBSSで希釈した際に、わずかながら析出物が生成することがあります。析出物は細胞の蛍光観察やプレートリーダーに影響を及ぼしますので、溶液調製後に遠心し、上清をご使用ください。
- 調製後の working solution は保存できません。その日のうちにお使い下さい。
操作
蛍光イメージング、プレートリーダー測定
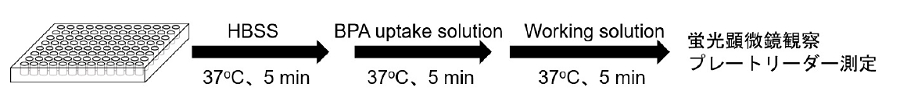
図3 イメージングおよびプレートリーダー測定の手順
- ウェル間の時間差を少なくするためにマルチチャンネルピペットをご使用下さい。
- 細胞のアミノ酸取り込み能力は温度に影響を受ける場合があります。HBSS、BPA uptake solutionおよびworkingsolutionは予めインキュベーター(37°C)内で加温してからご使用ください。
- 細胞を96 well マイクロプレートに播種し(1 x 104 cells/well)、5% CO2インキュベーター(37°C)内で一晩培養する。
- 上清を除去した後、加温したHBSS (37℃※1) 150 μlにて3回洗浄する。
- 加温したHBSS (37℃※1) 150 μlを添加し、5% CO2インキュベーター(37°C)内で5分間静置する。
- 上清を除去した後、加温したBPA uptake solution (37℃※1) あるいはHBSS (37℃※1, ブランク)150 μlを添加し、5% CO2インキュベーター(37°C)内で5分間静置する。
- 上清を除去した後、加温したHBSS (37℃※1) 150 μlで3回洗浄する。
- 上清を除去した後、加温したworking solution (37℃※1) 150 μlを添加し、5% CO2インキュベーター(37°C)内で5分間静置する。
- 蛍光顕微鏡で観察、またはプレートリーダーで測定する。
(イメージング:DAPIフィルター、プレートリーダー:360/460 nm)
working solution を除去すると蛍光シグナルが消失します。working solution を添加したまま観察および測定を行ってください。
フローサイトメーター測定
付着細胞の場合
- 細胞を6 well マイクロプレートに播種 (2 x 105 cells/well) し、5% CO2インキュベーター(37℃)内で一晩培養する。
- 上清を除去した後、加温したHBSS (37℃※1) 1,500 μl にて3回洗浄する。
- 加温したHBSS (37℃※1) 1,500 μlを添加し、5% CO2 インキュベーター(37°C)内で5分間静置する。
- 上清を除去した後、加温したBPA uptake solution (37℃※1) あるいはHBSS (37℃※1、ブランク) 1,500 μl を添加し、5% CO2インキュベーター(37°C)内で5分間静置する。
- 上清を除去した後、加温したHBSS (37℃※1) 1,500 μlで3回洗浄する。
- 上清を除去した後、加温したworking solution (37℃※1) 1,500 μl を添加し、5% CO2インキュベーター(37°C)内で5分間静置する。
- セルスクレーパーで細胞を剥離し、フローサイトメトリーで測定する。
浮遊細胞の場合
- マイクロチューブに2 x 105 cells/tubeになるように細胞を分注する。
- 300 x g, 5分間遠心後、上清を除去し、加温したHBSS (37℃※1) 500 μlを加える。この操作を2回繰り返す。
- 300 x g, 5分間遠心後、上清を除去し、加温したHBSS (37℃※1) 500 μl を加えピペッティングにて懸濁後、37°C、5分間インキュベートする。
- 300 x g, 5分間遠心し、上清を除去する。
- 加温したBPA uptake solution (37℃※1) 500 μl またはHBSS (37℃※1、ブランク) 500 μl を加えピペッティングにて懸濁し、37°C、5分間インキュベートする。
- 300 x g、5分間遠心後、上清を除去し、加温したHBSS (37℃※1) 500 μl を加える。この操作を2回繰り返す。
- 300 x g, 5分間遠心後、上清を除去し、加温したworking solution (37℃※1) 500 μl を加え、ピペッティングにより懸濁する。
- 37°Cで5分間インキュベートする。
- フローサイトメーターで測定する。
実験例
アミノ酸トランスポーター阻害剤BCH(2-Aminobicyclo[2.2.1]heptane-2-carboxylic acid)によるアミノ酸取り込み阻害 (HeLa細胞)
蛍光イメージング、プレートリーダー測定
- 96 well ブラックマイクロプレート (ib89626 : ibidi社) の各ウェルにHeLa細胞 (1 x 104 cells/well) を播種し、5% CO2インキュベーター(37°C)内で一晩培養した。
- 培地を除去した後、HBSS (37°C) 150 μlにて3回洗浄した。
- 0 mmol/l (37°C、サンプル1)または1 mmol/l BCH (37°C、サンプル2)を含むHBSS (37°C) 150 μlを添加し、5% CO2インキュベーター(37°C)内で5分間静置した。
- 上清を除去した後、0 mmol/lまたは1 mmol/l BCHを含むBPA uptake solution (37°C、サンプル1, 2)あるいはHBSS (37°C、ブランク) 150 μl を添加し、5% CO2インキュベーター(37°C)内で5分間静置した。
- 上清を除去した後、HBSS (37°C) 150 μlで3回洗浄した。
- 上清を除去した後、working solution (37°C) を150 μlを添加した。
- 蛍光プレートリーダー(機種 : Infinite m200 PRO : TECAN社) 測定および、蛍光顕微鏡 (機種:BZ-X700 : Keyence社)で観察を行った。
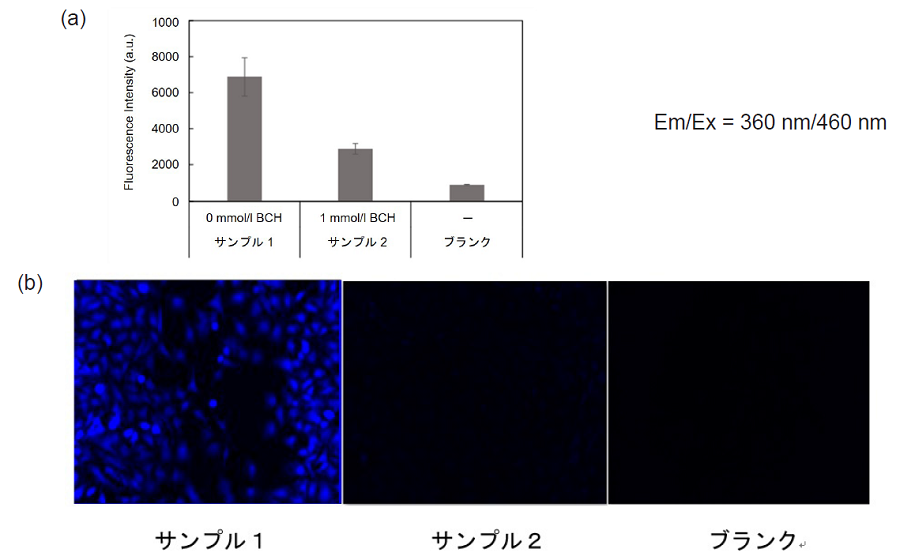
図4 アミノ酸阻害剤 BCH によるアミノ酸トランスポーター阻害
(a) プレートリーダー測定と (b) 蛍光イメージング
フローサイトメーター測定
フローサイトメーター測定
- 6 well マイクロプレートにHeLa細胞 (2 x 105 cells/well) を播種し、5% CO2インキュベーター(37°C)内で一晩培養した。
- 培地を除去した後、HBSS (37°C ) 1,500 μlにて3回洗浄した。
- 0 mmol/l (37°C、サンプル1)または1 mmol/l BCH (37°C、サンプル2)を含むHBSS (37°C) 1,500 μlを添加し、5% CO2インキュベーター(37°C)内で5分間静置した。
- 上清を除去した後、0 mmol/lまたは1 mmol/l BCHを含むBPA uptake solution (37°C、サンプル1, 2)あるいはHBSS (37°C、ブランク) 1,500 μl を添加し、5% CO2インキュベーター(37°C)内で5分間静置した。
- 上清を除去した後、HBSS (37°C) 1,500 μlで3回洗浄した。
- 上清を除去した後、working solution (37°C)を1,500 μlを添加し37℃で5分間インキュベートした。
- セルスクレーパーで細胞を剥離し、フローサイトメーター(LSR Fortessa X-20 : BD社製)で測定した。
- BV421 filter set (Ex: 405 nm, Em: 450/40 nm)
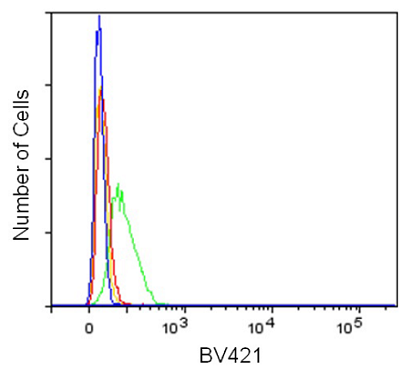
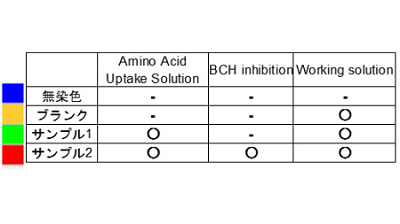
図5 アミノ酸阻害剤 BCH によるアミノ酸取り込みの阻害
本キットは大阪府立大学の切畑光統先生から技術指導および情報提供をいただき開発した製品です。
よくある質問/参考文献
UP04: Amino Acid Uptake Assay Kit
Revised Jul., 10, 2023


 を押して省略できます。
を押して省略できます。