各β-ガラクトシダーゼ検出試薬との比較データがAngewandte Chemie International Edition(論文)とSupporting Informationに掲載されています。下記の各検出試薬とサンプル毎に比較されている資料をご参照ください。
※論文およびSupporting Informationに表記されている「SPiDER-βGal-1」が、小社製品「SPiDER-βGal」に該当します。
X-Galとの比較
未固定試料をSPiDER-βGalで染色し、X-Galは固定試料を用いて染色しました。SPiDER-βGaは、X-Galと同じように、β-ガラクトシダーゼが発現した領域を特異的に染色することが示されました。このことから、SPiDER-βGalを用いることで、試料を固定化* せずに短時間で目的タンパク質の発現を確認することが可能となりました。
※試料を固定した後にSPiDER-βGalで染色することも可能です
蛍光試薬C12FDG及びFDGとの比較
C12FDG及びFDGは、フルオレセイン構造を有するβ-ガラクトシダーゼ検出用の蛍光試薬です。C12FDG及びFDGの蛍光特性はSPiDER-βGalと異なります。また、水溶性が比較的高いガラクトース部位を2つ有した構造のため、脂溶性の高い生細胞膜に対する透過性が低く、通常、蛍光染色には膜透過性を高める処理が施されます。β-ガラクトシダーゼ発現HEK細胞のライブ染色の結果から、両試薬の膜透過性の違いが蛍光染色に優位な差として確認されました。
|
SPiDER-βGal
試薬濃度 1 μmol/l
|
C12FDG
試薬濃度 33 μmol/l
|
FDG
試薬濃度 100 μmol/l
|
 |
|
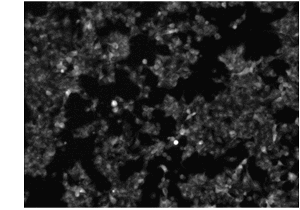
( Ex: 550/25 nm, Em: 605/70 nm )
|

( Ex: 470/40 nm, Em: 525/50 nm )
|

( Ex: 470/40 nm, Em: 525/50 nm )
|
( ) 内はフィルター条件 |
|
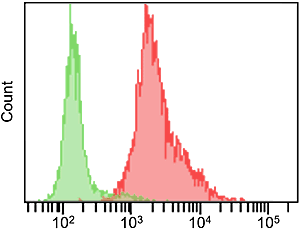
( Ex: 488 nm, Em: 515-545 nm )
|
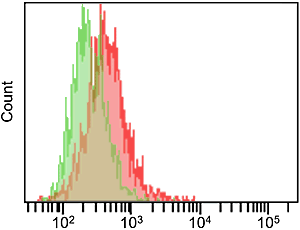
( Ex: 488 nm, Em: 515-545 nm )
|
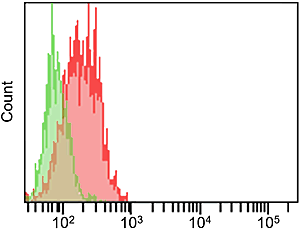
( Ex: 488 nm, Em: 515-545 nm )
|
緑:HEK293/LacZ(-)
赤:HEK293/LacZ(+) |
蛍光試薬HMDER-βGalとの比較
HMDER-βGalは、SPiDER-βGalと類似した構造を有するβ-ガラクトシダーゼ検出用の蛍光試薬です。HMDER-βGalの蛍光特性はSPiDER-βGalと同じですが、β-ガラクトシダーゼと反応後に近傍のタンパク質等に固定化されず細胞内滞留性の点において、SPiDER-βGalと性質が異なります。β-ガラクトシダーゼ発現HEK細胞のライブ染色の結果から、両試薬における細胞内滞留性の違いが蛍光染色に優位な差として確認されました。
抗β-ガラクトシダーゼ抗体との比較
SPiDER-βGalがβ-ガラクトシダーゼと反応して、その近傍で蛍光を発していることを、抗β-ガラクトシダーゼ抗体を用いた免疫染色法を用いることで確認されました。
・幼虫脂肪体のライブおよび固定化後の染色データ:Figure 3b(論文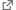 ) )
・マウス脳の染色データ:Figure 3c(論文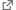 ) ) |
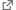 (論文)
(論文)









