 |
| �@�g�b�v�y�[�W > ES/iPS �זE�������t�g�D�ւ̕����U�����@�̊J�� |
 |
||||||||||||||||||||||
ES/iPS �זE�������t�g�D�ւ̕����U�����@�̊J��
|
||||||||||||||||||||||
 |
���@�L�� �F�{��w������w�������@���זE���� ���\�����זE����@���� |
 |
�H�@���� �F�{��w������w�������@���זE���� ���\�����זE����@���� |
�@Embryonic stem �iES�j and Induced Pluripotent Stem �iiPS�j cells are expected to use for regenerative medicine, and also serve a highly useful tool in the study of developmental biology. �@The embryonic endoderm requires signals from the adjacent germ layers for subsequent regionalization into specific endoderm organs. The requirement of inducing signal from the mesoderm led to the idea that coculture of ES cells with a feeder cell line would induce the ES cells to differentiate into the definitive endoderm.
This led to the discovery of M15, a mesonephros derived cell line, which has been shown to be an excellent endoderm inductive source. To establish optimal conditions for differentiation into pancreas, liver or intestinal cell lineages, ES cell were differentiated into definitive endoderm �iDE�j and were challenged with various growth factors or chemicals that affect certain signaling pathways at late stage. Among these tested growth factors and chemicals, we found that activin and FGF signals promote pancreatic differentiation, dexamethasone and HGF induce hepatic differentiation or the activation of Wnt and inhibition of Notch signaling pathways efficiently induced intestinal differentiation. Moreover, we established non-feeder systems using synthesized basement membrane or nanofiber as a scaffold for endoderm differentiation.
To identify endoderm or pancreas specific genes in ES cell-differentiation, we induced mouse ES cells into the mesendoderm, DE, mesoderm, ectoderm and Pdx1-expressing pancreatic lineages, and performed DNA microarray analysis. Genes specifically expressed in the DE and/or in Pdx1-expressing cells were extracted and their expression patterns in normal embryonic development were studied by in situ hybridizations. This review describes the establishment of endoderm differentiation methods of ES/iPS cells, and application of these differentiation systems into the study of developmental biology.
�L�[���[�h�F ES �זE�AiPS �זE�A����t�A�����U���AM15 �זE�AsBM
1�D �͂��߂�
�@2012 �N�̎R���L�틞�s��w�����̃m�[�x����w�����w�܂̎�܈ȍ~�A���זE�𗘗p�����Đ���Âւ̊S�͔��ɍ��܂��Ă���B 1 �^���A�a���҂ւ̎��Ö@�Ƃ��Ă��X���ڐA�A���邢���X���ڐA���L���ł��邱�Ƃ��m���Ă���B�ڐA���ʂ�����ɒቺ���ēx�ڐA���K�v�ƂȂ�ȂǁA����Ȃ���P���K�v�ł͂��邪�A���N�ԃC���X�������Â��痣�E�ł��邱�Ƃ�ڐA�O�ɔ�����̃R���g���[�����e�ՂɂȂ闘�_������B�������A�h�i�[�s���Ƃ����傫�Ȗ��_�����邽�߂ɈڐA�זE����@�Ƃ��� ES �זE/iPS �זE������Xβ�זE�U�������ڂ���Ă���B��X�́AES �זE�iembryonic stem cell /���זE�j����� iPS �זE�iinduced pluripotent stem cell /�l�H���\�����זE�j����̓���t�����U���@�\�ɂ��Č������s���Ă����B����X���̔����E�����ɂ��Č������s���Ă������A���̓���t�g�D�ł���̑��E���ւ̕����������s���Ă���B��X�́A����܂ŕ������T�|�[�g����ޗ��Ƃ��đَe�X���g�D�A�x���זE�A�[����ꖌ�A�i�m�t�@�C�o�[��p���邱�ƂŁA�ȕւ��V���v���ȕ����U���Z�p�̍\�z��ڎw���Ă����B�x���זE��p���������U���n�Ɋւ��ẮA�|�{�t�̑g����ύX���邱�Ƃɂ���X���E�̑��E���Ƃ���������t�g�D�݂̂Ȃ炸�A�O��t�E����t�n�זE�������悭�����U�����邱�Ƃɐ������Ă���B����ɁA�\�z���� ES �זE�����U���n�œ���ꂽ�e�핪���זE��p���Ėԗ��I��`�q������͂��s���A����t�̐V�K�זE�\�ʍR���}�[�J�[�Ƃ��� DAF1�iCD55�j�����o�����B�X�Ȃ��͂̌��ʁA����t���������X���ł̔����̕��Ȃ� 4 �̐V�K��`�q�肵���B�ȏ�̂悤�ɁA��X�͍Đ���Â�f���זE�쐻�ɂނ��� ES �זE�����U���n�̍\�z���s���A����ꂽ�m���ɂ��Ĕ����w�I��͎�@��p���Č����āAES �זE�̕����U���n�������̔������ۂ𗝉����邱�Ƃ̃c�[���Ƃ��Ĕ��ɗD��Ă��邱�Ƃ��ؖ����Ă����B�{�����ł́A�X�������U���̌���ɂ��ĉ�����A��X���\�z�����e�핪���U���@�A�����U�������̉������@���q�ׁA�Ō�� ES �זE�������瓾���m���������ւƉ��p������ɂ��ďq�ׂ�B
2�D �X�������U���̌���
�@�q�g ES/iPS �זE���Đ���Â̍ޗ��Ƃ��ėL�p�ł��邱�Ƃ͏�q�̒ʂ�ł��邪�A���A�a�̍Đ���ÂɊւ��ẮA�זE���x���ŋ@�\��L���Ă����Xβ�זE���[����זE�ڐA�ł��邱�Ƃ��瑁���̗Տ����p�����҂���Ă���B�{�͂ł́AES/iPS �זE�����Xβ�זE�ւ̕����U���̌�����Љ��B
�@�} 1 �ɗ������Xβ�זE�Ɏ���܂ł̔����n���̖͎��}�������B������́A�O�E���E����t�ƌĂ�� 3 �̍זE�w����Ȃ�A�X��������t�R���̑���ł���B�X�������͂܂��A�}�E�X�ɂ����đِ� 8.5 ���O��ɓ���t���̓���̈���X�O��זE�̗U�����N���邱�ƂŊJ�n�����B���̌�A�X�O��זE�͑��B���A�ِ� 10.5 ���ڍ��ɂ́A�w���ƕ����ɂ��ꂼ���X��ƌĂ��\�����`�������B����ɔ������i�ނƁA�ِ� 14.5 ���ڍ��ɂ́A������זE����ъO����זE���������n�߂�B������זE�� 4 ��̍זE�ɕ��ނ���A�ŏ��ɃO���J�S���傷��α�זE���������ďo�����A���̌�C���X�����傷��β�זE�A�\�}�g�X�^�`���傷��δ�זE������X�|���y�v�`�h�傷�� pancreatic polypeptide�iPP�j�זE���������Ă���B ES/iPS �זE�����X�����U������ۂ��} 1 �Ɏ����悤�ȃ}�[�J�[��`�q�̔������w�W�ɂ��āA�������Xβ�זE�ւ̐���Ȕ��������ߒ����Č�����Ƃ�����@���Ƃ��Ă���B�܂��A�̑��E���Ȃǂ�����t�R������ł���A�X���̏ꍇ�Ɠ��l�ɐ��픭���ɂ����Ēm���Ă���U���V�O�i���� ES �זE�֗^���邱�ƂŁA���ꂼ��̑g�D�ւ̕����U�������݂��Ă���B

�@�X��������t�R���̑���ł��邪�AES �זE���������t�̑��ɂ��A�����A��̊O�g�D���`��������̊O����t�Ƃ������̂���������i�} 1�j�B������̊O����t�ł́A����������t�}�[�J�[���������Ă��邱�Ƃ��킩���Ă���B���̂��߁AES �זE���琳�픭���ɉ������`���Xβ�זE�邽�߂�����t����������U�����s���ꍇ�A�����ɕ�����������t������t�Ȃ̂���̊O����t�Ȃ̂�����ʂ��邱�Ƃ�����Ȏ������������B���̖��́A2005 �N�� Yasunaga �� 1�j �ɂ��}�E�X ES �זE����A�܂� D'Amour �� 2�j �ɂ��q�g ES �זE��������t�ւ̌����I�ȕ����U�����@�A����ɂ� Cxcr4 �Ƃ������q������t�݂̂ɔ������A��̊O����t�ɂ͔������Ȃ��Ƃ������Ƃ�����A�悤�₭�������ꂽ�B�ނ�́AES �זE�����������ŃA�N�`�r���ܗL�|�n��p���Ĕ|�{���邱�Ƃɂ��A�}�E�X����уq�g ES �זE������Ɍ����I������t�����������ƕ����B���肳�ꂽ Cxcr4 ���q������t�̃}�[�J�[�Ƃ��ĕp�ɂɎg����悤�ɂȂ����B 2005 �N�ɕč��� Novocell �Ёi�� ViaCyte �Ёj�� D'Amour ��ɂ���ăq�g ES �זE�������t�זE�������I�ɕ����U��������@ 2�j ������Ĉȍ~�́A���̕��@�����ɗl�X�ȕ����U�����@���J������Ă����B 2006 �N�ɂ̓q�g ES �זE��������t����Đ��픭���ɉ������`�ŃC���X�������Y�������Xβ�זE���U�����邱�Ƃɐ��������ƕ��� 3�j �B����A���n���Ɋւ��ẮA����ꂽ�C���X�����Y���זE�̓O���R�[�X�l�ɉ����ăC���X���������ʂ�ς��邱�Ƃ����܂�ł����A�ۑ���c���Ă����B�����ŁA�ނ�͂�萬�n�����זE�邽�߂��Xβ�זE�֕����r���̍זE���}�E�X�ֈڐA���Ain vivo �Ő��n��������Ƃ����헪���Ƃ�A�q�g ES �זE�R���X���זE���}�E�X�̓��Ő��n���A����ɋ@�\���邱�Ƃ������� 4�j �B�} 2 �ɂ͂���܂ŕ���Ă���q�g ES �זE�����Xβ�זE�ւ̕����U�����@�ɂ��Ė͎��I�ɂ܂Ƃ߂����A2006 �N�� D'Amour �̕��@����{�Ƃ��āA�l�X�ȉ��ǂ��Ȃ���Ă������Ƃ��킩�� 5-9�j �B

3�D �����U�����@�̍\�z
�@ES/iPS �זE����ړI�̑g�D���U�����邽�߂ɂ́A�œK�ȑ���Ɣ|�{�t�̑g�ݍ��킹���K�v�ł���B�{�͂ł́A��X���\�z���Ă��������U���n���Љ��ƂƂ��ɑ��ꂨ��є|�{�t�ɏœ_���i���āA�U�����@�\�z�̃v���Z�X�ɂ��Ă�����������B
3-1�D�}�E�X�َe�X�g�D��p�����X�������U��
�@�X���͓���t�R���̑���ł���A�Xβ�זE���X�O��זE�E������O��זE����Ĕ�������B��X���X�������U���������J�n���������́AES �זE�����ɂ������X�������̗U���V�O�i�����ɂ��Ă̏��͂قƂ�ǂȂ������B�����ŁA��X�́AES �זE���}�E�X�َe�̊e����Ƌ��|�{���邱�Ƃɂ���X�O��זE�ւ̕����U�������݂��B�]���ɂ́A�X���O��זE�}�[�J�[�ł��� Pdx1�ipancreatic and duodenal homeobox 1�j��`�q���� LacZ ���������ꂽ Pdx1/LacZ ES �זE��p�����B�����̌��ʁAES �זE�ƃ}�E�X�َe�X����邢���X�ԏ[�D�Ƃ����|�{����ƁA�X�O��זE�ւ̕����U�������i����邱�Ƃ����������� 10�j �i�} 3�j�B�܂��A�e��t�����q���X�����U���ɋy�ڂ��e���ɂ��ĕ]���������ʁA�X�O��זE�ւ̕����ɂ͉t�����q�Ƃ��� TGF β2 ���L���ł������B����ɁA�������̊O����`�q�� ES �זE�ɋ����������A�X���ւ̕����ɑ��铱����`�q�̌��ʂׂ��B���̌��ʁA����t�U�����������j���g���� cmix ��`�q���}�E�X ES �זE���ŋ����������邱�Ƃɂ��A�X������ TGF β2 �������X�����U���������������A���̑������ʂ� cmix �`�����̔����ʂƑ��ւ����B
3-2�D �x���זE M15 ��p���������U��
�@��L�̌����őَe�X������X�������U���V�O�i�������݂��邱�Ƃ͖��炩�ɂȂ������A�����U���@���̉𖾂ɂ́A���ȕւŌ����I�ȕ��@���K�v�ł������B���픭���ɂ����ē���t�͋ߐڂ��钆�E�O��t�̈悩��̃V�O�i�����đO�㎲�ɉ������̈扻�����肳��邱�Ƃ�����Ă����B�����ŁA����t�R���̔|�{�זE����U���V�O�i�����Ƃ��ė��p���镪�����@�̎��������݂��B
������̍זE���ɂ����X�����U�������ׂ����ʁA����t�R���|�{�זE�� M15 �זE�ɗU�����������o���AM15 �זE���x���זE�Ƃ��ėp����A�V�����X�����U���@�̍\�z�ɐ������� 11�j �i�} 3�j�B
�����U�����@�̊J������їU����̍זE�̉�͂ɂ́APdx1 �v�����[�^�[���� GFP�iGreen Fluorescent Protein�j�������g�݊�����`�q���z���Ɏ���`�q�g�݊����}�E�X����ՖE����������� Pdx1/GFP ES �זE��p�����B�e��}�[�J�[�̔�����͂̌��ʁA��L�����U���@�ɂ�� ES �זE������l�̂�����ɓ���t��I��I�ɕ����U�����邱�Ƃ��\�ł���A�X���݂̂Ȃ炸�A���̓���t�R������i�����A�x�A�̑��A�����j�}�[�J�[�̔������F�߂�ꂽ�B����ɁA�X�N���[�j���O�Ɏg�p�����זE���ɂ��ă}�C�N���A���C��͂��s���AM15 �זE�̂��������i�\�̖͂{�̂ɂ��ĉ�͂��s�����B��͂̌��ʁA�X�������Ɋւ��āAActivin�CFGF�iFibroblast growth factors�j�C���`�m�C���_�E�ڒ����q�̊֗^���������ꂽ�B�����ŁAM15 �זE�� Activin ����� FGF �̓Y����g�ݍ��킹�邱�Ƃ� ES �זE������Ɍ����悭�X�O��זE���U���ł�����@���m���ł����B��ʓI�ȉ�͂̌��ʁA�x���זE�݂̂̏ꍇ�ɓ������X�O��זE�͖� 2�� ���x�ł��������A�t�����q��Y�����邱�ƂŖ� 30�� �Ɣ���I�ɑ��������i�} 3�j�B����ꂽ�X�O��זE�ɂ��ẮA�}�E�X�ւ̈ڐA�������s���A�X�����\�����邷�ׂĂ̍זE�֕����\�ł��邱�Ƃ��킩�����B
�@�̑��͑n���ɂ����Ē��S�I�������ʂ�������ł��邪�A�V���╨���̑̓��ł̑�ӂ���іŐ������Ȃǂɂ����āA�����̍זE�ƃq�g�̍זE�ł͕�����ӂ̑傫�ȈႢ�����邱�Ƃ���A�������������ł͓Ő��ƗL�����̌��肪�s�\�ł���B�܂��q�g�̍זE�̋������ɂ߂Č��肳��Ă���A�����̒҂���W�߂�ꂽ�זE�g�D�ł͎����f�[�^�̂�����傫���L�Ӌ`�Ȍ��ʂ邱�Ƃ͍���ł���B�����ŁA�q�g ES/iPS �זE����̍זE�ւ̕����U���Z�p���m���ł���A���肵���q�g�̍זE�̋������\�ƂȂ�A�n������ɂ�����ɂ߂ďd�v�ȋZ�p�v�V�ƂȂ�B
��X�́A�܂��A�}�E�X ES �זE��p���Ĕ|�{�����̎��K�����s���A��̌����Ō����������X�������U����������A�������|�{������ς��Ă������Ƃɂ��A�̑������ɍœK�Ȕ|�{�t�̑g�������肵���B�ŏI�I�ɂ��X�������U��������L���� Activin �� FGF ���������A����� HGF �iHepatocyte growth factor�j�ADex �iDexamethasone�j�Ȃǂ�Y�����邱�ƂŔ��Ɍ����悭�̑�������U���ł��� 12�j �i�} 3�j�B�{���@�́A�}�E�X ES �זE�݂̂Ȃ炸�q�g ES �זE�ɂ����p�\�ł���AES �זE�R���̊̑��זE�𗘗p���邱�ƂŁA�̑������@���̂���Ȃ�𖾂�V��̈��S���]������і]���ւ̉��p�����҂����B

�@�������́A�H������z���E��ӂ���d�v�ȑg�D�ł���B
����܂ł́A�q�g�������R���זE�� Caco2 �זE���n��ɂ�������Ԏ����̃��f���Ƃ��Ĕėp����Ă���B�������ACaco2 �זE�͏������ɔ�ׂ�Ɩ�ӊ������Ⴍ�A�|�{���@�ɂ���čזE�̐����ɑ傫�ȍ���������ȂǁA���_�������B�ߔN�A���̂̒����זE�����͐���ł��邪�AES/iPS �זE����̕����U�������͂��܂�s���Ă��Ȃ������B���̂��߁A�����ւ̕����U���ɂ��Ă��A�܂��͊̑��̏ꍇ�Ɠ��l�Ɏx���זE��p���ĕ����U����������t�ɑ��āA�l�X�Ȑ������q�E�ᕪ�q��������Y�����Ĕ|�{���s�����ƂƂ����B�X���}�[�J�[�ł��� Pdx1�C�����̑��}�[�J�[�ł��� α-fetoprotein�iAFP�j�C�����}�[�J�[��`�q Cdx2 �̔������w�W�ɁA�������זE�ւ̕�����I��I�ɑ��i���������T�������B�l�X�ȏ��������̌��ʁA����t�����U����� WNT �V�O�i�������������鉻���� BIO �� Notch �V�O�i����}�����鉻���� DAPT �������邱�Ƃɂ��A�������̍זE�ւ̕��������i����A�S�̂� 88�� ���x�̍זE�� Cdx2 �z���̏������̍זE�ւƕ������� 13�j �i�} 3�j�B�܂����̕����ߒ��ɂ� Fgf �� Bmp�iBone Morphogenetic Protein�j�Chedgehog �V�O�i�����֗^���Ă��邱�Ƃ��������ꂽ�B����������������t����A�z�����זE�E�t�זE�E�p�l�[�g�זE����ђ��Ǔ�����זE�̕����זE���U���ł��邱�Ƃ��m�F���Ă���B����͂��̍זE��p���������̔������J�j�Y���≊�ǐ��������̕a���𖾂Ȃǂ̊�b�����Ƒn���Đ���ÂȂǂ̉��p���������҂ł���B
�@ES �זE����e��t��U������Z�p�ɂ��ẮA�����̕����邪�A��̌n�ŎO��t�ւ̕������Ɋώ@�ł��镪���U���n�͂̕Ȃ������B��X�́A��q�̂悤�ɒ���t�R���̔|�{�זE�� M15 �זE��p���ē���t�g�D�ł����X���E�̑�����ђ��Ƃ���������t�g�D�������I�ɕ����U��������@���\�z���Ă����B�����̌����œ���ꂽ�m�����Q�l�ɂ��āAM15 �זE�Ɖt�����q�̓Y����g�ݍ��킹�邱�Ƃɂ��AES �זE�������t�݂̂Ȃ炸����t����ъO��t�������悭�����U�����邱�Ƃɐ��������B
Activin ����� bFGF ��Y�����邱�Ƃɂ�蒆����t�E����t���ABMP7 ��Y�����邱�Ƃɂ�蒆��t���AP38MAPK �̑j�Q��ł��� SB203580 ��Y�����邱�Ƃɂ��_�o�O��t�������I�ɕ����U�����邱�Ƃ��ł��� 14�j �i�} 3�j�B�����U�������e�זE�ɂ��āA�}�C�N���A���C��͂��s�������ʁA�e��}�[�J�[��`�q�̔������m�F�ł����B���̊e��t�ɂ�����}�C�N���A���C��͂̌��ʂ����ɁA��q����V�K����t�}�[�J�[�̒T�������t���������̊ȕւȑ��� Kit �̊J���Ȃǂ̌������X�^�[�g�����B����ɒ����|�{���s�������ʁA�_�o�n�ł̓j���[�����݂̂Ȃ炸�A�X�g���T�C�g��I���S�f���h���T�C�g�ւ̕����A����t�n�ł͍��⎉�b�זE�ւ̕���������ꂽ�B�ȏ�̂��Ƃ���AM15 �זE��p���ĕ����U�������זE�́A���n�����_�o����ђ���t�֕�������\�͂�L���Ă��邱�Ƃ����炩�ɂȂ����B
�@��L�� M15 �זE��p��������t�g�D�i�X���E�̑��E�����j�A����t����ъO��t�ւ̕����U�����@�̍\�z�ߒ��ŁA����̏����͓����ł����Ă��A�|�{�t�g���݂̂�ύX����邱�Ƃɂ��A�������R���g���[�����邱�Ƃ��\�ł��邱�Ƃ����炩�ƂȂ����B���̂��Ƃ́A���̌�̉�X�̕����U�������ɂ����Ĕ��ɑ傫�ȉe����^����m���ł������B
3-3�D�[����ꖌ�isBM�j��p���������U��
�@�����āAM15 �זE�� ES �זE�ւ̓��������ׂ邽�߂ɓ�̎������s�����B�܂��A�����|�{�t�ňقȂ�זE�Q���ʂɔ|�{�\�ȃg�����X�E�F����p�������|�{�n��p���AM15 �זE�̉t�����q�̉e���ׂ��Ƃ���A�����̓���t�U���ɂ����Ă͉t�����q���d�v�ł��邪�A���̌�̑�����ٓI�����ɂ͋����e�����F�߂��Ȃ������B����AM15 �זE���p���z�����A���f�q�h�ŌŒ肵�Ă��A�����X���������i���ʂ͎����Ȃ������B�ȏ�̌��ʂ���AM15 �זE�� ES �זE�Ƃ� cell-cell ���邢�� cell-matrix ���ݍ�p���X�������ɂ͏d�v�ł��邱�Ƃ��������ꂽ�B���ɁA�}�C�N���A���C��͂ɂčזE�O�}�g���b�N�X��`�q�̔����ʂׂ��Ƃ���AM15 �זE�͑��̎x���זE�ł��� PA6 �� OP9 �זE�Ɣ�ׂāAcollagen type IV �ƃ��~�j��α5�iLama5�j�̔������������Ƃ����炩�ɂȂ����B�����͊�ꖌ�̎听���ł��邪�A�Ȃ��ł����~�j���� 3 �̃T�u���j�b�g����\������Ă���Aα���Aβ���Aγ�������ꂼ�������w�e���O�ʑ̂ł���B����ɁAM15 �זE�ɂ�����Lama5 �̔������m�b�N�_�E������ƁA�X���ւ̗U�����}������邱�Ƃ��m�F�����B
�@�����ŁA��X�͍������������̎������g���m��̃O���[�v���m���������~�j�� 10 �iα5 β1 γ1�j��L�x�Ɋ܂ދ[����ꖌ�isynthesized basement membrane, sBM�j�ɒ��ڂ��A�����p�����V�K�X�������U���n�̊J�������݂��B M15 �זE�ł̒m�����Q�l�ɂ��āA����t����������X�������ɂ�����|�{�t�g����l�X�������邱�Ƃɂ��A���̌��ʁAsBM ��ɂ����Ďx���זE������ ES �זE�͓���t�����X�O��זE�ւƕ������A����ɃC���X�����Y���זE�ɂ܂ŕ������邱�Ƃ𖾂炩�ɂ��� 15�j �i�} 4�j�B����� sBM ���X�������U�����J�j�Y������͂������ʁA���~�j���̃V�O�i�����C���e�O��������ē`�B����A�X��������U�����Ă��邱�Ƃ������������B
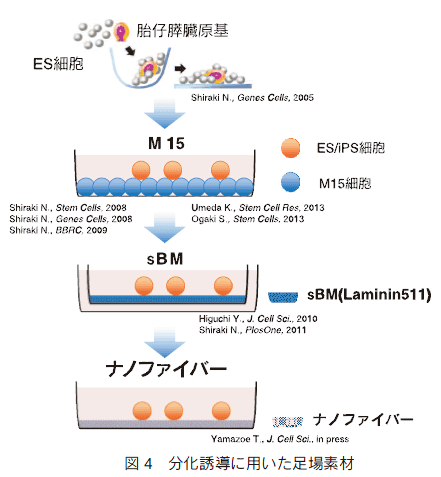
�@�����āAsBM �̊̑������U���ւ̓K�������݂��B�헪�� M15 �זE�̏ꍇ�Ɠ��l�œ���t�����U����̔|�n�g�����̑������Ɏ��K�����邱�ƂŁA�̑����U�������݂��B�����̌��ʁA sBM ��ł��}�E�X����уq�g ES �זE����A���u�~���債�A��Ӎy�f�����������@�\�I�Ȋ̑��זE�̕����ɐ������� 16�j �B����ɁAsBM ����̗U�����J�j�Y������͂������ʁA��ꖌ�����ł��郉�~�j���̃V�O�i�����C���e�O��������ē`�B����AAkt �i�v���e�C���L�i�[�[ B�j�̃����_������āA�̑�������U�����Ă��邱�Ƃ������������B
3-4�D�i�m�t�@�C�o�[��p���������U��
�@�Đ���Â� ES/iPS �זE�����p����ɂ�����A�|�{�n�ɂ͖��m�̐����A�Ƃ�킯�َ퓮���R�������͉y�I�ɔr������邱�Ƃ��]�܂��B�����Ŏ��ɒ��ڂ����̂́A���S�Ȑl�H������ނ�p������@�ł���B�Ȃ��ł��|���A�~�h���G���N�g���X�s�j���O�@�ɂ���ă����_���z�������i�m�t�@�C�o�[�́A�}�E�X ES �זE�̑��B���i�⏉�ド�b�g�̍זE�@�\�ێ��ɓK���Ă���ƕ���Ă������Ƃ���A���̊�ނ� ES/iPS �זE�̊̑������Ɏg�p�����邩�ۂ������������B�x���זE���g�킸�ɖ����������œ���t�g�D���U������ۂ̔|�n�g���ɂ��ẮAsBM ��p���������ő����̏��̒~�ς�����A�i�m�t�@�C�o�[��p���������U���n�̍\�z�ɑ傫���𗧂����B
�@�����̌��ʁA�[���`���Acollagen type�T�Afibronectin�A�}�g���Q�����R�[�g�����ʏ�̃v���[�g�Ɣ�r���āA�i�m�t�@�C�o�[�͌����悭����t�}�[�J�[�ł��� Sox17 �̔��������AES/iPS �זE���A���u�~������\�� ICG ��荞�ݔ\���ǍD�Ȋ̑��זE�ɗU������ 17�j �i�} 4�j�B ���ʂ̂���i�m�t�@�C�o�[�̔|�{�M�\�ʂł́A�זE�̓h�[����Ɋۂ����݂� in vivo �Ɨǂ������`�Ԃ������Ă���A��X�͍זE���i�̐���Ɋւ�� Rho �t�@�~���[�ɑ����� Rac1 ���A��������Ԃ� ES �זE�݂̂Ȃ炸�����ߒ��ɂ����Ă��i�m�t�@�C�o�[��Ŋ���������Ă��邱�Ƃ����o�����BRac1 �I��I�j�Q���p�����������ʂ��� Rac1 �̊������͏����̓���t�U���݂̂Ȃ炸�A����t����̑��ւ̗U���ɂ����Ă��d�v�Ȗ�����S���Ă��邱�Ƃ𖾂炩�ɂ����B
4�D�����̉���
�@�����U�����@���\�z���邤���ŁA�����x�̊ȕւȕ]�����@�̗L���́A�\�z�ɕK�v�Ȍ������Ԃɑ傫���e������B�܂��A�q�g ES/iPS �זE�͊e��זE�ɕ��������邱�Ƃ��\�����A���������� 100�� �ł͂Ȃ��������ȍזE���T���v�����Ɏc�邱�ƂƂȂ�B���̂��߁A�����̃��X�N�����関�����ȍזE���������A�ړI�̍זE��I�ʂ��邽�߂Ƀt���[�T�C�g���g���[�����p����Ă���B�����ŁA��X�͊̑����������A���^�C���Ń��j�^�[���A���I�ʂ���͂���ړI�ŁA�������Ȉ�`�q�����g�����Z�p�ł���w���p�[�ˑ��^�A�f�m�E�B���X��p���āA�A���u�~���iALB�j��`�q���ɞ�F�u���^���p�N���imKO1�j��`�q�������q�g ES �זE������� iPS �זE������������ 18�j �B���̍זE���R���̕����זE�ł́AmKO1 �̌u�������݂� ALB ��`�q�̓]�ʊ����f���邽�߁A���|�[�^�[�̌u�����w�W�ɁA�̍זE�������A��ʉ��A�������邱�Ƃ��\�ł���B�X�Ƀt���[�T�C�g���g���[�őI�ʂ��� mKO1 �z���זE�ƉA���זE���A�}�C�N���A���C��͂ɂ���r�����Ƃ���AmKO1 �z���זE�ɂ����āA��ӂȂǁA�̋@�\�Ɗ֘A�̂����`�q�Q�̔������������Ă���AmKO1 �z���זE���̍זE�̓�����L���邱�Ƃ��m�F���ꂽ�B���݂́A�{�זE����p�����̑������U���̍X�Ȃ���P��A�̑����ٓI�ɔ�������V�K�}�[�J�[��`�q�̒T�����s���Ă���B
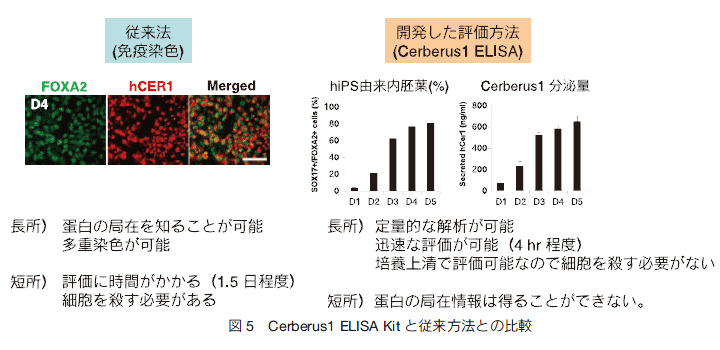
�@�ʏ�A ES/iPS �זE�������t�g�D�ł����X���E�̑��E�����U�����邽�߂ɂ́A�ꂩ����v���A�쐬���邽�߂ɂ͉t�����q�ȂǃR�X�g��������B�����ŁA���Ԃ��p�ʂɂ��Ȃ����߂ɂ͍ŏI�����Ɏ���ߒ��ŁA�����U�����������Ă��邩���`�F�b�N����K�v������B����A�Đ���Â� ES/iPS �זE�R���̕����זE�𗘗p����Ƃ����ꍇ�͂��̕����U���ߒ��ŕi���`�F�b�N���O�ꂳ���ł��낤�B����܂ŕ����x�̊m�F�́A�w�W�ƂȂ�זE���^���p�N���̔����ʂ������Ԃ��Ƃɑ��肵�A�����̔����ʂ̕ω��Ŕ��f���邽�߈ꕔ�̔|�{�זE��j��K�v���������i�} 5�@�]���@�j�B�����ŁA��X�͊�����Г��m���w�������Ƌ����ŁA�|�{�㐴���ɕ��傳�ꂽ Cerberus1 �^���p�N���𑪒肷�邱�ƂōזE��j�邱�ƂȂ�����t�זE�̕����x�𑪒肷����@���\�z���� 19�j �i�} 5 ELISA�j�B��q���� ES �זE�R������t�E�O��t�E����t�̃}�C�N���A���C���ʂ���A����t�œ��ٓI�ɔ���������������q��T���������ʁACerberus1 �����o�����B�}�E�XES�זE�����t�֕��������ꍇ�ACerberus1 mRNA �̔����ʂ͓���t�}�[�J�[�ł��� Sox17 �iSry-box containing gene 17�j�̔����Ƒ��ւ��A�|�{�㐴���ɕ��傳�ꂽ Cerberus1 �ʂ����������ɔ�Ⴕ�đ������A����t�̊����Ƃ̑��ւ��m�F���ꂽ�B�܂��A�q�g iPS �זE�ɂ����Ă��A�|�{�㐴���� Cerberus1 ����ʂ͓���t�̍זE���Ƒ��ւ��邱�Ƃ����炩�ƂȂ����B�{���@�́A�זE���̒`���̋Ǎݏ��͓��邱�Ƃ��ł��Ȃ��Ƃ����Z���͂�����̂́A�]�����Ԃ� 4 ���ԂƒZ�����Ƃ�זE���E�����ƂȂ��|�{�㐴�݂̂Œ�ʓI�ȕ]�����\�ȓ_���]���@�Ƃ̑傫�ȈႢ�ł���B���� ELISA Kit ��p���邱�ƂŁAiPS �זE���p���|�{���Ȃ������t�����������ȕւɑ��肷�邱�Ƃ��\�ƂȂ�AiPS �זE�����̕i���Ǘ��ւ̗��p�����҂����B
5�DES �זE�������甭��������
�@ES �זE�̌����ł́A���������œ����Ă����m���𗘗p���邱�Ƃ������B��X�� ES �זE�����U���������瓾��ꂽ�m���������։��p����Ƃ����������s���Ă����B�{�͂ł́A���̗�� 2 �����B
�@ES �זE�������̍זE���U�����邽�߂ɂ́A���̗̈�ɂ͔��������A�ړI�̗̈�݂̂ɔ�������}�[�J�[��`�q�����ɏd�v�ł���B�������A�����I�ɂ͕����̃}�[�J�[��`�q��g�ݍ��킹�ĕ����זE��]�����邱�Ƃ������B�����ŁA��X�́A����܂ŏq�ׂ� ES �זE�����U���n�ƃ}�C�N���A���C��p���āA����t�ɓ��ٓI�ɔ��������`�q�̒T�����s�����i�} 6A�j�B�����̌��ʁA�V�K����t�}�[�J�[�Ƃ��čזE�\�ʍR���ł��� DAF1 �iCD55�j�肵�� 20�j �B����ɁA�����̃}�[�J�[��`�q�ł��� Cxcr4 �A���� Pdx1 �z���זE�����݂���ِ� 9.5 ���ڐ������p������͂ł́A DAF1 �͂��ׂĂ� Pdx1 �z���X�O��זE�Ŕ������Ă���A�X������t�}�[�J�[�Ƃ��Ă��L�p�ł��邱�Ƃ��������ꂽ�i�} 6B�j�B����ɁA DAF1 ���זE�\�ʍR���ł��鐫���𗘗p���čR DAF1 �R�̂𗘗p��������t�זE�̔Z�k���\�ƂȂ�A����t������X�������̂悢�c�[���Ƃ��ė��p�ł���B���݂́A���� DAF1 �z������t�̐����ɂ��ďڍׂɌ�����i�߂Ă���B
�@��X�́A��L�̃}�C�N���A���C��͂��X�ɐi�߂āA�X�����ٓI�ɔ�������V�K��`�q�̒T�����s�����B�}�C�N���A���C��͂̌��ʂ��� ES �זE�R���̓���t���X���O��זE�Ŕ����̍�����`�q�� 65 ��`�q���o���A�����̈�`�q�ɂ��đِ� 8.5 ���ڂ���Ƒِ� 14.5 ���ڂ��X���� in situ hybridization ���s�����B��͂̌��� 27 �̈�`�q�ɂ��ē���t���������X���ł̔����肵�� 21�j �B����ɁA���̈�`�q���ɂ� 4 �̐V�K��`�q�iAkr1c19�C Aebp2�C Pbxip1�C Creb3l1�j���܂܂�Ă����i�} 6C�j�B���݂́A���ꂼ��̈�`�q�ɂ����X�������ɂ�����������ڍׂɌ������Ă���B

6�D�I����
�@�{�e�ł́A�X�������U���ɂ��Ă̌���ɂ��ĉ�������B����ɁA���������ō\�z���������U���n�ɂ��đ��ꂨ��є|�{�t�� 2 �̊ϓ_����q�ׁA�Ō�ɕ����U���������瓾���m���̔��������ւ̉��p�ɂ��Đ��������B ES/iPS �זE����쐬���������p�����Đ���Â��������邽�߂ɂ́A�����I�ȕ����U�����@�̍\�z�͂��Ƃ��AXenogenic Free �Ȕ|�{�n�̍\�z�⎡�ÂɕK�v�ȍזE���̊m�ۂȂǂ̉ۑ肪����A�ړI�זE�̏��������R�K�v�ƂȂ�ł��낤�B����A��L��肪��������A ES/iPS �זE�R���זE���Տ����p����邱�Ƃ����҂���B
| ���҃v���t�B�[�� | |
| ���� | ���ؐL���@Shiraki Nobuaki |
|---|---|
| ���� | �F�{��w�@������w�������@���זE����@���\�����זE����@���� |
| �A���� | ��860-0811 �F�{���F�{�s������{�� 2-2-1 TEL �F 096-373-6806 E-mail �F shiraki@kumamoto-u.ac.jp |
| �o�g�w�Z | �F�{��w��w�@��w������ |
| �w�� | ���m�i��w�j |
| ���� | �H�����@Kume Shoen |
|---|---|
| ���� | �F�{��w�@������w�������@���זE����@���\�����זE����@���� |
| �A���� | ��860-0811 �F�{���F�{�s������{�� 2-2-1 TEL �F 096-373-6620 E-mail �F skume@kumamoto-u.ac.jp |
| �o�g�w�Z | ����w��w�@���w�n������ |
| �w�� | ���m�i���w�j |
| Copyright(c) 1996-2013 DOJINDO LABORATORIES,�@ALL Rights Reserved. |