レドックス応答性タンパク質チオール解析用試薬 DNA マレイミド
株式会社同仁化学研究所 加治屋 いづみ、大内 雄也
生体は内外の環境変化に迅速に応答し、その恒常性の維持を図っている。その中でもエネルギー代謝や免疫応答の過程で発生する活性酸素は、生体が受ける最も大きなストレスであり、疾病や老化の大きな要因の一つとして広く認知されている。近年では、このような酸化ストレスの障害性という負の面だけではなく、重要なシグナル伝達機能としての役割が明らかとなり、酸化および還元反応を利用した細胞機能制御は新たな研究ステージに入ってきている。その中心にあるのが、タンパク質に存在するシステインである。システインのチオール基は生体内のレドックス変化に応答するセンサー部位であり、過酸化、ニトロシル化、スルフヒドリル化、グルタチオン化などの様々な化学的修飾を受けることで転写やタンパク質発現、細胞死などの様々な細胞応答を引き起こすことがわかってきている。従って、タンパク質内のチオール基修飾の解析は、レドックスシグナルを理解する上で必要不可欠であり、近年のプロテオミクス技術の発展に伴う網羅的なタンパク質解析と並行して、特定タンパク質のシステインチオール基の詳細な解析が進められている。
今回のトピックでは、特定タンパク質内のチオール基が修飾を受けているのかどうか、修飾を受けているチオール基はいくつあるのかを簡便に解析できる手法について紹介したい。
電気泳動によるタンパク質分離やウェスタンブロットによるタンパク質解析は、古くから使用されている汎用的な手法であり、現在でもタンパク質を用いた実験には欠かせない技術のひとつである。これらの手法を用いて反応性チオール基の解析を行う場合、何らかの化合物でチオール基をラベル化し、ラベル化による変化を追跡することでその情報を得ることができる。最も一般的な方法である蛍光標識法の場合には、タンパク質に反応性チオール基が存在すれば、その量に応じてタンパク質に蛍光化合物を導入することが出来るので、タンパク質に付加される蛍光シグナルによって反応性チオール基の有無あるいは量的情報を得ることができる。しかし、多くのレドックス応答性タンパク質のようにタンパク質内に複数の反応性チオール基が存在する場合には、蛍光強度の比較だけではその解釈は困難である。すなわち、タンパク質全体量に対する反応性チオール基の平均的な量をモニターすることはできるが、チオール基の状態変化に関する情報は得ることができない。特にレドックス応答性タンパク質の場合には、反応性チオール基の平均量ではなく、個々のチオール基の状態変化が重要な情報となるため、蛍光標識法ではなく分子量変化による解析法がより有効な手段となる。つまり、反応性チオール基を適当な化合物で標識し、SDS-PAGE によってタンパク質を分離することで、反応性チオール基の数に応じて分子量の変化をモニターし、バンドシフトの形で反応性チオール基の分布情報を得ることができる。

AMS(4-Acetamido-4-maleimidylstilbene-2,2-disulfonic acid)やマレイミド化ポリエチレングリコール(PEG-mal)は、本目的に使用されるチオール標識試薬であり、レドックス応答性タンパク質を解析する上で欠かせない存在となっている。しかしながら、AMS は分子量が小さいため、電気泳動時のバンドシフトが小さく、大きなタンパク質には適用できないという欠点がある。一方、PEG-mal は分子量が大きいため、標識によるバンドシフトが大きく、様々なタンパク質への適用が可能である。しかし、PEG-mal 自体に分子量分布が存在するため標識したタンパク質のバンドがブロードであり、PEG で標識されたタンパク質の電気泳動度の変化は分子量に比例しないため、バンドシフトからチオール基数の情報を得られないという欠点がある(Fig. 2, 3)。

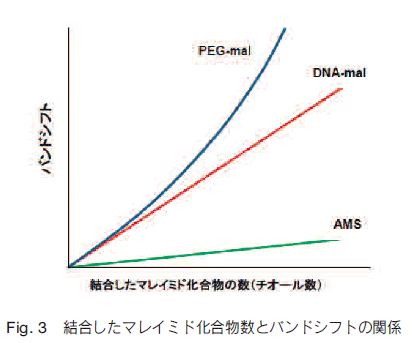
そこで、原、久堀らはこれらの問題を解決しうる新規のマレイミド化合物 DNA-maleimide(DNA-mal)を開発した。この化合物は、一本鎖 DNA の末端にマレイミド基を導入した単純な構造だが、合成する DNA の分子量が単一であるため標識されたタンパク質のバンドが非常に明瞭であり、標識によるタンパク質泳動の変化がチオール基数に比例するという特長を有している(Fig. 2, 3)。今回使用されている DNA は、塩基数が 24 であり、電気泳動上ではチオール基 1 個あたり約 9 kDa のバンドシフトを示す。また少なくとも 6 つの反応性チオール基を有するタンパク質までは、チオール基数に比例したバンドシフトを示すことがわかっている。さらに、種々の異なる電気泳動条件下でラベル化タンパク質を泳動した場合、PEG-mal は泳動条件によってバンドシフトが変動するのに対し、DNA-mal は泳動条件に関係なく分子量変化に応じたバンドシフトを示すことが確認されている。従って、バンドシフト量の測定によって、タンパク質分子 1 個あたりの反応性チオール基の数を直接求めることが出来る。
タンパク質のシステインチオール基の翻訳後修飾は、単なる酸化ストレス応答に限らず、種々のシグナル伝達系に関与しており、その反応の多様性や、感受性の高さからセリンやチロシンのリン酸化以上に重要なシグナルである可能性が示唆されている。また、最近注目されている反応性硫黄分子の関与も確認されており、今後システインチオールを含む硫黄を中心とした生理機能の解明が大きな研究の流れを作り出すものと予想される。
今回紹介した DNA-mal を用いた解析法は、タンパク質内のシステインチオール基がどの程度修飾を受けているかを簡便に解析できる有用な技術であり、またビオチンスイッチ法などで用いられている修飾チオールへの選択的ラベル化法と組み合わせることにより、タンパク質がどのような修飾を受けているか、そしてそれはどの程度なのかなど、より詳細なチオール解析への応用も可能である。今後、本手法がタンパク質チオール解析法として実用化され、硫黄を中心とした生体内シグナル伝達解明の一翼を担うことを期待したい。
▲ページのトップへ
参考文献
S. Hara, T. Nojima, K. Seio, M. Yoshida and T. Hisabori, Biochim. Biophys. Acta., 2013, 1830, 3077.
|




