 |
| トップページ > 蛋白質のレドックス状態の可視化方法の開発 |
 |
||||||||||||||||||||||||||||||
蛋白質のレドックス状態の可視化方法の開発
|
||||||||||||||||||||||||||||||
 |
原 怜 東京工業大学 資源化学研究所附属資源循環研究施設 特任助教 |
 |
久堀 徹 東京工業大学 資源化学研究所附属資源循環研究施設 教授 |
Abstract
Redox status of the redox responsive proteins are critical factors to assess their functions. Especially the thiol residue is one of the most reactive side chain in the protein that is subject to change in cellular redox states. A convenient visualization system for the redox state of protein thiol group serves as a useful tool to know the situation of the protein of interest. For the purpose, several chemical modifiers such as AMS and PEG-maleimide were applied to date. After modification of thiols in the protein by these chemicals, the number of the free thiols can be detected as a mobility shift using SDS-PAGE. However, these chemicals showed several disadvantages such as small mobility shift to investigate larger proteins, or non-uniformity after the modification to determine the number of the labeled thiols. To overcome these disadvantages of the conventional chemical modification methods, we developed a new thiol modifier, DNA-maleimide. The advantages of this chemical is discussed.
1. はじめに
1964 年に Laurent らは、デオキシヌクレオチド還元酵素の研究の過程で、この酵素が基質のヌクレオチドを還元するときに重要な役割を持っている小さな蛋白質を発見し、チオレドキシン(チオールの酸化還元に関わる蛋白質の意)と命名した 1)。その後の研究により、チオレドキシンは、生物界に普遍的に存在する蛋白質であることがわかってきた。チオレドキシンは、分子量 12,000 くらい、分子内に 2 つのシステインを含むよく保存された配列である WCGPC を持った蛋白質で、4 本のαヘリックスと 5 本のβストランドで構成される特徴的な構造を持っている 2) 。
1970 年代後半に、アメリカの Buchanan らのグループが、高等植物の葉緑体にやはりチオレドキシンが存在すること、および、特に葉緑体で行われる光合成の炭酸同化反応を触媒する酵素のいくつかの活性が、チオレドキシンによって酸化還元制御を受けていることを発見した 3)。光合成では、光エネルギーをまずクロロフィル分子が吸収し、葉緑体チラコイド膜に存在する 2 つの光化学反応中心にエネルギーを集約してこれを励起することで水から NADP+ までの電子伝達を駆動し、還元物質である NADPH を生産する。この電子伝達反応の際にチラコイド膜のストロマ側からルーメン側に輸送されるプロトンによって形成されるチラコイド膜内外のプロトン駆動力を利用して、ATP を合成する。この一連の反応は、「明反応」と呼ばれる。一方、これらの反応によって合成された NADPH と ATP は、葉緑体のストロマで働くカルビン回路で二酸化炭素を同化する際に用いられ、糖が合成される。この糖を合成する反応は純粋に酵素反応であり、光の有無に依存しないと考えられたため「暗反応」と呼ばれた。ところが、葉緑体のチオレドキシンが光合成の電子伝達系から還元力を受け取り、これによって炭酸同化系の酵素群が活性化されていることが明らかになり、カルビン回路は明所で働くことが明らかになった。このため、暗反応という呼び方はあまり使われなくなった。ともあれ、炭酸同化に関わる複雑な反応過程を担う酵素のうち、グリセルアルデヒド 3- リン酸デヒドロゲナーゼ(GAPDH)、フルクトース 1,6- ビスホスファターゼ(FBPase)、セドヘプツロース 1,7- ビスホスファターゼ(SBPase)、ホスホリブロキナーゼ(PRK)の 4 種類は、チオレドキシンによって酵素分子が還元されることで活性化する、いわゆる「チオール酵素」である。これらの酵素は、いずれも分子内に酸化還元応答するひと組以上のチオール基を持っており、これが酸化されてジスルフィド結合を形成した場合に、酵素活性が低下、ないし、失活することが知られている 4)。
葉緑体の ATP 合成酵素は、ミトコンドリアの ATP 合成酵素や細菌細胞膜に存在する ATP 合成酵素と基本的に同じ分子構造を持った複合体蛋白質である。1997 年にこの酵素は中心軸のγと呼ばれるサブユニットが触媒反応の過程で一方向に回転することが明らかになり、もっとも単純な構造をした分子モーター蛋白質として知られている 5, 6)。すでに、酵素自身は発見されてから 60 年を経過し、生化学的にも非常によく研究されている。葉緑体 ATP 合成酵素は、ミトコンドリアや細菌由来の ATP 合成酵素とは異なり、単離精製しても ATP 加水分解活性を示さない。ところが、葉緑体の ATP 合成酵素は、dithiothreitol(DTT)のようなチオール還元試薬で処理すると、高い活性を示すようになる。この活性調節に関わっているのは、やはり酵素分子内に存在するジスルフィド結合であり、この結合を形成する二つのシステインは回転する軸部分であるγサブユニットにある 7)。すなわち、 ATP 合成酵素は、その部品の蛋白質分子が還元されたり、酸化されたりすることによって、回転したりしなかったりを調節できる巧妙な分子モーターというわけである 8)。
葉緑体には、もうひとつ、グルコース 6- リン酸デヒドロゲナーゼ(G6PDH)というユニークなチオール酵素がある。この酵素は、フルクトース 1,6- ビスリン酸から分岐して、酸化的ペントースリン酸回路に代謝系をつなぐ重要な酵素である。この酵素も酸化還元で活性が変化するスイッチを持っているが、この酵素はこれまで述べてきた葉緑体の酵素とは異なり、酸化されたときに活性型、還元されると不活性型になる。つまり、他のチオール酵素とは逆の制御を受けている 9)。
葉緑体では、光があたると内部が還元型になり、炭酸同化系の酵素群が活性化して炭酸同化反応が行われるわけだが、夜になるとこれらの酵素は酸化され反応は停止する。また、光合成の電子伝達系が停止すると、NADPH も供給されなくなる。 NADPH は細胞内で還元力としてさまざまな代謝系に使われているため、これが供給されない夜間は不都合が起こる可能性がある。しかし、ペントースリン酸回路も NADPH の供給をする重要な役割を担っているため、夜間、光合成の電子伝達系が動いていないときには、この回路が積極的に働くことで NADPH を供給するわけだ。
この例でもわかるように、蛋白質の酸化還元を直接反映するチオール基による酵素の酸化還元制御は、基質や生産物、補因子による制御とともに、酵素機能の制御システムとして非常に重要である。
2.植物細胞内レドックスの重要性:チオレドキシンアフィニティークロマトグラフィー
私たちのグループが、高等植物を材料として酸化還元蛋白質の研究を始めたのは、1997 年頃のことである。当時は、前節に記したように、植物の葉緑体で重要なチオール酵素がいくつか発見されており、これを仲介するチオレドキシンの重要性が認識され始めた時期でもあった。チオレドキシンは、それ自身が 2 つのシステインのチオール基を持っており、標的となる蛋白質(こちらはジスルフィド結合を持っている)との間で、ジチオール−ジスルフィド交換反応を行い、結果的にチオレドキシンは酸化型に、標的蛋白質が還元型になる。この交換反応の過程で、まず、チオレドキシンが持つ 2 つのチオール基の一方が標的蛋白質のジスルフィド結合と反応して、分子間ジスルフィド結合を形成する。次に、チオレドキシンのもうひとつのチオール基がこの分子間ジスルフィド結合を求核攻撃して、チオレドキシン側にジスルフィド結合が移り、標的蛋白質の方はジチオール型、すなわち還元型になる。細胞内には、システイン残基を持った蛋白質は多数あるし、特に光合成生物の場合には、水の分解によって発生する酸素が常に細胞内に存在するので、これらシステインは酸化ストレスにいつも曝されていることになる。従って、葉緑体内には酸化されている蛋白質が多数あると考えられたが、先にも述べたようにそれまでに明らかにされていたチオレドキシンの標的酵素は驚くほど少なかった(図 1)。
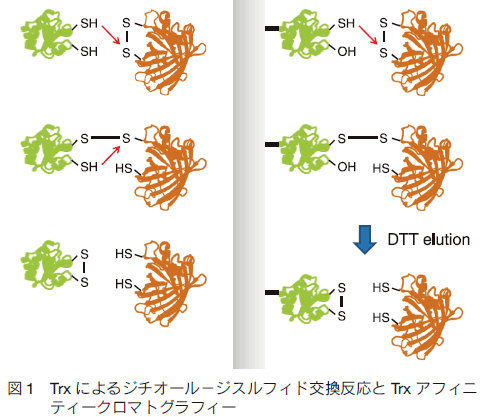
そこで、最初に私たちが行った研究は、チオレドキシンの標的を積極的に探索することであった。方法としては、チオレドキシンそのものを捕捉担体として用いるクロマトグラフィーを考案した 10)。すなわち、チオレドキシンが持っている二つのシステインの一方をセリンに置換し、この変異型チオレドキシンが標的蛋白質のジスルフィド結合と反応した時に、そこで反応が停止するようにした。このような変異型チオレドキシンをクロマトグラフィー担体に固定することで、チオレドキシンの標的となり得る蛋白質だけが、チオレドキシンを介して担体に捕捉されるものと予想したのである。反応後は、塩や界面活性剤で担体をよく洗浄して非特異的に吸着しているであろう蛋白質を洗い落とし、最後にジチオスレイトールなどを用いて分子間ジスルフィド結合を還元すれば、チオレドキシンの潜在的な標的蛋白質が網羅的に回収できる、と考えたわけである。
実際、葉緑体から調製した可溶性蛋白質画分を標的蛋白質群として上記のような実験を行ってみると、予想通り、さまざまな蛋白質が捕捉されることがわかった 11)。この実験を行っていた当時は、まだ高等植物の全ゲノムの解析が行われる前だったので、捕捉された蛋白質を SDS ゲル電気泳動で分離し、それぞれの蛋白質の N 末端アミノ酸配列をひとつずつ解析するという古典的な方法で、どのような蛋白質が捕捉されたのかを調べた。その結果、それまで葉緑体チオレドキシンの標的蛋白質として報告されていたチオール酵素以外に、複数の新規の蛋白質を得ることに成功した。そして、私たちがこの方法を論文発表した翌年から、数多くの研究者が同様の方法をさまざまな生物種やオルガネラを標的として同様の研究を実施した。ちょうど、生物の全ゲノム情報が充実し始めた時期でもあり、蛋白質の同定技術の進歩の助けもあって、チオレドキシン標的蛋白質候補の数は、爆発的に増加した。例えば、高等植物の葉緑体の場合は、私たちが 1997 年に研究を開始した当時、10 種類しか報告がなかったチオール酵素は、現在では葉緑体の中におそらく 300 種類、植物全体で 400 種類の蛋白質がチオレドキシンと相互作用する可能性があると記されている 12)(表 1)。

このようなプロテオミクス解析の進展を強力にサポートしたのが、質量分析法の著しい進歩である。質量分析法自体は、1990 年代から実用化されていたが、当初は蛋白質のような巨大分子について正確な分子量を得ることが難しかったし、試料の取扱いも難しく、分析機器も高価で誰もが利用できる環境にはなかった。しかし、2002 年にノーベル化学賞を受賞した MALDI TOF MS 法が急速に進歩し、高分子量の蛋白質の分子量を簡便な方法で正確に分子量決定できるようになった。さらに、2000 年に高等植物では先駆けとなるシロイヌナズナの全ゲノムが解読され、ペプチドマスフィンガープリント法(PMF 法)によって簡単に蛋白質の同定を行うことが可能になった。このような技術とデータベースの発達で、これまでわかっていなかった蛋白質の翻訳後修飾についても数多くの知見がもたらされた。特に、システイン残基については、それまで酸化でジスルフィド結合を組むことくらいしかわかっていなかったが、グルタチオンが結合するグルタチオン化、NO によって修飾を受ける S- ニトロソ化、強酸化によって起こるスルフェン化やスルフィン化など、さまざまな修飾が起こっていることがわかってきた(図 2)。

3.ペルオキシレドキシンと蛋白質の酸化還元
ペルオキシレドキシン(Prx)は、1988 年 Sue Goo Rhee らによって、酵素を酸化から守る機能を持った蛋白質として発見された 13)。その後、Prx は分子が持っている還元型のチオール基が、標的のジスルフィド結合やスルフェン基、あるいは過酸化水素などの過酸化物を還元する機能を持つ抗酸化ストレス蛋白質であることがわかった。また、反応に関与するチオール基の数の違いによって、1-Cys 型、2-Cys 型、Atypical 2-Cys 型、および、Q 型に分類されること、生体内に非常に量の多い(場合によっては、総蛋白質の数%)蛋白質であることも明らかになってきた 14)。そして、Prx は、チオレドキシンやグルタレドキシンといった酸化還元蛋白質から還元力の供給を受けて、標的の還元を行っていることがわかってきた。以前から知られているアスコルビン酸ペルオキシダーゼやグルタチオンペルオキシダーゼなどとの大きな違いは、ペルオキシダーゼに比べて代謝回転速度が著しく遅いことである。一方で、過酸化物に対する Km はペルオキシレドキシンの方がはるかに小さい。すなわち、ペルオキシダーゼがざっと掃除を済ませた後に、ペルオキシレドキシンが丁寧にホコリを拭き取る役割を担っている、というイメージである。このペルオキシレドキシンは、チオレドキシンやグルタレドキシンから還元力を受け取って働き、過酸化物と反応して自身が酸化されると、再びチオレドキシンなどの還元力を供給する蛋白質、あるいは、還元物質によって還元状態に戻ることが知られている。
従って、このようなレドックス蛋白質は、細胞内で常に還元型と酸化型の間で動的平衡状態にあると考えられる。すなわち、これらレドックス蛋白質の細胞内での動態を明らかにするためには、そのチオール基の数を定量してチオール基の酸化還元状態を調べることが必要である。そのために、以前は、5,5’-dithiobis(2- nitrobenzoic acid)(DTNB)を用いた比色定量法 15) や、monobromobimane(mBBr)を用いた蛍光の変化量の測定 16, 17) がよく用いられていた。しかし、これらの方法は、いわば系の中の平均値を求めるので、定量した値が必ずしも整数では得られず、分子中のシステインの状態を正確に記述することが難しかった。
4.新規マレイミド試薬開発の必要性
1997 年に、小林と伊藤らは、大腸菌ペリプラズムの蛋白質の酸化還元を制御しているレドックス蛋白質 DsbA の研究において、チオール修飾試薬で還元型蛋白質を修飾すると、標識されていない蛋白質と異なる電気泳動移動度を示すことを報告した 18)。この研究に用いられたチオール修飾試薬は、4-acetamido-4’-maleimidylstilbene-2,2’-disulfonate というもので、通常 AMS と呼ばれる。 AMS の分子量はおよそ 500 なので、ジスルフィド結合が還元された蛋白質は、AMS 修飾によって分子量が約 1000 増加する。従って、SDS ゲル電気泳動によって、AMS 修飾した蛋白質と修飾しなかった蛋白質を比較すると、移動度に差が現れる。チオール基が酸化されてジスルフィド結合を形成している場合には、AMS では修飾されないので、両者のこの差を利用して、酸化状態の蛋白質と還元状態の蛋白質を電気泳動上で簡単に見分けることができるわけだ(図 3)。

この方法の利点は、測定したい系の中にある蛋白質の一部分だけが還元状態であっても、これを電気泳動ゲル上ではバンドとして検出できる点で、前章で紹介した DTNB による定量法に比べるとずっと感度がよい。チオールの定量法の場合には、平均値でしか得られないので、例えば系の中にある蛋白質の 10% が酸化状態にある場合には、得られる定量結果の値が若干小さくなるだけで、それが実験誤差によるものなのか、蛋白質の不均一な酸化の結果なのか見分けることが難しい。 AMS 修飾の場合には、10% の蛋白質だけを異なるバンドとして得ることが可能である。
しかし、AMS 修飾法にも欠点がある。最大の問題は、修飾による分子量変化がひとつのシステインあたりわずか 500 なので、分子量の大きな蛋白質の場合には、電気泳動によって充分な移動度の変化が見られないことがある点である。この問題を解決する手段として、分子量の大きなポリエチレングリコールにマレイミド基を導入した通称 PEG マレイミドが用いられている。特に、分子量 5000 程度のポリエチレングリコールがよく用いられるので、分子量 10 万近い大きな蛋白質でも標識によって電気泳動上の移動度の変化を可視化することが可能である 19)。ところが、PEG マレイミドにも欠点がある。それは、標識した分子の与える電気泳動のバンドがきれいに収束せず広がりを持ってしまうこと、および、標識による移動量が必ずしも PEG の付加によって与えられる分子量に一致しないことである。前者の問題の原因は、おそらく PEG の分子構成によるところが大きい。 PEG は工業的に高分子合成(いわゆるリビング重合法)によって作られるため、得られる PEG 分子は一定の分子量の前後に幅をもった異なる分子量の集団である。このため、分子量の異なる PEG が蛋白質に付加されることになり、得られる蛋白質 +PEG の分子量もある程度の幅を持つことになるわけだ。
一方、標識された分子の移動度が PEG で加算された分子量に合致しない、という問題は得られる標識蛋白質の性質の問題といえる。 AMS の場合には、修飾によって変化する分子量が小さく、また、修飾に用いられた AMS 分子の影響も無視できる範囲であった。ところが、PEG の場合には、分子量の変化量が、時には 1 万、場合によっては数万にもなる。現在、一般に行われている SDS ゲル電気泳動法の場合、2 アミノ酸あたり 1 分子のドデシル硫酸が結合するために、直鎖状に延びたポリペプチド鎖の単位長さあたりの負電荷が同じになり、分子の電気泳動度は分子の大きさによって規定されている。ところが、PEG 分子が結合した場合には、PEG 部分にはドデシル硫酸が結合できないため、電気泳動のルールがそのままでは適用できないわけだ。その結果、電気泳動のバンドの移動度から、単純に PEG マレイミドで修飾されたチオール基の数を見積もることができない。
5. DNA マレイミドとその応用
生体内の蛋白質の酸化還元状態の重要性を考えると、特に、チオール基(システイン残基)のレドックスを簡便に知ることができれば、さまざまな情報が得られるに違いない。ところが、前章で述べたように、チオール修飾試薬には、さまざまな問題点があった。そこで、数年前から私たちの研究室では、AMS や PEG マレイミドなどの従来のチオール試薬に代わる有用なチオール試薬を開発することを目指して研究を行ってきた。
さまざまな高分子の適用を考えたが、どれも標識化合物として使用できる量の問題、その化学的性質の問題などで、なかなか決定打が見つからなかった。そんなときに、卒業生の野島達也氏が最近行っている研究の話をしてくれて、蛋白質を自由自在に配列させるためのアンカーとして、蛋白質に DNA を結合させたところ、電気泳動で分子の移動度がきれいに変化したという話を教えてくれた。今から 3 年ほど前のことである。これは我々の目的にも使えるぞ、ということで、早速、DNA の末端にチオール修飾試薬であるマレイミドを結合させた新規修飾試薬を設計した。
チオール修飾で標識したタンパク質に十分な移動度変化を与えることと、DNA を用いた修飾化合物をエタノール沈殿で精製が可能であることを前提条件として分子サイズを検討し、修飾化合物に用いる一本鎖 DNA の鎖長を 24 塩基に決定した。DNA の塩基配列は、特に分子内および分子間で相補鎖を形成しないことに留意してデザインした。また、一本鎖 DNA の 5’末端にはアミノ基を導入しておき、このアミノ基をマレイミド導入の足掛かりにした。そして、アミノ基に特異的に結合する NHS とマレイミドを分子の両端に持つ分子架橋化合物と DNA を反応させた後、陰イオン交換クロマトグラフィーとエタノール沈殿によって目的とするマレイミドを導入した DNA 分子を得ることに成功した。筆者らは、この標識化合物を DNA マレイミドと命名した。次に、合成した DNA マレイミドで、実際にさまざまな蛋白質を修飾してみた。その結果、修飾された蛋白質は、予想通り、SDS ゲル電気泳動をした際に AMS よりも大きな移動度の変化を与え、また、PEG マレイミドよりも収束した蛋白質バンドを確認することができた。DNA マレイミドで修飾された蛋白質に DNAse を作用させると、電気泳動上の蛋白質の分子量は、未修飾のものにほぼ近い所まで減少したので、蛋白質に結合した DNA は本来の構造を保っているものと予想される。さらに、得られた移動度変化は、チオール基 1 つあたり、すなわち蛋白質に結合した DNA 鎖一本あたり約 9300 相当でほぼ一定の値になった。このことから、修飾後のタンパク質の移動度変化、すなわち、見かけの分子量を、SDS ゲル電気泳動によって測定することで、対象とする修飾以前の蛋白質上でいくつのチオール基が還元型であったのか数えることが可能になる。これまで、3 節に記載した以外の方法で蛋白質上の酸化還元に関わるチオール基の数を数えるためには、あらかじめシステイン残基の数を変えた変異体を組み換え体蛋白質として作成しマーカーとして用いる方法や、質量分析による解析を行うなどの必要があった。しかし、今回、私たちが開発した DNA マレイミドを用いれば、修飾による移動度変化が目的蛋白質の分子量に関係なく蛋白質に結合した DNA の数によって一定の値を与えるので、簡便に蛋白質上のフリーのチオール基の数を決定することができる 20)(図 4)(図 5)。


一方で、DNA マレイミドにも大きな欠点がある。それは、PEG マレイミドでも共通に見られる問題であるが、DNA や PEG など比較的大きな分子を蛋白質に結合させるため、修飾された蛋白質をウェスタンブロッティング法に供すると、ゲルから PVDF 膜への転写効率が著しく低下してしまうという点である。ウェスタンブロッティング法では、一般に、分子量の小さな蛋白質よりも大きな蛋白質の方が膜への転写効率が悪いことは知られているが、DNA や PEG を数多く蛋白質に付加することで、ゲルからの移動が物理的に困難になるのかも知れない。しかし、修飾前と修飾後の蛋白質の転写効率が異なると、電気泳動で酸化型と還元型を定量的に分離できるというマレイミド試薬のメリットを活かすことができない(図 6)。
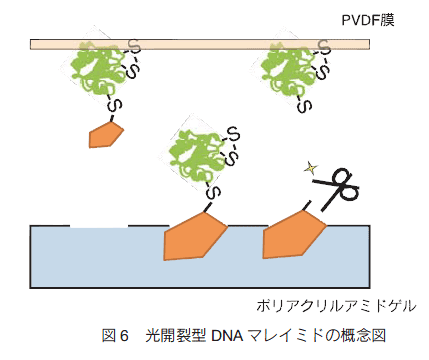
この問題に対応するために、私たちは、DNA マレイミドにさらに改良を加えて修飾によって電気泳動時の移動度を変化させる性質を保ったまま、転写効率の落ちない新型 DNA マレイミドを開発した。ウェスタンブロッティング法における転写効率の低下の原因は、明らかに DNA という大きな分子が蛋白質に結合していることそのものによって起こると考えられた。そこで、修飾によって蛋白質に結合させた DNA 分子を、SDS ゲル電気泳動後にゲル中で切り離すことにした。蛋白質から外してしまえば、その後の転写効率の低下は起こらないと考えたわけである。このような用時対応型の機能を付加するために、DNA 部分とマレイミド基の間に紫外線照射によって切断される官能基を導入することにした。私たちは、この新しい機能を付加した DNA マレイミドを、光開裂型(PhotoCleavable)という意味で、DNA-PC マレイミドと命名した。DNA-PC マレイミドは、基本設計は DNA マレイミドと同じで、蛋白質修飾と通常の SDS ゲル電気泳動では、DNA マレイミドと同条件で用いることができる。また、通常の室内光の条件下で使用する限りは、実験中に DNA 部分が切り取られることはない。しかし、電気泳動のゲル中にあっても、通常の UV トランスイルミネーターで照射を行うと、ゲル中で容易に DNA 部分が被修飾蛋白質から切り離されることを確認した。また、実際に DNA-PC マレイミドで修飾した蛋白質を試料としてウェスタンブロッティングを行ってみたところ、予想通りに紫外線照射に依存して、得られるシグナルの強度が回復していた。移動度は DNA マレイミドで標識したものと変わらないので、チオール基の数を数えることも可能である。こうして、巨大分子を蛋白質のフリーのチオール基に特異的に結合させて電気泳動によって結合数を識別する方法は、ウェスタンブロッティング法と併用できるようになった。このことによって、例えば、目的蛋白質を識別可能な抗体を持っていれば、細胞内の特定の蛋白質の酸化還元状態や、それが持つチオール基のうち何個が翻訳後修飾を受けているかを簡単にモニターすることが可能になった。今後、DNA マレイミドによる修飾法をペプチドマッピング法や高感度の質量分析装置と併用することによって、蛋白質分子内チオールの状態の可視化が、ますます簡便になるものと予想される。
6.終わりに
私たちが今回開発した DNA マレイミド、および、DNA-PC マレイミドは、蛋白質上のフリーのチオール基修飾試薬として、特に巨大分子のチオール基のレドックス状態や、過酸化、グルタチオン修飾などの翻訳後修飾の状態観察に有効なツールといえる。しかも、SDS ゲル電気泳動だけで、レドックス状態だけでなくその割合も算出することができる優れたツールである。
DNA を結合したマレイミド試薬は、蛋白質に結合した後でも DNA しての機能を損なっていないと予想される。このため、用いる DNA の塩基配列を工夫することで、DNA のハイブリダイゼーションを利用した新たなアプリケーションに展開できる可能性がある。さらに、紫外線によって光開裂する機能を利用すれば、その応用の幅はさらに広がるであろう。
| 関連製品 | メーカーコード |
| -SulfoBiotics- Protein Redox State Monitoring Kit | SB11 |
| -SulfoBiotics- Protein Redox State Monitoring Kit Plus | SB12 |
| 著者プロフィール | |
| 氏名 | 原 怜(Satoshi Hara) |
|---|---|
| 所属・職位 | 東京工業大学資源化学研究所附属資源循環研究施設 特任助教 |
| 連絡先 | 〒226-8503 横浜市緑区長津田 4259 TEL : 045-924-5267 FAX : 045-924-5268 |
| hara.s.ab@m.titech.ac.jp | |
| 出身大学 | 東京工業大学 |
| 学位 | 理学博士 |
| 専門分野 | 生化学、分子生物学、蛋白質科学 |
| 氏名 | 久堀 徹(Toru Hisabori) |
|---|---|
| 所属・職位 | 東京工業大学資源化学研究所附属資源循環研究施設 教授 |
| 連絡先 | 〒226-8503 横浜市緑区長津田 4259 TE L: 045-924-5234 FAX : 045-924-5268 |
| thisabor@res.titech.ac.jp | |
| 出身大学 | 早稲田大学 |
| 学位 | 理学博士 |
| 専門分野 | 植物生化学、生体エネルギー変換 |
| Copyright(c) 1996-2014 DOJINDO LABORATORIES, ALL Rights Reserved. |