遺伝子導入試薬
HilyMax (ハイリーマックス) |
同仁品コード:H357
1ml ¥20,000-(本体価格) |
|
 |
|

 |
  
−Rat primary corical neurons への導入事例−
→こちら(PDF)からもご覧いただけます。

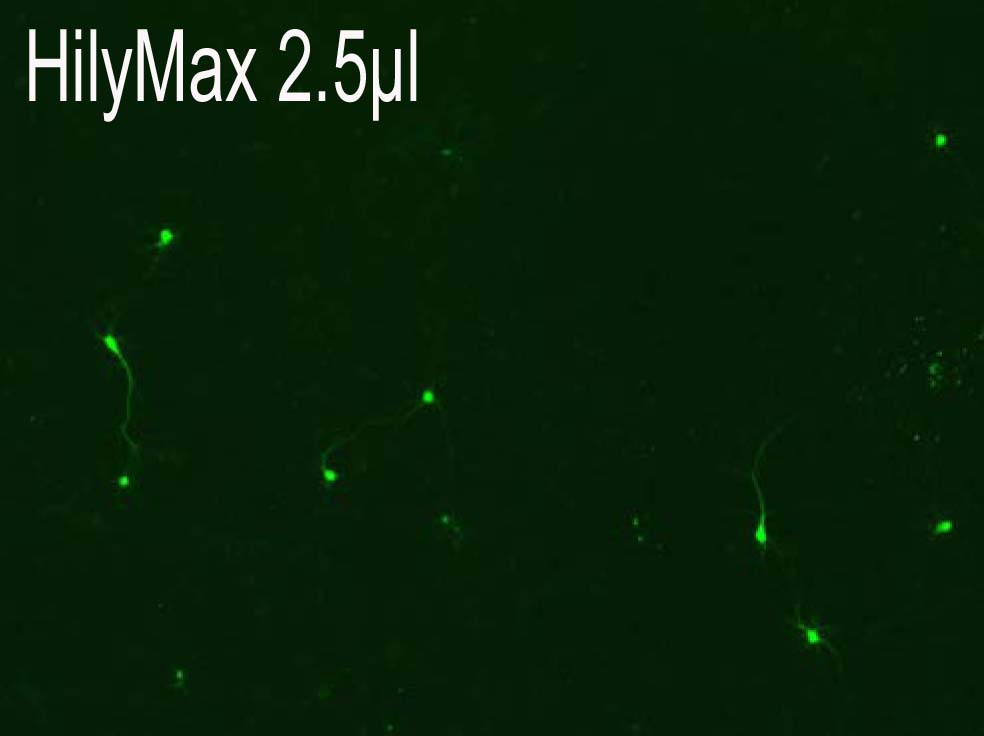 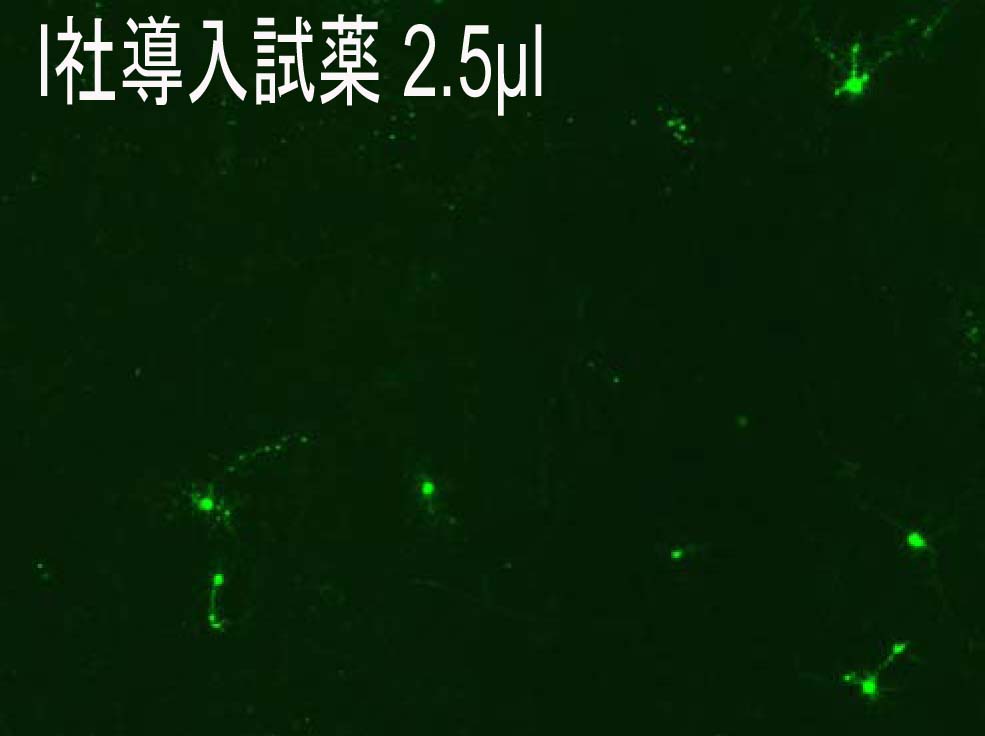


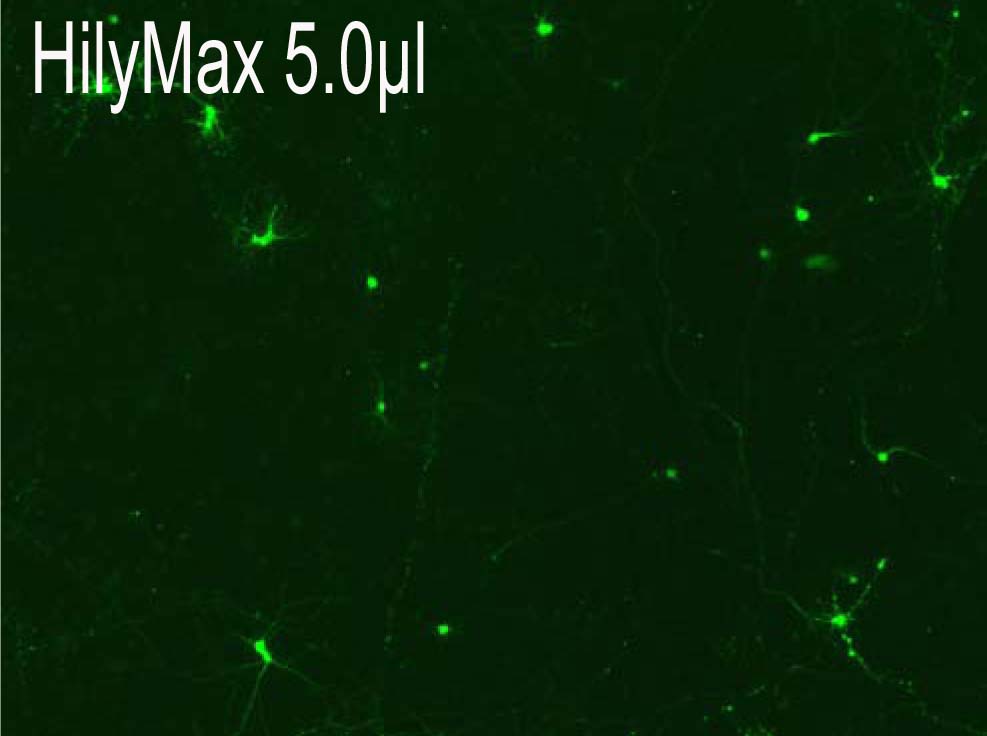 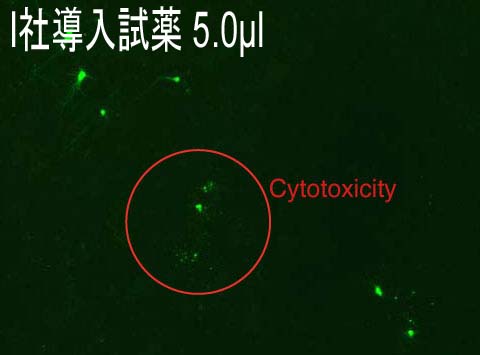
(データ提供:Johns Hopkins University, Dr. Minori Koga)
Culture Condition
・Cell : Rat primary corical neurons, 100,000 cells/well
・Media :
Media A; Neurobasal Media (500uL) + B-27(10uL) + 0.5mM Glutamine (1.25uL)
Media B; Neurobasal Media (500uL) + B-27(10uL) + 0.5mM Glutamine (1.25uL) + pen/strep (5uL)
・Microplate : 24-well plate
Transfection Condition
・Vector :Conventional expression promoter driven EGFP
・Reagent : HilyMax or Company I
・Ratio : (Reagent):(Plasmid) = (2.5):(1.5)→(5.0):(1.5)
・DNA-HilyMax複合体の調製用培地 : Neurobasal Media
Neurobasal Media(25μl)+plasmid, Neurobasal Media(25μl)+Reagent
→それぞれをNeurobasal Mediaに混和、5分間馴染ませた後に混合し、20分インキュベーションする。
・遺伝子導入後の培地交換 : 有(3時間後)
<導入手順>
1. Primary Neuron Cellを24-Well plateにて培養([Media-B]を使用)
2. [Medium-B]を300μl取り除き、[Media-A]を250μl添加し、Total 450μlとする。
(このとき取り除いた[Media-B]は後から使用するので捨てない→[Media-B'] とする)
3. ReagentとPlasmidの混合物 50μlを添加し、インキュベーションする。
4. 3時間後、Mediaを交換する。
(交換用Media : [Media-B] + [Media-B'] を1:1で混合したものを使用する)
5. 48時間後にイメージングを行う。
|
 
−ショウジョウバエ細胞(S2 cell)における導入事例−
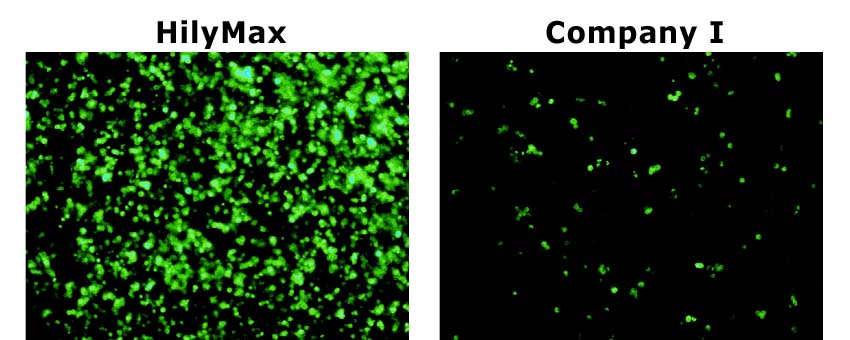
(データ提供:Max Planck Institute of Neurobiology, Dr. Takashi Suzuki)
Culture Condition
・Cell : S2(Schneider 2) cell, 200,000 cells/well
・Media : Schneider's Drosophila medium with 10% FCS
・Antibiotics : 50 units Penicillin/ml, 20 μg Streptomycin/ml
・Microplate : 24-well plate
Transfection Condition
・Vector : 1 μg/well [ pAct Gal4(6 kb), pUAS-mCD8::GFP(10 kb) ]
・Reagent : 5 μl/well
・DNA-HilyMax複合体の調製用培地(添加剤) : Schneider's Drosophila medium(without seum
and antibiotics)
・遺伝子導入後の培地交換 : 有(4時間後)
*培地交換を行っていただくことで、導入効率の向上が認められます。
|
 
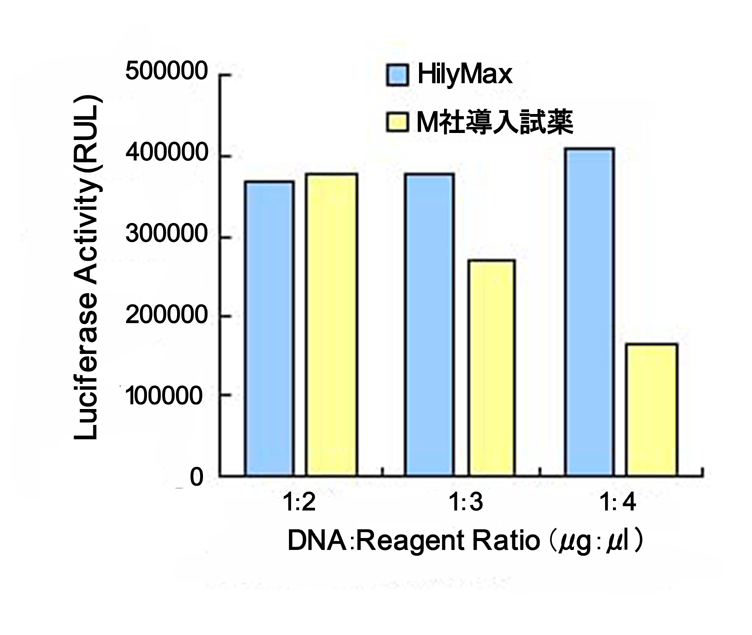
細胞内へ導入した遺伝子は、一般的に導入操作のみによってタンパクを発現するが、薬物刺激に対して発現する場合もある。
一例として、IL-8プロモーターを組込んだルシフェラーゼ発現プラスミドをA549細胞に導入した場合、HilyMaxで導入した場合と、
他社品で導入した場合とでは、以下のチャートに示す差が観察された。
|
|
刺激なし |
TNF-α添加 |
TNF-α、
Dexamethasone添加 |
| HilyMax |
Luciferase活性(RLU) |
835 |
10313 |
1753 |
| シグナル応答 |
|
12.4倍↑ |
83%↓ |
| 他社品 |
Luciferase活性(RLU) |
12053 |
20890 |
12334 |
| シグナル応答 |
|
1.7倍↑ |
41%↓ |
他社品では、刺激を加える前(刺激なし)からルシフェラーゼが発現している。これをTNF-α刺激するとシグナル応答が増加するが、TNF-α刺激により発現したIL-8の増加量よりも、
ルシフェラーゼ発現量が少ない1) 。一方、HilyMaxで導入を行うと、刺激なしではルシフェラーゼ発現量が少ない。これをTNF-αで刺激することにより、IL-8発現量に相関した
シグナル応答がでてくる1) 。
したがって、HilyMaxはシグナル応答をより明確に測定できることが分かる。一方、他社品の導入試薬は、GFP安定発現するHT1080細胞へ導入試薬のみ
添加すると、試薬濃度依存的にGFP発現量が増加することが確認されている2) 。
1) H. Takei, Y. Baba, A. Hisatsune, H. Katsuki, T. Miyata, K. Yokomizo,
and Y. Isohama, Glycyrrhizin Inhibits Interleukin-8 Production and Nuclear
Factor-κB Activity in Lung Epithelial Cells, but Not Through Gluco- corticoid
Receptors, J Pharmacol Sci., 2008, 106, 460-468.
2) T. Tagami, K. Hirose, J. M. Barichello, T. Ishida, and H. Kiwada, Global
Gene Expression Pro?ling in Cultured Cells Is Strongly Influenced by Treatment
with siRNA-Cationic Liposome Complexes, Pharmaceutical Research, 2008, 25, 11.
|

 |
 
−siRNA用の導入試薬としても使用可能−
|
|
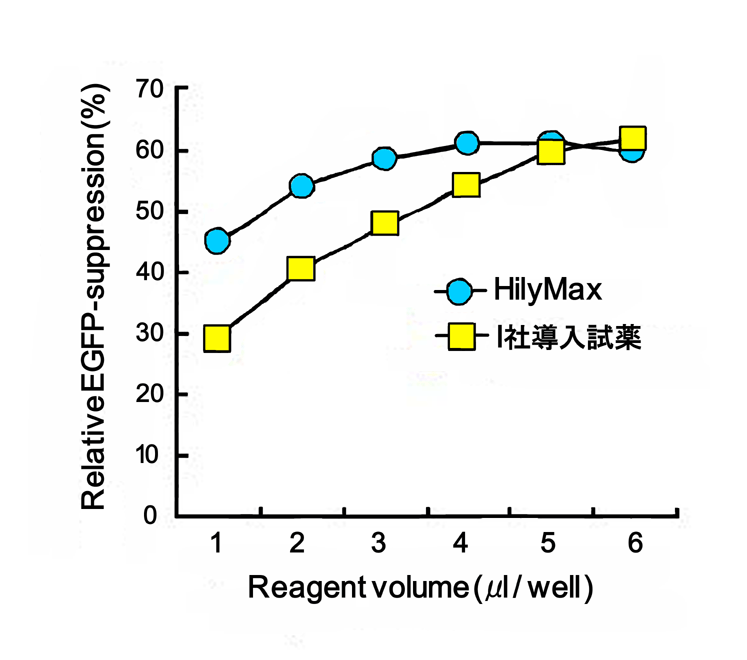 |
24-wellプレートにてEGFPを発現している細胞に対し、HilyMaxを用いてGFP siRNAを血清存在下でトランスフェクションした。24時間後にフローサイトメトリーにてEGFPのノックダウン率を測定した。
(データ提供:福岡県工業技術センター 生物食品研究所 楠本賢一先生)
|
【HilyMaxによるsiRNA導入マニュアル】
siRNAとプラスミドを同時に導入するコトランスフェクションが可能です。
詳細なプロトコルではありませんが、下記PDFファイルに導入例を示します。
ご検討の上、ご使用ください。
 siRNA導入プロトコル siRNA導入プロトコル
|
 |
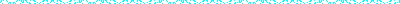
 
−汎用されている市販の導入試薬と同等かそれ以上の導入効率−
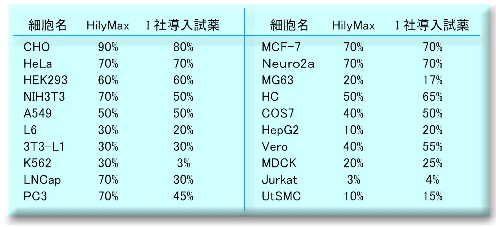
−初代培養細胞、血球系細胞での高効率遺伝子導入−
初代培養細胞(COV)への遺伝子導入 血球系細胞(DT40)への遺伝子導入
COV(ニワトリ卵巣由来)細胞およびDT40(ニワトリB細胞由来)細胞にpGL3 vectorを血清存在下で遺伝子導入し、
24時間後にLuciferase活性を測定した。
(データ提供:就実大学薬学部生物薬学科分子細胞薬学ユニット)

|
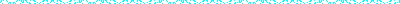 |
−汎用されている細胞へのGFP導入例−
CHO cell HEK293 cell A549
cell

 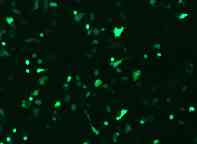
HeLa cell NIH3T3 cell
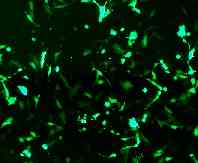
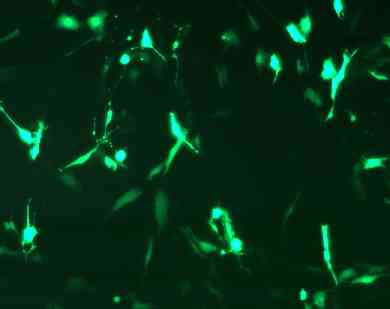 |
 
ワンチューブによるシンプルプロトコール
遺伝子導入前の培地交換が不要

|
|
 
*下記ダウンロードファイルはPDFになっております。
HilyMax標準プロトコル(日本語)
HilyMax standerd protocol (English)
|
|
 
−多岐にわたる細胞への導入実績−
*導入条件の詳細は、細胞名をクリックしてください。(一部細胞を除く)
導入条件一覧
 使用論文一覧 使用論文一覧
数字-B C-G
H-J
K-M
N-P
Q-
| 細胞名 |
由来 |
細胞種毎プロトコル |
導入実績例 |
使用論文 |
| 293 |
ヒト 腎臓 |
|
 |
|
| 293T |
ヒト 胎児腎臓 |
|
 |
|
| 3T3-L1 |
マウス |
|
|
|
| A172 |
ヒト グリア芽腫 |
|
|
|
| A549 |
ヒト 肺上皮癌 |

 |
 |
・J, Pharmacol. Sci., 2010, 113(1), 76.
・Clin. Exp. Allergy, 2009, 39(10), 1508.
・J. Parmacol. Sci., 2008, 106(3), 460. |
| adrenal chromaffin cells |
ウシ副腎髄質細胞 |
|
|
・Neuropharmacology, 2010, 58(7), 1097 |
| AGS |
ヒト 胃上皮 |
|
|
|
| ASPC1 |
ヒト 膵臓 |
|
 |
|
| B16 |
マウスメラノーマ |
|
|
・Biosci. Biotechnol. Biochem, 2010, 74(11), 2253. |
| BAEC |
ウシ大動脈内皮細胞 |
|
|
・生体医工学, 2009, 47(6), 595.
・Biochem. Biophys. Res. Commun., 2007, 361(1), 243. |
| BmN |
カイコ 卵巣 |
|
 |
|
| bovine fibroblast cell |
ウシ線維芽 |
|
|
<siRNA>・J. Reprod. Dev., 2010, 56(1), 60. |
| C2C12 |
マウス 骨芽 |
|
|
・Neuron, 2011, 69(2), 215.
・J. Biol. Chem., 2011, 286(48), 41455. |
| Caco2 |
ヒト 腸管上皮 |

 |
 |
・Mol. Genet. Metab., 2011, 102(1), 91. |
| CEF |
ニワトリ 胚 |
|
 |
|
| CHO |
チャイニーズハムスター 卵巣 |

 |
 |
・Autophagy., 2008, 4(1), 131. |
| CHO-S |
チャイニーズハムスター 卵巣(浮遊) |
|
 |
|
| COS1 |
アフリカミドリサル 腎臓 |
|
|
|
| COS7 |
アフリカミドリサル 腎臓 |

 |
 |
・J. Biol. Chem., 2010, 285(22), 16967. |
| COV |
ニワトリ 卵巣 |
|
|
|
| DLD-1 |
ヒト結腸腺癌 |
|
|
・Clin. Cancer. Res., 2010, 16(8), 2320. |
| DT40 |
ニワトリ 血球・リンパ系 |
|
|
|
| DU145 |
ヒト 前立腺癌細胞 |
|
 |
|
| ECPC4 |
脳脈絡叢癌 |
|
 |
|
| EF/CT-1 |
|
|
|
<siRNA>・Endocrinology, 2010, 151 (12), 5873. |
| END-D |
マウス 血管内皮 |
|
 |
|
| GH3 |
ラット下垂体癌 |
|
|
J. Biol. Chem., 2012, 288, 1706. |
| ESCs E14 |
マウス ES細胞 |
|
|
|
| H1395 |
ヒト 肺癌 |
|
|
|
| H4IIE |
ラット肝癌 |
|
|
・J. Health Sci., 2011, 57(3), 264. |
| HaCaT |
ヒト 皮膚角化細胞 |
|
 |
・J. Biol. Chem., 2011, 286(39), 34121.
<siRNA>・Mol. Cell. Biol., 2010, 30(7), 1689. |
| HC |
ヒト 胎児肝臓 |
|
|
|
| HCT116 p53 |
ヒト結腸腺癌 |
|
|
・Nucleic Acids Res, 2011, 39(1), 76.
・Mol. Cell. Biol., 2008, 28(21),6557. |
| HEK293 |
ヒト 胎児腎臓 |
  |
 |
・Biol. Pharm. Bull., 2012, 35(2), 380.
・Biochem. Biophys. Res. Commun., 2012, 421(2), 329.
・J. Biol. Chem., 2010, 285(29), 22542.
・J. Biol. Chem., 2010, 285(9), 6522.
・Development, 2010, 137(11), 1875.
・Development, 2010, 137(6), 923.
・J. Biochem., 2009, 145 (4), 437. |
| HEK293FT |
ヒト 胎児腎細胞 |
|
 |
|
| HEK293T |
ヒト 胎児腎細胞 |
|
 |
・J. Virol., 2012, 86 (7), 3851.
・Neuron, 2011, 69(2), 215.
・J. Biol. Chem., 2010, 285(22), 16967.
・PLoS One, 2010, 5(2), e9081.
・Biol. Pharm. Bull., 2010, 33(5), 784.
・J. Biol. Chem, 2010, 285(6), 3568.
・Genes to Cells, 2008, 13(6), 593.
・Biochem. J., 2008, 410, 513.
<siRNA>・Genes. Cells, 2011, 16(7),748. |
| HeLa |
ヒト 子宮頚癌 |

 |
 |
・PLoS One, 2011, 6(4), e18638.
・Biochem. J., 2009, 425, 445.
・Biochim. Biophysi. Acta, 2010, 1802(9),749.
・Biol. Pharm. Bull., 2008, 31(12), 2334.
・Ann. Hematol., 2008, 87(1), 19.
・J. Biol. Chem., 2007, 282(50), 36671.
<siRNA>・FEBS Letters, 2010, 584(16), 3550. |
| HeLaS3 |
ヒト 肝臓, 胆嚢 |
|
 |
|
| HepG2 |
ヒト 肝臓 胆嚢 |

 |
 |
・Nucleic Acids Res., 2011, 39(1), 76.
・Cell Death Dis., 2011, 2, e177.
・PloS One, 2008, 3(12), e4068 |
| HFL-1 |
ヒト 胎児 肺 |
|
 |
|
| HHSteC |
ヒト 肝星細胞 |
|
 |
|
| HSG |
ヒト顎下腺細胞 |
|
|
<siRNA>・Biosci. Rep., 2011, 31(1), 57. |
| HT29 |
ヒト 結腸癌 |
|
 |
・Ann., Hematol., 2008, 87(1), 19. |
| HUVEC |
ヒト臍帯静脈内皮細胞 |
|
|
・Biochem. Biophys. Res. Commun., 2012, 418(4), 641. |
| Human hepatic Stellate |
ヒト 肝臓 |
|
 |
|
| JHH-4 |
ヒト 肝臓, 胆嚢癌 |
|
 |
|
| Jurkat |
ヒト 白血病性T細胞 |
|
|
|
| K562 |
ヒト 血球・リンパ系 |

 |
 |
|
| KINGS1 |
ヒト グリア細胞 |
|
|
|
| L |
マウス 線維芽 |
|
 |
|
| L6 |
ラット 筋組織 |

 |
 |
|
| L929 |
ラット 繊維芽 |
|
|
|
| LMHl |
ニワトリ 肝臓癌 |
|
 |
|
| LNCap |
ヒト 前立腺癌 |

 |
 |
|
| MC3T3-E1 |
マウス 骨芽細胞 |
|
 |
|
| MCAS |
ヒト 卵巣癌 |
|
 |
・Ann. Hematol., 2008, 87(1),19. |
| MCF7 |
ヒト 哺乳器 |

 |
 |
・PLoS One, 2011, 6(11), e27441.
・Mol. Pharmacol., 2010, 78(5), 855.
・Cancer Sci., 2009, 100(10), 1834.
・Carcinogenesis, 2008, 29 (9), 1837. |
| Mesenchymal cell |
ヒト 間葉系幹 |
|
|
|
| MDCK |
イヌ 腎臓 |

 |
 |
|
| MEF |
マウス 胎児由来線維芽細胞 |
|
 |
|
| MG63 |
ヒト 骨肉種 |
|
|
|
| MKN |
ヒト 胃 |
|
|
|
| NB1 |
ヒト 神経芽細胞腫 |
|
|
|
| NCI-H295R |
ヒト 副腎腫瘍 |
|
|
|
| Neuro2a |
マウス 神経系 |

 |
 |
|
| NHLF |
ヒト正常肺線維芽 |
|
|
<siRNA>・J. Biol. Chem., 2011, 286(37),31932. |
| NIH3T3 |
マウス 胎仔 |

 |
 |
・Sci. Rep., 2011, 1, 15.
・J. Biol. Chem., 2010, 285(29), 22114.
<siRNA>・Nucl. Acids Res., 2012, 40(19), 9482. |
| PA-1 |
ヒト テラトカルシノーマ |
|
|
|
| PanC1 |
ヒト 膵臓癌 |
|
 |
|
| PC12 |
ラット 副腎髄質 |

 |
 |
|
| PC3 |
ヒト 前立腺癌 |

 |
 |
|
| REF |
ラット初代線維芽細胞 |
|
|
・Oncogene, 2011, 30(26), 2912. |
| ROS 17/2.8 |
ラット骨芽細胞様細胞 |
|
|
・J. Biol. Chem., 2009, 284(37), 25230. |
| Primary Osteoblast |
初代骨芽細胞 |
|
 |
|
| RBL2H3 |
ラット 血球・リンパ系 |
|
|
|
| Sf9 |
ヤトウガ |
|
|
|
| SHSY-5Y |
ヒト 神経芽 |
|
 |
|
| T98G |
ヒト 脳グリオブラストーマ |
|
|
|
| THP-1 |
ヒト単球性白血病 |
|
|
<siRNA>・J. Immunol., 2009, 182(9), 5823. |
| Tn5 |
昆虫細胞 |
|
|
・J. Biol. Chem., 2010, 285(6), 3625. |
| U937 |
ヒト 単球性白血球 |

 |
 |
|
| UtSMC |
ヒト 子宮平滑筋 |
|
|
|
| Vero |
アフリカミドリザル 腎臓 |

 |
 |
|
| VSMC |
ラット 血管平滑筋 |
|
 |
|
| マウス胎児海馬初代培養細胞 |
マウス 胎児海馬 |
|
 |
|
| 耳下腺腺房細胞初代培養 |
耳下腺腺房細胞 |
|
 |
|
|
|
















