 |
| トップページ > がんターゲティングのためのナノメディスン |
 |
||||||||||||||||
がんターゲティングのためのナノメディスン
Cancer chemotherapy has serious drawback with its poor cell specificity. Polymer-based nano-medicine will be one of the most promising strategies to access this issue. In this strategy, many researches have focused on how we can accumulate nanomedicines in tumor selectively. Probably the most versatile and important strategies for this purpose is “enhanced permeability and retention effect (EPR effect)”. The effect based on enhanced extravasation of huge molecules in tumor neovasculature. As an additional effect, cancer specific ligand-receptor interaction (so-called active targeting) is also available to enhance the binding ability of nano-medicine to cancer cells. Although these strategies realize significant drug accumulation in tumor comparing with small drug administration, greater amount of nano-medicine may still distribute to other normal organs. In this context, Stimuli-responsive polymers have been applied to enhance the contrast of drug concentration between tumor and normal cells. In this review, recent progress of cancer DDS materials using stimuli-responsive strategy is reviewed. Future direction for ideal cancer nano-medicine is also considered.
1. はじめにがんは、糖尿病合併症などと並んで、深刻な疾患である。罹患数が多いにもかかわらず、早期発見と外科的処置が可能な場合を除いて、有効な治療法も確立していない。それ以外の治療法では、例えば、放射線療法、免疫療法があり、さらには放射線療法と免疫療法の組み合わせでの有効性が指摘されている。これは、放射線療法で崩壊したがん細胞が免疫提示効率を上げるなどの効果によるものと考えられる。これらの方法はある種のがんでは効果がみられているものの、がんが免疫の低下に関係する疾患であることに加え、制御性 T 細胞などががんを免疫から保護しているなど、難しい問題が多く、すべてのがんで必ずしも顕著な効果を挙げているとは言えない。一方、これとは別に薬物を用いる化学療法がある。もし、薬物でがんを治癒できれば理想的であるが、実際には、これも一部のがんを除き有効とは言い難いのが現状である。特に、化学療法において問題になるのは、重篤な副作用である。制癌剤の多くは増殖活性の高いがん細胞を殺傷するためのものであり、これが他の増殖性の正常組織にも強い副作用を生じさせてしまう。期待された分子標的薬も、単一遺伝子の異常で起こる場合には良いが、多段階発癌などの場合にはがんそのものの不均一性のために効果が一定でなかったり、結局他の正常臓器に副作用がみられたりする。また、反復投与により耐性が獲得されることも、大きな問題の一つである。これらの問題を克服するには、投与量を可能な限り減らすことと、そのうえで効果を維持するために、がんへの薬物分布を可能な限り大きくすることが重要である。 これらを可能にする試みとして、高分子量材料を用いる種々のナノメディスンが注目され、世界的に多くの研究がなされている。 ここではそれらの戦略と材料についてまとめてみた。 2. パッシブターゲティングとアクティブターゲティング薬物投与量を減らしつつ、がんに対する有効濃度をあげるには、薬物をコンテナに濃縮し、これをがんにより多く分布するようにすることが基本となる。このために、ナノ粒子を基本とする非常に多くのドラッグキャリヤーが開発されている。これらナノ粒子をよりがんに集積させるための戦略として、最も基本となるのががん新生血管における透過性向上と、がん周辺でのリンパ管未発達の状態を利用する EPR 効果である 1)。がん新生血管では、通常の血管に比べ内皮細胞の構築が不完全で、通常では漏出しない高分子量物質が血管外に漏出する。さらにがん部は慢性炎症を起こしていることが多く、これによる血管透過性向上も引き起こされている。さらに、急増組織であり老廃物を除去するリンパの構築も不完全であるため、漏出した巨大分子ががん部に滞留しやすくなっている(図 1)。そこで、通常血管では漏出しないナノ粒子を血中に安定に循環させることができれば、結果としてナノ粒子はがん部に集積する。これがパッシブターゲティングで、ナノメディスンを用いるがんターゲティングのほとんどすべてが、何らかの形でこの効果を用いており、最も重要な戦略である。たしかに、この効果を有効に利用することは制癌剤の投与量の削減と副作用の軽減を可能とする。最も有効にこの効果を利用するためには、ナノ粒子の大きさは、腎排泄を抑えるため 10 nm 以上、脾臓などのマクロファージや肝臓のクッパー細胞などに捕捉されないために、200 nm 以下である必要がある。また、十分な EPR 効果が得られるまである程度長時間安定に血中を循環する必要がある。 片岡らの高分子ミセルを用いるナノキャリヤーがその代表例であり、疎水コアに制癌剤や遺伝子を内包でき、外側の PEG 鎖からなるシェルで補体や血清アルブミンなどの血液成分との相互作用を回避し、安定に血中を循環できる。ブロック共重合体を精密に設計することで、粒径を厳密に制御でき、粒径によるがんへの集積と、がん組織内部への浸透を調べている。その結果、例えば EPR 効果が出にくい膵臓がんなどでは、粒径を 30 nm と小さくすることで、集積と組織内浸透を劇的に改善できると報告している 2)。 ただ、EPR 効果によってがん組織に濃縮されるナノ粒子は投与量の数%であることに注意を要する。すなわち、残りの 95% は標的以外の組織や臓器に分布する可能性がある。そこで、さらにナノ粒子のがん部への集積コントラストを向上させるために、正常細胞に比べがん細胞表面や、がん血管で特に発現が亢進している分子に対する特異的リガンドをナノ粒子に導入し、その特異的相互作用を利用するアクティブターゲティングがしばしば組み合わされる(図 1)。リガンドとしては、葉酸、フェリチン、インテグリンに対する RGD ペプチド、グルタミンなど、種々の分子が利用される。ただし、この場合、がん部への漏出はあくまで EPR 効果で決まるのであり、特異リガンドがナノ粒子のがん部への漏出を加速するわけではない。特異相互作用に基づくがん組織へのナノキャリヤーの滞留性が向上され、結果として見かけ上のコントラストが上がったようにみえるということになる。特定のがんでは一定の効果を与えるが、実際のがん組織は、不均一な細胞群からなり、これらの標的分子の発現レベルは均一ではなく、しかも、がんのステージによっても変化するので、現実のがんに対して期待されるほどの効果を与えない場合も多い。  3.がん細胞特異的に薬物を蓄積させる戦略 上述したように、EPR 効果はナノメディスンのがん部へのターゲティングの基本的戦略である。また、リガンドの利用は、EPR 効果を補足する一般的戦略として、広く研究されてきた。しかしながら、これらの戦略だけでは、薬物をがん細胞へ十分蓄積させつつ、正常細胞(組織)への分配を副作用を回避できるまでに抑制することは困難である。この問題の解決策としては、EPR 効果で蓄積してきたナノキャリヤー中の薬物を積極的にがん細胞に短時間で蓄積あるいは放出させ、有効濃度を上げることである。  例えば、ナノ粒子に血中循環能を付与するために、しばしばナノ粒子表面を PEG 鎖で覆うが、PEG 鎖は EPR 効果によりがん部へ到達しても、がん細胞への取り込み効率が極めて低い。そこで、ポリ乳酸粒子表面を PEG 鎖でコーティングしたナノ粒子の PEG 末端にオリゴヒスチジンペプチドを介してビオチンを導入すると、弱塩基性のオリゴヒスチジンは、体内の pH 7.4 では中性であり、疎水性のため PEG 層に埋もれているが、がん組織周辺に達すると pH 低下によりプロトン化され、伸びきって PEG 層から外部に露出する。そのため連結していたビオチンも露出するので、ビオチン受容体を発現しているある種のがん細胞に結合し、エンドサイトーシスされる 3)。同じく、 pH 変化を利用するものとして、バクテリオロドプシン C へリックス由来のペプチドを同様にナノ粒子表面に修飾したものも報告されている 4)。この場合では、 pH 低下に伴いペプチドが細胞膜透過性を有するα-へリックスを形成して粒子の細胞への取り込みを加速する。これらに対し、がん組織近傍の MMP 活性を利用する方法としては、オリゴアルギニンなどの細胞膜透過性のカチオン性ペプチドを特定の MMP で切断できる基質配列を介してアニオン性のオリゴアスパラギン酸と連結したペプチドをリポソームなどの表面に導入したものがある 5)。正常細胞近傍では、膜透過ペプチドがアニオン性配列と結合しマスクされているが、がん近傍では基質配列が切断されてオリゴアスパラギン酸が切除されて細胞に取り込まれやすくなる。これとよく似た方法として、リポソームによく似た多機能性エンベロープ型ナノ構造体(MEND)を用いる方法がある 6)。 MEND は遺伝子とプロタミン誘導体などからなる核を膜脂質でコートし、表面にリガンドを配したナノ粒子であるが、表面は血中循環のため PEG で覆われている。ここで、PEG は脂質分子に連結しているが、両者のリンカーに MMP の基質配列を導入しておくと、がん細胞近傍でだけ PEG 鎖が切断され、細胞への取り込みが促進される。  このような物理刺激は、ナノメディスンががん部にのみ集積している場合には良いが、例えば、がんが臓器内に散在している場合には困難である。 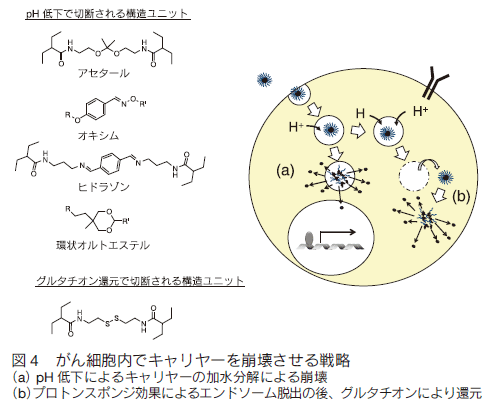 このような方法論は、近年、EPR 効果を補強し、がん細胞への特異性を高めるものとして注目され極めて多くの研究が報告されているが、そのほとんどは、ナノメディスンがエンドサイトーシスにより取り込まれ、後期エンドソームに移行する過程で起こる pH の低下、あるいは、細胞内に高濃度に存在するグルタチオンによる還元を利用するものである。 pH の低下により切断される官能基としては、オキシム 12)、ヒドラゾン 13)、アセタール 14)、環状オルトエステル 15)などが報告されており、これらのユニットで高分子型キャリヤ―の主鎖を連結したり、薬物をキャリヤーに連結したりすると、エンドソーム内で薬物放出が加速される。また、ブロック共重合体ミセル型キャリヤーのコア部分にカルボン酸を配し、これにシスプラチン型の薬物を配位させておくと、pH 低下により薬剤が後期エンドソームが存在する核近傍で放出され、薬剤耐性を有するがんでも効果が得られると報告されている 16)。還元反応を利用するものは、ジスルフィド結合を利用するのが一般的である。高分子鎖に組み込んだり、粒子内の架橋点として導入することで、粒子を安定化して薬剤放出を抑制しておき、細胞内のグルタチオンでジスルフィドが還元されて切断されることに伴い薬剤の放出が加速される仕組みである 17)。 4. がん細胞特異的なトロイの木馬 前述のトロイの木馬は、がん細胞への特異性は EPR 効果を含む既存の手法で確保し、あくまで細胞内で薬物放出を加速する仕組みを加えたものであり、がん細胞以外の細胞に取り込まれた場合にも同様のことが起こってしまう。一方、もし、細胞内での薬物放出ががん細胞に特異的な刺激で起これば、正常細胞では薬物の急激な放出は起こりえず、理想的なトロイの木馬となる。ただ、そのような原理を実現するには、がん細胞で極めてコントラストよく存在する刺激が必要である。がん細胞と正常細胞を比較する場合、最もコントラストよく異なる部分は、細胞の情報プロセシングの部分、すなわち、細胞内情報伝達系である。なぜなら、この部分の異常ががんの直接原因であるからである。なかでも、多くのがんで普遍的に異常活性化しており、しかも、正常細胞ではその活性がほとんど見られないいくつかの酵素がある。プロテインキナーゼ Cα(PKCα) は、未分化細胞で用いられる酵素であり、生体内では活性が高いのは血球幹細胞くらいであるが、多くのがん細胞で悪性度に比例して活性が亢進する酵素である。PKCαは、がんの増殖活性維持、転移時の細胞の浸潤、 P 糖タンパクなどを介する薬剤耐性の維持に必須の酵素であり、この酵素活性と予後の悪さが明確に相関することが知られている。また、近年、肺がんなどを用いて、がん幹細胞の必須酵素であることもわかっており、重要な薬物ターゲットとみなされている 19)。従ってPKCαを、がん細胞を識別する刺激に使えば、がん細胞でのみ薬物を放出できると考えられる。この場合、通常の化学療法では、がん組織中の比較的分化の進んだ悪性度の低い細胞ほど効果があるのに対し、PKCα を薬物放出刺激として用いると、悪性度の高い細胞ほど効果が出ることが期待でき、これまでの化学療法にはない大きなメリットとなることが考えられる。特にがん幹細胞を効率よく殺傷できれば大きな意味がある。  このキャリヤーは標的酵素でリン酸化、あるいは切断される特異基質を総荷電がプラスになるように設計しておいて、高分子に複数個側鎖として担持したものである。それにより、キャリヤーは、治療用遺伝子とポリイオン錯体となりナノ粒子を形成する。この際、この種のペプチド−高分子コンジュゲートは、高効率に遺伝子を抑制できるため、標的酵素活性が低い、あるいは、キナーゼの場合、一時的に活性化するのみ(この場合は、活性が収まれば直ちにホスファターゼが脱リン酸化を起こす)の正常細胞では遺伝子を開放しないが、標的酵素が持続的に活性化している疾患細胞では、基質部分がリン酸化されることに伴う負荷電の導入、あるいはプロテアーゼでは、カチオン部位の切除が生じ、ポリイオン錯体が崩壊することで、疾患細胞内でのみ遺伝子を活性化できる。この原理を使ってこれまでにプロテインキナーゼ A、Src、I-κ-キナーゼ、Akt、HIVキナーゼ、コクサッキーウイルスプロテアーゼ、カスパーゼなど種々の酵素に応答するシステムを開発してきた 20)。これらは、疾患細胞特異的な刺激を用いる真のトロイの木馬システムである。ただ、この原理を PKCα に適用するには、PKCα 特異的な基質ペプチドが必要である。しかし、PKC は 10 種類のサブファミリーがあり、α 以外のサブタイプは種々の組織で働いている。これらの基質アミノ酸配列は、いずれも似通ったコンセンサス配列を持っており、ペプチド基質では、α 特異基質を設計することは不可能とされていた。そこで、1000 種以上のライブラリを設計しスクリーニングしたところ、PKCα に特異性の高い基質を見出すことに成功した 21)。さらに、この基質をポリアクリルアミド型高分子主鎖に担持したキャリヤーを合成し、ルシフェラーゼ遺伝子と複合体化したところ、予想通りがん組織内投与で発現がみられる一方、正常組織では発現を抑制することに成功した 22)。この遺伝子発現は、基質ペプチド内のリン酸化部位であるセリン残基をアラニン残基にかえると消失することから、確かに PKCα によるリン酸化によるものと考えられた。ただし、この遺伝子発現の上昇は高々 10 倍であり、正常組織での発現を完全に抑制すると発現量が低くなる欠点があった。そこで、高分子主鎖をポリエチレンイミンにしたキャリヤーを設計合成したところ、リン酸化に伴う遺伝子発現亢進が 150 倍に改善された 23)。これは、遺伝子とキャリヤーの複合体が細胞に取り込まれた後、ポリエチレンイミン主鎖のプロトンスポンジ効果で、複合体のエンドソーム脱出能が向上したことに基づくものである。さらに最近、これに疎水基を導入してやると、遺伝子活性化効率を 400 倍にまで改善させることに成功している 24)。カスパーゼ- 8 遺伝子を用いた担癌マウスにおけるがん治療を検討したところ、顕著に増殖を抑制し、肺転移も抑制できることが明らかになった。ただし、このナノ粒子複合体は、腫瘍内投与では効果を発揮するが、血中投与すると複合体が血液成分と相互作用して崩壊してしまう問題があったが、最近、我々はこれを回避する新しい方法の開発に成功した。 5. おわりにがんを標的としたナノメディスンに関して、がんに特異性を発揮させるための方法論と、それを可能にするキャリヤーの実際を紹介した。現実のがんは、単一遺伝子の異常による白血病などの一部を除き、極めて多様性の高い疾患であり、また、同一のがん組織中でも非常に不均一な細胞集団から構成されている。従って、これらに対し逐一有効な薬剤、あるいは薬剤カクテルを開発し、さらに、どの薬剤が個々のがんに有効であるかを的確に判断していくことは非常に難易度の高い課題である。一方、もしがんに薬剤を特異的に運べれば、すでに断念された薬剤が投与可能となり、経済的にも有利である。そのため極めて多くのナノメディスンが研究されてきたが、がん部への蓄積に限界があり、しかも、固形がんでも多くの微小がんとして偏在したり転移したりするものには適用が難しく、実際には、壁細胞などの存在により EPR 効果が得られないものも存在する。これらの問題を解決するには、さらなる蓄積効率を実現する全く新規な原理か、5% の蓄積率を容認して副作用を回避させる新たな DDS 戦略が必要である。 |
||||||||||||||||
|
||||||||||||||||
| Copyright(c) 1996-2014 DOJINDO LABORATORIES, ALL Rights Reserved. |
