 |
| �@ �g�b�v�y�[�W > ���^���p�N���@�\��͂̂��߂̌����\����͐헪 |
 |
||||||||||||||||
�A��
|
||||||||||||||||
| ���^���p�N���@�\��͂̂��߂̌����\����͐헪 �g��@�M�� ���Ɍ�����w��w�@ |
1�D �͂��߂�
�@���^���p�N���̋@�\��͂́A�����㐶���Ȋw�̒��S�ɂȂ�ƍl������s�R�o�C�I���W�[�̐��i�ɕs���ł���B�{�A�ڂł́A���̒m���x�̒Ⴂ�u�s�R�o�C�I���W�[�v�̊T�O�ƌ�����܂��Љ�A���̂����Ƃ��d�v�ȉۑ�ł��閌�^���p�N���̋@�\��͂̂��߁A�����\����͂������ɏd�v�ł��邩���A���ጤ�����Љ�Ȃ���l�@����B���ɖ��^���p�N���������y�ь����\����͐헪�̌���ɂ��ĊT�����A����̓W�]���l�@����B
2. �@�s�R�o�C�I���W�[
�@�@�u�������ۂ̓^���p�N���̋쓮���鉻�w�����ł���B�v�ƌ�����B�i�����ł́u���w�v�͕����w�Ɖ��w�̋��E�����ł��Ă��錻����l���������̂ł���B�Ⴆ�A�������ɉ����鑾�z���̎�e���u���w�����v�Ɋ܂߂Ă���B�j���������āA�������ۂ̉𖾂Ƃ̓^���p�N���̋@�\�����w�����Ƃ��ĂƂ炦��i���w�̌���ŋL�q����j���Ƃł���ƌ�����B���̂��߂ɂ��} 1 �̂悤�Ƀ^���p�N���̋@�\���S���\������e���q�̈ʒu�������\����͂ɂ��A���w�����������q�ԂɌ`������Ă��鉻�w�����̐U�������w�i�ԊO�A���}�������j��͂ɂ�茈�肷��K�v������B���̂悤�ɂ��Ăǂ̂悤�ȉ��w�������������q���@�\���S��Ԃɂǂ̂悤�ɔz�u����Ă��邩�����肷��B����ɁA�^���p�N���͋@�\���S�̍\����ω������邱�Ƃɂ���ĉ��w�������쓮����B���������āA��q�̋@�\���S�̈ʒu�Ɖ��w�������̎��ԕω���ǐՂ��邱�Ƃ��^���p�N���̋@�\�����w�����Ƃ��ĂƂ炦��i���w�̌��t�ŋL�q����j���߂ɕK�v�ł���B�U�������w�I��͂ɂ�蓾��ꂽ���w�����̐U�����ɂ��ƂÂ��āA���w���������� 10-12 m�i�s�R���[�g���j��荂���x�Ō��肷�邱�Ƃ��ł���B���w�������͂��̂悤�ɔ����Ȍ��������̈Ⴂ�ɑ傫���e�������B�����ł��̂悤�ɂ��āA�s�R���[�g���̐��x�ł̋@�\���S�̍\���̎��ԕω��ɂ��ƂÂ��ă^���p�N���̋@�\���𖾂��邱�Ƃɂ�萶�����ۂ����w�̌��t�ŋL�q���邱�Ƃ��s�R�o�C�I���W�[�Ɩ�������Ă���B
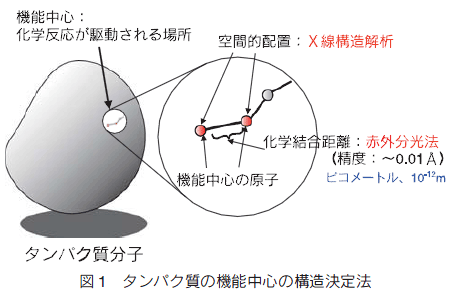
�@���q�̈ʒu���͌��ݍł����x�̍����^���p�N�� X �������\����͂ɂ���Ă� 0.1�� �i10-11 m�j���x�̐��x���������Ȃ��B�������A�����\����͖@�ɂ�茴���I�ɂ́A�^���p�N�����\������S�Ă̋K���I�ɔz�u���ꂽ���q�� 3 �����I�ʒu�����肷�邱�Ƃ��ł���B�������A�^���p�N���̂悤�ȋ��啪�q�̊e���q�̈ʒu����q�̂悤�ȐU�������w�I���x�Ō��肷�邱�Ƃ͌����I�ɂ͕s�\�ł���A�e���q�̉��w�������������\����͂������狁�߂邱�Ƃ͔��ɍ���ł���B����A�U�������w�I���@�̐��x�͉��w�������̉�͂ɏ\���ł��邪�A 3 �����I������I�Ɋ܂܂�Ă��Ȃ��B���������āA�^���p�N���̂悤�ɋ���œ���̑����̉��w�������܂ދ��啪�q�ł́A���o���ꂽ�U�������^���p�N�����̂ǂ̉��w�����ɗR�����邩�肷�邱�Ƃ͂قƂ�Ǖs�\�ł���B���̂悤�ɁA�����\����͖@�ƐU�������@�͑���I�ł���A�s�R�o�C�I���W�[�̗��ւƂ�����B
�@�@�\���S�ɐF�f���q���܂܂�Ă���ꍇ�͋����}�������@�ɂ��A���ٓI�ɂ��̋@�\���S�̐U������������x�œ�����B�זE�̐����ɕs���ȑ����̃^���p�N���͋����C�I������z��������X�̉��������@�\���S�Ɏ����Ă��邽�߁A�����}�������@�͔����@�\�̗����ɑ傫����^���Ă����B�������A�@�\���S�ɂ͉��z���������Ȃ��A�~�m�_�c����z��������������ێ����A���̋@�\�������邽�߂ɏd�v�Ȗ����������Ă���A�����}�������@�ɂ����E������B���̂悤�ȃA�~�m�_�̋@�\��͂ɂ͐ԊO�����@���s���ł���B
�@����̃A�~�m�_�̐ԊO�������́A�����I�ɂ͖��זE��`�q�����n���\�z���A���ʓ��ٓI���ʑ̕W���@�ɂ�蓾����B�������A���ݖ��זE�����n�\�z�͎�ɏ��^�̐��n���^���p�N���ɂ����K�p����Ă��炸�A�����[���@�\���������̃T�u���j�b�g�ō\�����ꂽ���^���p�N���Ɋւ���͂Ȃ��B�����̒���I�Ȏ��݂͂Ȃ���Ă��邪 1�j �A���ʁA�Č����Ƃ��ɂ܂����ǂ̗]�n�͑傫���B����ɁA���ɏq�ׂ�悤�ɁA�ԊO�����w�I�����̃^���p�N���ւ̓K�p�Ɋւ�����_�����邽�߁A���^���p�N���̓��ʑ̕W���Z�p�̊J���͂��܂芈���ɍs���Ă���Ƃ͌����Ȃ��B
�@�^���p�N���͐��n�t���Ő����@�\������B����͖��^���p�N���ł����l�Ŗ��ђʌ^���^���p�N���͐��n�t���̃���������d�w�ɑg�ݍ��܂�ė��[�͐��n�t���ɁA�������͎��b�_���̌`������a���I���ɒu����邱�Ƃɂ����艻�����悤�v����Ă���B�����A���^���p�N���͗L�@�n�}���ł͋ɂ߂ĕs����ŕϐ����₷���B�������A���͋����ԊO�z���������ߐ��n�t�ɐԊO�����@��K�p���邱�Ƃ͕s�\�ł��邱�Ƃ͏펯�ł���B���������āA���ʓ��ٓI���ʑ̕W���@���傫���i�����Ă��A�ԊO�����w�I�@�\��͕͂s�\�ł���B����A�^���p�N�������ł̓^���p�N���O�̋ψ�n�}�n�ł͎������ɂ߂č���Ȕ��������`������Ă���A���ꂪ�^���p�N�������̃A�~�m�_�c��̉��w�I�����ɑ傫���e������Ɨ\�z�����B���ہA�Ⴆ�A�|�_�� pKa �l�͐��n�t���烁�^�m�[���ɗn�}���������邾���� 5 ���x�������邱�Ƃ��m���Ă��� 2�j �B�������A����܂ł� X ���\����͂ɂ���Ĉʒu�����肳�ꂽ�^���p�N�������̃A�~�m�_�c��̉��w�I�����͂��̎��ӂ̔������� X ���\�����猩�ς��邱�Ƃɂ�萄�肳��Ă������A�ԊO�����w�I�������s���ł��邱�Ƃ͌����܂ł��Ȃ��B
�@�@�\���S���\������A�~�m�_�c��̓^���p�N���O�Ől�דI�ɍ\�����邱�Ƃ�����Ȋ��ɒu����Ă���\���������B���������āA���̂悤�Ȋ��Ői�s���鉻�w�����������̉��w�̌�b�����ŋL�q���邱�Ƃ͕s�\�ł���\��������B���̂Ȃ�A�����̉��w�̓^���p�N���O�̋ψ�n�}�n�ł̒m���Ɋ�Â��č\�z����Ă��邩��ł���B���������āA�s�R�o�C�I���W�[�����̐��i�̂��߂ɂ͉��w�̌�b�𑝂₷�K�v������B�����Ő����w�Ɖ��w�Ƃ��Z������B���̗Z�����s�R�o�C�I���W�[�̏d�v�ȖڕW�̈�ƍl�����Ă���B
3�D �s�R�o�C�I���W�[�̐��i
�@�@�������ۂ��^���p�N���̋@�\�����w�����Ƃ��ĂƂ炦�邱�Ƃɂ��𖾂��邱�Ƃ�ڎw���s�R�o�C�I���W�[�͈ȉ��̂悤�ɂ��Đ��i�����B�ړI�Ƃ��鐶�����ۂ̋����I�Ȍ��ۉ�͂���o�����A���̌��ۂ��쓮���鑽���̃^���p�N����T���A���肷��B���ɂ�����P�����A�X�̃^���p�N���̋@�\����q�� 2 �̋Z�p�i�����\����͂ƐU�������w�I��́j�𗘗p���ĉ��w�����Ƃ��ĉ𖾂���B���̂悤�ɂ��ċ@�\���𖾂��ꂽ�X�̃^���p�N�����ǂ̂悤�ɂ��āA���̐������ۂ��쓮����V�X�e�����`�����邩����͂��邱�Ƃɂ�苐���I�ɉ�͂��ꂽ���ۂ̋@�\���𖾂��邱�Ƃ��ł���B�������ۂ����w�����Ƃ��ė�������i�s�R�o�C�I���W�[�j���߂ɂ͏�q�� 2 �̋Z�p�����ł͕s�\�ł���A���̂悤�Ȍ����S�̂��K�v�ł��邱�Ƃ������������B�����I�Ȍ��ۉ�͂���^���p�N���̓���P���܂ł��זE�����w�I�����A����Ȍ���\�������w�I�����Ƒ�ʂ��邱�Ƃ��ł���B����� 2 �̌����͂����̕��@���l�������傫���قȂ邽�߁A�ʏ�͕ʁX�̌����O���[�v�Ő��i����Ă���B���̌��ʃs�R�o�C�I���W�[�I���_�������Ό������A�זE�����w�I�����ɂ����Ă͑��ʂȌ��ۂɖڂ�D���Ă���炪�^���p�N���ɂ���ċ쓮����鉻�w�����ł��邱�Ƃ��Y����錋�ʁA�������ʂ̊w�p�I�Ӌ`�Â����s���ĂɂȂ�A���p�ւ̉\�������c�_����Ă��Ȃ����Ƃ������Ȃ�B����A�\�������w�I�������������ۂ̉𖾂�ڎw���Ƃ����s�R�o�C�I���W�[�������Ɠ��Y�����҂̎����Ă��鍂�x�ȋZ�p��K�p����̂ɓs���̂悢�^���p�N���������ΏۂƂ��đI������錋�ʁA�Z�p�I�ɂ͋ɂ߂č����x�ł͂��邪�A�����Ȋw�̐i���ɂ͂قƂ�ǖ𗧂��Ȃ��������ʂ��o���A���̕�����ŖJ�ߍ������S�������Ă��邾���ɂȂ肪���ł���B
�@�������Ȃ���A���ɍŋߐ��N�ŁA���ˌ��{�݂����E�I�Ɍ��Ă��������Ă��邱�Ƃɉ����� X ����͎����Z�p�� X �������\����͋Z�p���������i�����A��̑O�ɂ� X �������\����͂̓G�L�X�p�[�g�ɂ�����̓͂��Ȃ����̂ł��������A���݂ł́A�f�l�ł����Ƃ̓K�ȏ���������ΎQ���ł���悤�ɂȂ��Ă��Ă���B����́A X �������\����͕���̌����҂����̋Z�p�̐����Ȋw�̐i�W�ւ̍v���̉\����[���F�����A����Ƃł����̋Z�p�𗘗p�ł���悤����ȓw�͂��X�����Ă����i���݂����Ă���j���ʂł���A���� X �������\����͋Z�p�̊J���Ɍg����Ă��������҂̉Ȋw�ɑ���^���Ȏp���͓��M���ׂ����Ƃł���B���̂悤�ȏ̕ω��̌��ʁA�זE�����w����Ƃ��Ă��������O���[�v�� X �������\����͂����s���Đ��i���A�זE�����w�����O���[�v�Ŏ������ʂ����q���W�Ɋ�Â��čl�@����悤�Ȃ��Ƃ��������Ȃ��Ȃ��Ă��Ă���B
�@���̂悤�ɐ������ۂ��^���p�N���̋쓮���鉻�w�����Ƃ��ĂƂ炦��Ƃ����s�R�o�C�I���W�[�I�����͊m���ɐ���ɂȂ��Ă��Ă���B�������A��q�̒ʂ�ԊO������͂��^���p�N���ɓK�p�ł��Ȃ����Ƃɉ����āA�� 3 ����̕��ˌ��ɂ��ł��D�ꂽ X ���\����͖@���^���p�N�����쓮���锽���ߒ��ɔ����ω���ǐՂ���ɏ\���Ȏ��ԕ���\�������Ȃ��B����܂ł����E�G�@���A��������͂̎��݂͂��������A�����@�\��͂ɏ\���Ȏ��ԕ���\�ƍ\�����x�������@�͊J������Ă��Ȃ������B������ X ���\����͂͐����Ȋw�����҂ɂ͌��ʂĂʖ��ł������B���������āA��X�̕��@�Ŕ����ߒ��̒��ԑ̂��\�Ȍ��葽���ߑ��A�Œ肵�A���� X ���\�����甽���ߒ��𐄒肷�鑼�Ȃ������B�� 2 �̖����ł��Ȃ��� 3 ������ˌ��ݔ��ɂ�� X ���\����͂̌��_�́A���� X ���Ǝ˂ɂ��^���p�N���\���̑����ł���B���̑�����h�����ߕs���܂ɐZ�Ђ��������� 100K �ȉ��̒ቷ�œ������Ȃ���Ȃ�Ȃ��B�������A�ȉ��ɏq�ׂ�悤�ɂ��̂悤�ȏ����ő��肳�ꂽ�f�[�^�ł��A�_���Ҍ������^���p�N���̂悤�� X �����̍����ꍇ�́A X �����������S�ɏ������邱�Ƃ͔��ɍ���ł��� 3, 4�j �B
�@���������āA�s�R�o�C�I���W�[�i�^���p�N���̋@�\���S���\�����錴�q�̈ʒu�Ɖ��w�������̓��Y�^���p�N�����쓮���鉻�w�����ߒ��̐i�s�ɔ����ω���ǐՂ��邱�Ƃɂ���ă^���p�N���̋@�\�����w�̌��t�ŋL�q����B�j�̎����͋Z�p�I�ɂ͂قƂ�Ǖs�\�ł������B���ہA����܂łɁu�s�R�o�C�I���W�[�I�v�ɉ𖾂��ꂽ�^���p�N���@�\�͊F���ł���B
�@�������Ȃ���A�ŋ߁A���Ɍ�����Ɨ����d���������𒆐S�Ƃ����A�s�R�o�C�I���W�[�̎����̂��߂̒n���ȑ��̒����w�͂��������юn�߁A�s�R�o�C�I���W�[�Ƃ������������̂��̂ɂȂ����B
4�D �s�R�o�C�I���W�[���i�̋Z�p�I��Ղ̊m��
4.1�@�ԊO�����V�X�e��
�@���iH2O�A�y���j�͓��Ƀ^���p�N�����\������A�~�m�_�����ƃy�v�`�h�����i�A�~�h�o���h�j�ɂ��V�O�i���̂������g���̈�i�w���̈�ƌĂ��j�ɋ����z���������߁A�ʏ�̎s�̂̐ԊO�������u�iFTIR�j�Ń^���p�N�������̐ԊO�X�y�N�g�������o���邱�Ƃ͕s�\�ł���B�����Ő��̂��̋����z���̉e������X�̕��@�Ōy������i�Ⴆ�A�啔���̐����������������t�B�����B���Z�x�̃^���p�N���n�t��Z�����H���ő���B�y�����d���iD2O�j�ɒu���B�j���Ƃɂ���đ��肪���݂��Ă���B�������A���萸�x���ėp�����s�\���ł���B���̐���͂܂�Ƃ��됅�������ԊO�z���������߂ł���B�����ŁA�t�F���g�b���[�U�[�̔��F���𗘗p���������ԊO�������J������ƂƂ��ɒ������x�̐ԊO���m������邱�Ƃɂ��A���̋z���̉e����啝�Ɍy�����AAmide-�T �̈�̃y�v�`�h C=O �� 1 �c��̃o���h�ʒu�̕ω��ł��A�������insec ���x���j���肪�\�ȃV�X�e���̊J���ɐ��������B���̃V�X�e���𗘗p���ăE�V�S�`�g�N�����_���y�f�� CO ���𗣌�̐ԊO�X�y�N�g���ω��i������ 1.5 μsec�j�̐�������ɐ��������i�} 2�j 5�j �B���̃X�y�N�g���ω��� Amide-�T �̈�� 1 �c��̃y�v�`�h C=O �̃w���b�N�X����o���W�ւ̑J�ڂ������x�ő������邱�Ƃ������Ă���B�����̌��ʂ̓s�R�o�C�I���W�[�̎����ɕs���ȋZ�p�̈�ł���ԊO�����Z�p�̊m�����������̂ł���B X ���\���̓w���b�N�X����o���W�ւ̑J�ڂ� Ser382 �c��ł����N����Ȃ����Ƃ������Ă������� 6�j ���̐ԊO�z���ω��ʓ��ٓI�W���Ȃ��� Ser382 �c��ɓ��肷�邱�Ƃ��ł����B���̗Ⴊ�����悤�ɍ�����\ X ���\����͂Ɣ�r���邱�Ƃɂ��A���ʑ̕W���Ȃ��ɁA�ԊO�V�O�i���̋A�������҂ł���B�����I�ɂ͖ړI�^���p�N���̌�����p���āA�ԊO�ٕ��������肷�邱�Ƃɂ��V�O�i���̓���͉\�ł���B�傫�ȍ���͗\�z����邪���킷��ɒl���錤���ۑ�ł���B

4.2�@������������ X ���\�����
�@�s�R�o�C�I���W�[�̂�����̊�b�Z�p�ł��鎞���� X ���\����͖@�͍�N�x���ғ����J�n�����������R�d�q���[�U�[�ݔ��iXFEL �A���� SACLA�j�ɂ��܂��ɋ}�]�������������B SACLA �͑� 3 ����̕��ˌ��{�݂�茅�Ⴂ�ɋ����A���Z���i20×10-15 sec�j�p���X�������邱�Ƃ��ł���B���̂��߁A�Ǝ˂��ꂽ�^���p�N�������͊��S�ɔj��A X ����͂������Ȃ��Ȃ邪�A�����������ߔj���O�� X ����͂𖾗ĂɎ����B���������āA�t�F���g�b�i10-15 sec�j���x���̒Z���Ԃł� X ����͎������\�ɂȂ�B����ɋ��� X ���̏Ǝ˂̌��ʁA�����̔j�����ł��邽�߁A�����I�� X ���Ǝ˂̉e�������悤�� X ����͂͂قƂ�ǖ����ł���B���̂��ߑ� 3 ������ˌ��{�݂𗘗p���� X ����͎����̂悤�� X �����������邱�Ƃ��ł���B�������ASACLA �ɂ�� X ����͎����ł͐U���ʐ^�̑��肪�s�\�ł��邽�ߐÎ~�ʐ^�̑��茋�ʂ�������\����͂��s���K�v������B���̂��߂̃f�[�^��͖@�̊J�����������Ă���B���̌��ʁA�E�V�S�`�g�N�����_���y�f�̋x�~�_���^�̖����� X ���\���� 1.9�� ����\�Ō��肳�ꂽ�i�} 3�j 4�j �B�x�~�_���^�y�f�� O2 �Ҍ����S�iheme a3 �� CuB �ƌĂ��S�C�I���Ɠ��C�I���Ƃō\������Ă���A heme a3 �̓S�C�I���iFea3�j�� O2 ���������A���ɂ܂ŊҌ������B�j�ɂ͉ߎ_�����C�I���iO2 2-�j���������Ă��邱�Ƃ��_���Ҍ��H��ɂ�莦������Ă��� 7�j �B���̂��Ƃ� SPring-8 �� X ���\����͂ɂ��x�����ꂽ 3�j �B�������A�������Ă��� O22- �� O-O ���������� 1.7�� �ƒᕪ�q�ߎ_������������ X ����͎����f�[�^�ƈ�v���Ȃ��B���̌��������� SPring-8 �� X ���ɂ��Ǝ˂ɂ�� O22- �ɑΉ�����d�q���x���������邱�Ƃ��F�߂�ꂽ�̂ŁA�Ǝˎ��Ԉˑ������ɑ��肵�Ǝˎ��ԁ@0 �ɊO�}�������ʓ���ꂽ���̂ł���B���̌��ʂ̓^���p�N�����Ŋ��������ꂽ��Ԃł̌����������Ƃ������͉\�ł͂��邪�A X ���Ǝ˂̉e���� 0 �O�}�ɂ���Ă������ł��Ă��Ȃ��\��������B�} 3 �Ɏ����ꂽ SACLA �ɂ��t�F���g�b X �������\����͎������ʂ� SPring-8 �ɂ��\����͂ł� X ���ɂ�鑹�����ʂ����S�ɏ������邱�Ƃ͕s�\�ł��邱�Ƃ������Ă��� 4�j �B����ɂ�薳����������������\ X ���\����͂� SACLA �𗘗p���Ď����\�ł��邱�Ƃ������ꂽ�B�܂��A���̐��ʂ̂��d�v�ȈӋ`�� 20×10-15 sec �̎��ԕ�����̎����� X �������\�����\�ł��邱�Ƃ����������Ƃɂ���B
�@���̌��ʁA�s�R�o�C�I���W�[�����̂��߂̍ő�̋Z�p�I���_�i���n�t���̐ԊO�����Ǝ����� X ���\����́j�͂قډ��������Ƃ�����B����̔���I�Ȕ��W�����҂ł���B

5�D �����\����͂̈Ӌ`
�@��q�̒ʂ�A�����㐶���Ȋw�Ƃ��Ẵs�R�o�C�I���W�[�̖ڕW�̈�͊����̉��w�̌��t�����ł͋L�q�ł��Ȃ����ۂ����w�̌�b���g�����𖾂��邱�Ƃł���B���̖ڕW�̂��߂ɂ͍�����\�Ŕ�o���I�� X ���\�������肷�邱�Ƃ��s���ł���B�����x�i 3�� ����\�O��j�̕���\�� X ���\����͂��\�ȓd�q���x�ɑ��Ă̓^���p�N���O�̐��n�t���ł̍ł�����ȃA�~�m�_�̗��̍\�������Ă͂߂��č\�������肳��Ă���B����������ƁA�^���p�N���O�ł̃A�~�m�_�̍\���ɂ���ēd�q���x�i�������ʁj����������Ă���B���������āA�^���p�N�������ł̃^���p�N���O�ł͑��݂��Ȃ��������Ń^���p�N�����ł����`�����꓾�Ȃ��\���������Ă��A���ُ̈킪���o����邽�߂ɂ́A��������m�ł���d�q���x�̐��x�i����\�j���K�v�ł���B���������āA���ُ̈퐫�����o�ł��Ȃ����x�̕���\�� X ���\����͌��ʂ���͐��n�t���i�^���p�N���O�j�ŏ펯�I�ɗ\�z�ł��锽���@�\�������o�ł��Ȃ��\���������B�����ŋߑ����̃^���p�N���̒����x�� X �������\������������Ă��邪�A���̌��ʂɊ�Â������@�\�̓^���p�N�����ł̔����@�\�̓��F���\�������ł�����̂ɂ͂Ȃ��Ă��Ȃ����Ƃ��قƂ�ǂł���B��q�̂悤�ȍ\������̎菇���l������Γ��R�̂��Ƃł���B���������Ē����x�� X ���\������͏�q�̂悤�ȃ^���p�N�����ł����N���蓾�Ȃ��������쓮����\�������o���邱�Ƃ͕s�\�ł���B���̂��߁A�\����͂̍ہA�A�~�m�_�̗��̍\�������m�Ƃ���K�v�̂Ȃ����x���̍�����\�̓d�q���x���A�^���p�N�������ł����N����Ȃ����w�����̍\���𖾂ɂ͕K�v�ł���B�܂�A�A�~�m�_�c��̗��̍\�����^���p�N���O�̐��n�t�̂����Ɠ���ł���Ɖ��肵�Č��肳�ꂽ X ���\���̓^���p�N���O�̃A�~�m�_�̍\���̐��^�����ɉ߂��Ȃ����߁A���̍\������̓^���p�N�������̍\�����ِ������o���邱�Ƃ͌����I�ɕs�\�ł���B���������Ă��̕���\�� X ���\����͌��ʂ����ł̓^���p�N���@�\�i�A�~�m�_�̊W�߂ł͎������邱�Ƃ̂ł��Ȃ��@�\�j���𖾂��邽�߂̎肪����邱�Ƃ��ł��Ȃ��B���̂��߂ɂ͓d�q���x�̕���\�̌��オ�s���ł���B�� 3 ����̕��ˌ��{�� XFEL �ł� X ����͎����⓾��ꂽ X ����̓f�[�^������͋Z�p�̃n�[�h�E�F�A�A�\�t�g�E�F�A���ʂ���̐i���͂܂��ɓ��i�����ł���B�܂��A�^���p�N���̔����A�����������Z�p�̐i�����܂��Ƃɖڂ��܂����B�������A�����͒����x�̕���\�̌�������ڎw�������̂ł���A��q�̂悤�ȍ�����\��͂��\�ɂ���悤�Ȍ����������̒T���̂��߂ɂ͏�q�̂悤�ȃ��[�`����ƈȏ�Ɍ������������X�̃^���p�N���ɓ������ĒT���A���ǂ����݂�K�v������B���̂��߁A�^���p�N�������������̒T�����s�R�o�C�I���W�[���i�𗥑����Ă��邱�Ƃ������B
6. �@���^���p�N���\���@�\�����̈Ӌ`
�@�����̊�{�P�ʂł���זE�̍ł������ȍ\���I�����̈�͍זE�����͂��߂Ƃ�������������d�w�Ō`������Ă��閌�\���ł���ƌ����悤�B�����̖��\���͒P�Ȃ�d�ł͂Ȃ��A���푽�l�̖��^���p�N�����g�ݍ��܂�Ď�X�̋@�\���t�^����Ă���B�����̖��^���p�N���͋ψ�n�}�n�ł̉��w�����ł͎������s�\�ɋ߂����ِ��ƍ������������B����́A��ʂɋ���ȃ^���p�N���̓����͊O���Ƃ͖��m�Ɋ����قȂ��Ă��邾���ł͂Ȃ��A�ψ�n�}�n�ł͎������s�\�ɋ߂���X�̔��������@�\���S�̃A�~�m�_�����q�ɕt�^���Ă��邽�߂ł���ƍl�����Ă���B�܂��A���n���̋���^���p�N���ł��\���ɔ�Ώ̐����t�^����邱�Ƃɂ�葊�ݍ�p�����⑼�̃^���p�N���ɑ���@�\�������߂��Ă���B����ɖ��^���p�N���̔�Ώ̐��͖��ɕ������i���ƕ\�ASidedness�i�����j�ƌĂ�Ă���B�j��t�^����B���� Sidedness �͐��̃G�l���M�[�ϊ��╨���A����@�\���ߓ��̍זE���������ێ����邽�߂ɕs���ȋ@�\�̎������\�ɂ��Ă���B���ہA�����I�Ɍ����������ۂŁA���^���p�N�����S���֗^���Ă��Ȃ����̂͂Ȃ��ƌ�����B���̂悤�� Sidedness �����p�������^���p�N���̋쓮���鉻�w�������������̉��w�̌��t�����ł͗����ł��Ȃ��@�\�ŋ쓮����Ă��邱�Ƃ������Ɛ���ł���B�܂��A���̂悤�Ȗ��^���p�N���̍\���@�\�𖾂͐������ۂ̗����ɖ{���I�ɍv��������Ƃ����w�p�I�d�v���ɉ����āABiomimetic �ȋ@�\�������̐v������n�ւ̉��p�̉\�������҂ł���B���̂悤�ȏf���Ė��^���p�N���̍\���@�\�������N�X����ɂȂ��Ă��Ă���B
�@�ߔN�̐����Ȋw�����ł͑n����͂��߂Ƃ��鉞�p�̉\�������ڂ���邱�Ƃ������B���^���p�N������q�̂悤�Ȋw�p�I�������͉��p�̉\���ɒ��ڂ���Ă���A�č��ł͖��^���p�N���łȂ���^���p�N���\���@�\�����̗\�Z�l�������ɍ���ł���Ƃ̂��Ƃł���B�ܘ_���p�����̏d�v���͊�b�����̂���ɕς��Ȃ��B�u�������Ȋw�I�ɂ����ɂ�����Ă��邩�Ƃ��̌������ǂ�����p�������牓�����Ƃ͑S�����W�ł���B�v�͎����ł���ƌ����悤�B�ȑO�͎������Ɩ��W�Ȍ����������^�̊w��ł���ƐM���Ă���Ƃ����l�����Ȃ��悤�Ȋ�b�����w����̌����҂��������Ȃ������B���̂悤�Ȍ����҂͏ۉ�̓��Ƃ��Č������ᔻ�����ƂƂ��ɁA�u�����w�v������ȗ\�Z��K�v�Ƃ���u�����Ȋw�v�ɕϖe�������ʁA����Ȍ����O���[�v�̉��p�������䍑�ł��N�X�ڗ��悤�ɂȂ��Ă��Ă���B���̂��߁A���̂悤�Ȍ����҂͌������Ă���B�������A��q�́u�����ɗD�ꂽ�Ȋw�ł��邩�H�v�Ƃ̖₢�������݂���悤�ɂȂ�A�����Ȋw�̍��{�����邱�Ƃ��뜜�����B
�@�K���ɂ����^���p�N�������̊�b���p�̗��ʂɑ���d�v���͍L���F������Ă���A����̐����Ȋw�̒��S�ƂȂ�Ɗ��҂ł���B��q�̒ʂ�A���^���p�N���\���@�\�����̐i�W�͐��n���^���p�N���Ɠ��l�� X �������\���̕���\�ɂ�藥�������B���̕���\�����肷��ő�̗v���͌����̕i���ł���B���̕i���͖ړI�̖��^���p�N���̖�����P�����i�n���j���n�t���Ɉ��艻���邽�߂ɕK�v�ȊE�ʊ����܂̍\���ɍł������ˑ�����B���������āA�����Ȋw�̔��W�͗D�ꂽ�E�ʊ����܂̊J���ɂ���ċ쓮�����ƋɌ����邱�Ƃ��ł��悤�B
�@���^���p�N���̃s�R�o�C�I���W�[���ܘ_�ړI�Ƃ��閌�^���p�N���� X �������\���̕���\�ɗ�������Đi�����Ă����B���^���p�N���������̂��߂̊E�ʊ����܂̃X�N���[�j���O�L�b�g���J������A��q�̒����x�̕���\�̍\�����茤���ւ̎��g�݂��J�n���鐸�_�I�o���A�[�͈ȑO�ɔ�ׂĊm���ɒႭ�Ȃ��Ă���B�������A���^���p�N���ɂ��Ă��A�����@�\�̃s�R�o�C�I���W�[�I�����̂��߂ɂ́A����\����̂��߁A�ړI�Ƃ���^���p�N���ɓ������������̊m�����K�v�ł���B���̂悤�Ȏ��_�Ɋ�Â��������ƊE�ʊ����܂̎�舵���Ɋւ���c�_�͖{�A�ڎ����ȍ~�ɏ���B
7. �@�`�g�N�����_���y�f�̔����@�\�����̗��j
�@�^���p�N���̔����@�\�����͂��� X ���\���̕���\�̌���ɗ��������B�����ł͂��̂悤�ȃs�R�o�C�I���W�[�����̎��ጤ���Ƃ��āA�E�V�S�`�g�N�����_���y�f�̔����@�\�����̗��j���uX ���\���̕���\�̌��オ�ǂ̂悤�ɂ��̐i���ɍv�����Ă������B�v�Ƃ̎��_����Љ��B
7�D1�@X ���\������ȑO�̍\���@�\���
�@1995 �N�ɃE�V�S�`�g�N�����_���y�f�� X ���\���� 2.8�� ����\�ōۍy�f�Ƃقړ����ɕ��ꂽ 8, 9�j �B���̐��������������Ƃ��āA�����̖��^���p�N���� X ���\����̖͂{�i�I�Ȏ��g�݂��J�n���ꂽ���A����܂ł̓E�V�S�`�g�N�����_���y�f�̂悤�ɋ���Ȗ��^���p�N���̌������͕s�\�ł͂Ȃ����Ƃ̗\�z���吨���߂Ă����B���̂��߁A���� 1995 �N�ȑO�ɂ́A��������K�v�Ƃ��Ȃ����l�ȍ\����͂̓w�͂����͓I�ɐ��i���ꂽ�B
�@�E�V�S�`�g�N�����_���y�f�Ɋ܂܂��T�u���j�b�g���� SDS-PAGE ���݂͂̂ɂ���� 13 �ł���Ǝ咣����Ă��� 10�j �B�������A�ŏ��̃T�u���j�b�g�̕��q�ʂ� 8000 ���x�ł��邵�A�����I�ȕ���q���܂܂�Ă��Ȃ����߁A�����W�i�ɍČ����悭�܂܂�Ă��Ă��A�ŗL�̐����ł��邱�Ƃ������ϋɓI�ȏ؋��͓����Ă��Ȃ������B�_���Ҍ�������������q�Ƃ���6 �z�ʒ�X�s���^�� heme a �� 5 �z�ʍ��X�s���^�� heme a3 �����ꂼ�� heme a3 �ւ̓d�q���^�̂� O2 �������ʂƂ��ċ@�\���Ă��邱�Ƃ��������y�у��}�������w�I�ɏؖ�����Ă��� 11�j �B�܂� heme a3 �̋ߖT�ɂ͓����S�� 1 �ł��� CuB ���z�u����Ă��邱�Ƃ� EPR ����ɂ�鍂�X�s�� Fe3+ �� CuB2+ �ƊԂ̎��C�������������ʂ��狭����������Ă����B�� 2 �̓����S�ł��� CuA �����j�� Cupredoxin �^�\���ł��邱�Ƃ� EPR ���肩��咣����Ă��� 12�j �B����ۃ`�g�N�����_���y�f�̕��ʓ��ٓI�ψى�͂Ɋ�Â��āA���`���̂��߂ƃ|���v�����v���g���Ƃ̗A���o�H�ɂ��Ă��c�_����Ă��� 11�j �B
�@ X �������\�������肳���܂ł́A�{�y�f�̋@�\��͂̍ł��d�v�Ȑ��ʂ͋����}�������@�ɂ�� O2 �Ҍ��@�\��͂ł��낤�B��q�̒ʂ�A���F�c��������q�̃��}���X�y�N�g���͔��F�c�������[�U�[���ɂ���N���邱�Ƃɂ��A���}���U�����x��傫�����߂邱�Ƃ��ł��邽�߃^���p�N�������ɑS���e������邱�ƂȂ������x�̑��肪�\�ł���B�i�A���A���̕��@�ł͉��z���������Ȃ�����q�i�Ⴆ�� CuB �j�̃��}������͕s�\�ł���B�j����ɂ�� O2 �Ҍ��������ԑ̂Ƃ��� Fea32+-O2�iA�j�A Fea35+= O2-�iP�j�A Fea34+=O2-(F�j�AFea33+-OH-�iO�j�� 4 �킪���o���ꂽ�i�} 4�j 13�j �B�������A��q�̒ʂ苤���}�������@�� CuB �̍\���Ɋւ������S���^���Ȃ����߁A heme a3 �̍\���ω��������o����Ă��Ȃ��B�������A����ɂ�� O2 �Ҍ��ߒ��Ɋւ���d�v�Ȓm��������ꂽ�B�܂� A ���ԑ̂��� P ���ԑ̂ւ̕ϊ��̍ہAO-O �������ؒf����Ă��邱�Ƃ��ؖ����ꂽ�B�܂��A CuB ���� 2 �̎_���Ҍ����S�Ƃ��� Fea3 �ɋߐڂ��Ĕz�u����Ă���ɂ�������炸�A Fea32+-O2 �����o���ꂽ���Ƃ͑S���\�z�O�ł������B O2 �́A1 �d�q�Ҍ��͎₷���� 2 �d�q�Ҍ��͎ɂ����Ƃ����ŗL�̉��w�I�������l������� CuB �̍\�������肳��Ă��Ȃ��������߁A�Ȃ� A �^������ł��邩�͑S���s���ł������B�܂� A → P �ϊ��̎����ł� O-O �������ؒf����Ă��邽�߂ɂ� 14�j Fea3 �� CuB ����� 1 �d�q���ʂɉ����Ă���� 2 �d�q���ʂ��K�v�ł��邪�A���̗R���ɂ��Ă� X ���\�����Ȃ��ɂ͑z������s�\�ł������B�܂� F ���ԑ́AO ���ԑ̂� Fea3 �����̍\���ɂ��Ă����z������͓����Ȃ��d�v�ȏ�����}�������@�ɂ�蓾���Ă���B�������A1990 �N���߂� A ���ԑ̂̍\�������肳�ꂽ���A���̂��ꂪ���o�ł���قLj���ł��邩�Ɋւ��錤���ɂ� X ���\���̌����҂��Ȃ���Ȃ�Ȃ����� 15, 16, 17�j �B

7�D2�@���S�_���^ 2.8�� ����\�� X ���\������̈Ӌ`
.�@1995 �N�E�V�S�ƍۃ`�g�N�����_���y�f�̗��̍\���� 2.8�� ����\�Ō��肳�ꂽ 8�j �B�E�V�S�؍y�f�̗��̍\���ɂ� SDS-PAGE ����\�z����Ă����ʂ�� 13 �̃T�u���j�b�g�����o���ꂽ�i�} 5�j 18�j �B�Ȃ��A���� X ���\�������肳��Ă������@�\�����炩�ȃT�u���j�b�g�ȊO�͕s�����ł���\���͔ے�ł��Ȃ��B�������A�s������ X ���\�����Ɍ��o�����قǓ��ٓI�ɂ���ʓI�Ɍ�������\���͔��ɒႢ�ƌ�����B

�@CuA �̗��̍\���� EPR �̌��ʂ����S�Ɏx��������̂ł����� 8�j �B�@2 �̃w���̔z�ʍ\���������w�I��͌��ʂ���������ʂ�ł������i�} 6�j 8, 18�j �B�܂��A CuB �̈ʒu�����C�������\���\�z������B�@2.8�� ����\�̍\���̓A�~�m�_�����̔z�����w�� A �̃v���s�I���_��A�q�h���L�V�t�@�l�V����̗��̍\�������肷�� 8�j18�j �B�ܘ_���̕���\�ł͂����̗��̍\���̓^���p�N���O�Ō��肳�ꂽ�펯�I�\������g�ݗ��Ă��Ă���B�������A���̕��@�ł͌��肪�قڕs�\�ł���ƍl������悤�ȍ\���i�Ⴆ�w���̃q�h���L�V�t�@�l�V���G�`�������̗��̍\���j�����肳���B���̂悤�ȍ\���̈���ACuA�Aheme a�A heme a3 �Ƃ�����A������A�~�m�_�����̍\���i�} 6�j 18�j �ł���B���L�����␅�f�����̓^���p�N�������̓d�q�`�B�o�H�Ƃ��ċ@�\����ƍl�����Ă���B�����w�I�@�\��͂̌��� CuA ���璼�� heme a3 �֓d�q���`�B����邱�Ƃ͐����������i����ȑ�Ӊ�]���j�ł͑S���Ȃ����Ƃ��m���Ă���B�������A���̍\���� CuA ���� R438 ���o�R���� heme a3 �ւ̒��ڂ̓d�q�`�B�� CuA ���� heme a �ւ̓d�q�`�B�Ƃقړ������x�ŋN���邱�Ƃ��������Ă���B���������āA���� X ���\���� heme a �� heme a3 �Ƃ̎_���Ҍ��d�ʂ�d�q�`�B�ɔ����ĉs�q�ɒ��߂��邱�Ƃɂ���� heme a3 �ւ̒��ڂ̓d�q�`�B��h�䂵�Ă��邱�Ƃ������������Ă���B

7�D3�@2.3��\�̍\������
�@1998 �N�Ɏ_���^�^�Ҍ��^�̍\�������ꂼ�� 2.3/2.35�� ����\�Ō��肳�ꂽ 19�j �B���̕���\�̌���ɂ��A�܂� O2 �Ҍ����S�̊Ҍ��^�̍\���� CuB1+ ������ 3 �z�u�\���ł��邱�Ƃ������ꂽ�B����� CuB ���d�q���^�\�͂��z�ʎq��e�\�͂����Ɏア�A�ɂ߂Ĉ���ȍ\���ł��邱�Ƃ������Ă���B���̌��ʂ� CuB �� Fea32+ �������� O2 �ւ̑� 2 �̓d�q���^�̂Ƃ��ċ@�\���Ȃ����Ƃ������Ă���B���̍\���� A ���ԑ̂̈��萫�Ɋ�^���Ă���B����� CuB �ɔz�ʂ��Ă��� H240 �C�~�_�]�[����� Y244 �� C-N ���L�������`�����Ă��邱�Ƃ����炩�ɂȂ����i�} 7�j 19�j �B���̖|���C���� O2 �Ҍ��ɋ��������v���g���|���v�y�f�̂��ׂĂɕۑ�����Ă��邱�Ƃ����炩�ɂȂ��Ă���B���� Y244OH � A → P �ϊ��̍ۂ� O-O �����J���̂��߂̓d�q���^�̂̈�Ƃ��ċ@�\���Ă��邱�Ƃ������������Ă���B

�@���̕���\����ɂ�肳��Ƀv���g���|���v�o�H�����炩�ɂȂ����B�} 8 �Ɏ�����Ă���悤�� P-side�i�~�g�R���h���A�����O���B�����瑤�Ƀv���g�����~�ς����B�j�̕��q�\�ʋ߂��Ɉʒu���� D51 ���Ҍ��^�ŕ��q�\�ʂɘI�o���邱�Ƃ��F�߂�ꂽ 19�j �B

�܂����� D51 �� N-side�i�~�g�R���h���A���������j���f�����̃l�b�g���[�N�Ɛ��o�H�ŘA������Ă��邱�Ƃ������ꂽ�B�܂��A���̌o�H�� heme a �̎��ӂɔz�u����Ă��邱�Ƃ������ꂽ�B������ X ���\���͂��� D51 ���܂ތo�H�i���� H-pathway �ƌĂ�Ă���B�j���v���g���|���v�o�H�ł��邱�Ƃ������������Ă���i�} 9�j 19�j �B�܂��_���^�i�x�~�_���^�j�ɂ� O22-�i�ߎ_�����j�� CuB �� Fea3 �Ƃ̊Ԃɉˋ����Ă��邱�Ƃ������ꂽ�i�} 7�j 19�j �B
�@�Ȃ��A����܂ł� X ����͎����̓t�H�g���t�@�N�g���[�� 8 ���ōs��ꂽ�B

7�D4�@�_���^�^�Ҍ��^�i1.8/1.9���j����\�̍\�����
�@�t�H�g���t�@�N�g���[��苭�� X ������������ 3 ����̕��ˌ��iSPring-8�j�𗘗p���邱�Ƃɂ�蕪��\������Ɍ��コ���邱�Ƃɐ��������i2004�j 20�j �B���̕���\�̌���ɂ���} 10 �Ɏ������悤�� H-pathway �̍\�����i�i�ɖ��ĂɂȂ����B�} 10A �Ɏ�����Ă��� D51 �̎_���Ҍ����𗧑̍\���ω��ɂ��} 10B �Ɏ������悤�Ȑ����q�̍\���ω��������Ă���B

����Ƀy�v�`�h���������f�����̃l�b�g���[�N�ɑg�ݍ��܂�Ă��� 20�j �B�v���g���́A�������͂ȋ��^�̂Ǝ�e�̂�����y�v�`�h�������o�R���ėA������邱�ƁA�܂����̗A���ɂ̓y�v�`�h������ keto-form�i-CO-NH-�j�� enoll-form�i-C�iOH�j=N-�j�ɑ�����萫�̂��ߕ����������邱�Ƃ��m���Ă���B���������āA���̃y�v�`�h������ P-side ����̃v���g���t����h���@�\�����ƍl������B�} 11A �̖͎��������悤�� H-pathway �͏㔼�������f�����̃l�b�g���[�N�A�������� N-side �̐����Z�����邱�Ƃ̂ł���o�H�i���o�H�j����\������Ă���B���o�H�ɂ͏��Ȃ��Ƃ� 1 �ȏ�̐����q�����݂��邱�Ƃ̂ł����ԁi�L���r�e�B�[�j������A���ꂪ���̈ړ��𑣐i���Ă���i�} 11A�j 21�j �B�} 11B�i���f�����l�b�g���[�N�̑��ʐ}�j�Ɏ������悤�� heme a �����f�����̃l�b�g���[�N�� 2 �̐��f�������`�����Ă���B heme a ����AO2 �Ҍ����S�ւ̓d�q�`�B�̌��ʐ��������דd���w�����ӂ֔�Ǎ݉�����B���̉e�������� 2 �̐��f������ʂ��āA���f�����̃l�b�g���[�N��ɂ���v���g���ƐÓd�I���ݍ�p�i�Ód�I�����j��U�N���A�v���g���\���A�����쓮���邱�Ƃ����� X ���\���͂͂�����Ǝ����Ă���B

�@�������A�Ód�I�����ɋ쓮�����̂Ȃ�Δ\���A���̕������������Ƃ͖{���s�\�ł���B���̃v���g���̋t���h�~�@�\�� X ���\���̕���\�̌���ɂ�薾�炩�ɂȂ����B�} 12�iA: ���o�H�̎_���Ҍ����� X ���\���ω��B�@B: ���o�H�\���ω��̖͎��}�j�Ɏ����ʂ�A���o�H�̍ő�̃L���r�e�B�[���A�{�y�f���_������邱�Ƃɂ��������邱�Ƃ����̕���\�Ŗ��炩�ɂȂ��� 21�j �B���̃L���r�e�B�[�̏����ɂ�萅�̌������x�͑啝�ɒቺ���A�����I���Ԕ͈͂ł̓L���r�e�B�[�͕������ƍl������B���������āA���̊J�ɂ��v���g���t����h�~���Ă���ƍl������B

7�D5�@�ċz�j�Q�܌����^�y�f�� X ���\�����
�@��q�̒ʂ苤���}�������w�I��͂ɂ��AO2 �Ҍ������̑� 1 ���ԑ́iA ���ԑ́j�� O2 �����^�ł��邪�A�� 2 ���ԑ́iP ���ԑ́j�ł� O-O �������J�Ă��邱�Ƃ����炩�ɂȂ��Ă���B���������āA����� O2 �Ҍ������ߒ��ł� O2 �����ɂ܂ŊҌ������iO-O �������J��j�܂ł̊Ԃ̉ߒ��ɐ����钆�ԑ̂͐������������̕����������ߌ��o�͕s�\�ł���B�����ŁA��X�̌ċz�j�Q�܁iO2 �̊�ގ��́j�����^�y�f�� X ���\����͂ɂ��AO2 �Ҍ����S�̋@�\��T�����邱�Ƃɂ�� O2 �Ҍ��@�\�̗�����[�߂�w�͂��������Ă���B

�@NO �����^�� X ���\���� 1.8�� ����\�Ō��肳�ꂽ�i NO �� O2 �̍ł��D�ꂽ�ގ��̂ł���B�j�B�} 13 �̂悤�� CuB �͊��S�Ҍ��^�̎��Ɠ��l���� 3 �z�ʍ\���ł���z�ʎq�Ƃ̋����� 2.5�� �ł��� CuB �̈��萫���l������Δz�ʎq�ւ̓d�q�`�B�� O2 ���������Ă��Ă����ɒx�����Ƃ��������Ă��� 21�j �B����� Y244OH ����̓d�q�`�B���} 13 �Ɏ�����Ă���悤�� H240 �̃C�~�_�]�[����ɂ��z�ʎq�ւ̑��ݍ�p���قڊ��S�ɖW�Q����Ă��邽�ߔz�ʎq�ւ̓d�q�`�B�͔��ɒx�����Ƃ������Ă���B���l�̌��ʂ� CO �����^�ɂ��Ă��F�߂��� 21�j �B������ X ���\����͌��ʂ� O2 �Ҍ����ʂ��z�ʎq�iO2�j�ւ� 2 �d�q�Ҍ���h���\���ɂȂ��Ă��邱�Ƃ������Ă���B���� CN- �����^�� O2 �����^�̋��\���̈�ł���iFe3+-O2-�j�̗ގ��̂ƍl������B���� X ���\���� 2.05�� ����\�Ō��肳�ꂽ�i�} 14A�j 21�j �BCN- �����ɂ�� CuB �̔z�ʍ\�����傫���ω����A�������Ă��� CN- �ɑ��� 3 �{�̓d�q�`�B�o�H���`�����ꂽ�i�} 14C�j 21�j �B Fea32+ ����� 2 �d�q�̋��^���\�ł���̂ł��̍\���� 4 �d�q�̓������^�������������Ă���i�} 14D�j�B����������� O2 �Ҍ����S�� O2- ����������������� 2 �{�̓d�q�`�B�o�H���`�����A4 �d�q�Ҍ��ɂ�� O2 �𐅂ɂ܂ŊҌ����邱�Ƃ������������Ă���B O2 �� 1 �d�q���������^����Ǝ�X�̊����y�f�킪�`�������B�������A�{�y�f�͂����ɋ�����������Ă���悤�� 4 �d�q�Ҍ��ɂ�芈���y�f����`�������� O2 �𐅂ɂ܂ŊҌ�����B

�@CO �� NO �����ɂ��Ҍ��^�ŔF�߂��鐅�o�H�ő�̃L���r�e�B�[�����S�_���^�̎��Ɠ��l�ɕ�����邱�Ƃ����炩�ɂȂ����B�܂��AP�AF�AO ���ԑ̂ł����l�ɕ�����邱�Ƃ������� X ���\���͎����Ă����B���������āA���o�H�� O2 �Ҍ����S���Ҍ��^�Ŕz�ʎq���������Ă��Ȃ��������J���Ă���AN-side ����̃v���g���i�q�h���j�E���C�I���j�̎��g�݂��\�ɂ��� 21�j �B O2 �Ҍ��̂��߂̓d�q�̓`�g�N���� c ���� 1 �d�q���� CuB�A heme a ���o�R���� O2 �Ҍ����S�ɓ`�B�����B�ڍׂȓd�ʉ�͂ɂ��A�`�g�N���� c ����� 1 �d�q���ʂ̓`�B�i1 ��Ӊ�]�����荇�v 4 �d�q���ʁj�ɋ������� 1 ���ʂ̃v���g�����|���v����邱�Ƃ��m���Ă���B�{�y�f�̑�Ӊ�]���} 15 �̂悤�ɗv�邱�Ƃ��ł���B O2 ���������Ă��犮�S�Ҍ��^�i�}���� R ���ԑ́j���Đ������܂ŃL���r�e�B�[�͕����ꂽ�܂܂ł���B���������āAR ���ԑ̂������Ă��� O2 ����������܂ł� 4 ���ʂ̃v���g�������f�����l�b�g���[�N�Ɏ�荞�܂�Ȃ���Ȃ�Ȃ��B�������A1.8�� ����\�̍\���ł� 4 ���ʂ̃v���g����e���\�ł��邩�ǂ����͖��m�ł͂Ȃ��B�v���g����e���ʂ̒T���̂��߁A���݂���ɍ�����\�� X ���\�������肷�邽�߂̓w�͂��������Ă���B

�@�E�V�S�`�g�N�����_���y�f�� 1941 �N�ɖ�t���A���тɂ���ĒP������ 22�j �A1961 �N�ɕĒJ�ɂ���Ĕ����������ꂽ 23�j �B���ꂩ�炳��� 33 �N��� X ����͎������\�Ȍ����������A��q�̒ʂ� 1995 �N�� 2.8�� ����\�� X ���\�������肳�ꂽ 8�j �B����� 15 �N��� 1.8�� ����\�ɓ��B���� 21�j �B�������A�܂������̉��w�̌��t�����ł͐����ł��Ȃ����ۂɂ͏o����Ă��Ȃ��B�������A����\�̌���ɔ����ĐV���E���J����悤�Ɋ�������قǁA�����̉��w�̌��t�ŋL�q�͂ł��邪�A�\�z�O�̔����̘A���ł������B���̖��^���p�N���ɂ��Ă�����\�̌���͓��l�̋����������炷�ɈႢ�Ȃ��Ǝv����B�������A�����x�̕���\�ɓ��B����Ƃ������A�~�m�_������������悤�ɂȂ�B�������番��\�����߂�̂� 2.8�� ����\�ɓ��B������ʏ�͂邩�ɍ���ɂȂ�B����ł�������\�ɒ��킷�鉿�l�����邱�Ƃ́A�Ⴆ�Ε���\ 2.3�� ���� 1.8�� �ւ̌���ɂ��v���g���|���v�o�H�̑}���}���} 9 �����} 11A �ւƏ���������ꂽ���Ƃ�������炩�ł���B���̂悤�Ȗ��^���p�N�� X ���\���̕���\����̋�̓I�헪������ȍ~�c�_����B
| ���҃v���t�B�[�� | |
| ���� | �g��@�M��iYoshikawa Shinya�j |
|---|---|
| ���� | ���Ɍ�����w��w�@�������w������ |
| �A���� | ��678-1297�@���Ɍ��ԕ�S��S�����s 3-2-1 TEL :�@0791-58-0345 |
| yoshi@sci.u-hyogo.ac.jp | |
| �o�g��w | ����w��w�@���w�����Ȕ��m����ے��������w��U |
| �w�� | ���w���m |
| ���݂̌����e�[�} | �~�g�R���h���A�ċz�̃s�R�o�C�I���W�[ |
| Copyright(c) 1996-2014 DOJINDO LABORATORIES,�@ALL Rights Reserved. |