 |
| トップページ > 膜透過性ポリジスルフィド(CPDs)を用いた細胞内導入 |
 |
膜透過性ポリジスルフィド(CPDs)を用いた細胞内導入株式会社同仁化学研究所 見汐 航太朗
 Matile らは、これらの手法で作製した CPDs の細胞内導入の様子を、基質として蛍光物質であるカルボキシフルオレセイン(CF)チオール基誘導体を用い、共焦点レーザー蛍光顕微鏡(CLMS)で観察している 4)。 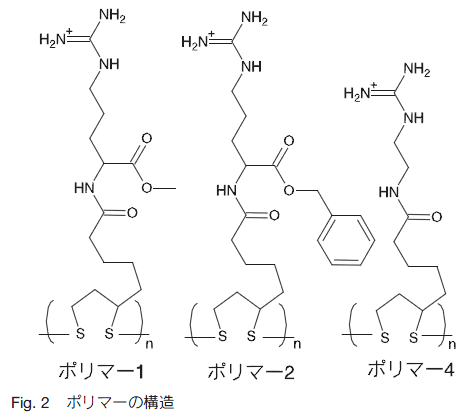
このような側鎖の構造によるポリマーの細胞内局在の違いは、脂溶性と S-S 交換反応の速度が関係していると考えられる。脂溶性が高いポリマー 2 はエンドサイトーシスを介して細胞内に導入され、エンドソームに捕捉されやすい。一方、脂溶性の低いポリマー 1,4 は、エンドサイトーシスを介さず、細胞膜表面のチオール基と CPDs が共有結合することによって、細胞膜を通過し、細胞内のグルタチオンにより細胞内に放出されると推察されている。また、細胞質に局在化するポリマー 4 は S-S 交換反応の速度が速く、核に局在化するポリマー 1 は交換反応が遅い。つまり、ポリマー 4 は細胞内に導入された後、即座にグルタチオンと反応して細胞質内で基質が放出されるのに対し、ポリマー 1 はその反応速度が遅いため細胞質で放出されず核まで移行する、とされている。さらに、ポリマー 4 の細胞毒性は非常に低く、ポリアルギニンでは明らかな細胞毒性を示す 10 μM でもほとんど細胞毒性を示していない。このような細胞毒性の低さは、その特有の細胞内導入機構によるものと考えらえる(Fig. 3)。 
参考文献1) A. G. Torres and M. J. Gait, Trends Biotechnol., 2012, 30, 185-190. 2) M. Kosuge, T. Takeuchi, I. Nakase, A. Tomos Jones and S. Futaki, Bioconjugate Chem., 2008, 19, 656-664. 3) E. Bang, G. Gasparini, G. Molinard, A. Roux, N. Sakai and Stefan Matile, J. Am. Chem. Soc., 2013, 135, 2088-2091. 4) G. Gasparini, E. Bang, G. Molinard, D. V. Tulumello, S. Ward, S. O. Kelley, A. Roux, N. Sakai and S. Matile, J. Am. Chem. Soc., 2014, 136, 6069-6074.
|
| Copyright(c) 1996-2014 DOJINDO LABORATORIES, ALL Rights Reserved. |