パイロトーシスの分子機構と役割
Molecular mechanisms and roles of pyroptosis
 |
須田 貴司 金沢大学 がん進展制御研究所 免疫炎症制御研究分野 |
Abstract
Pyroptosis was discovered as caspase-1-dependent programmed cell death of macrophages infected with intracellular parasites such as Shigella and Salmonella. Later, it was discovered that in addition to caspase-1, caspase-4 and -5 (caspase-11 in mice) induce pyroptosis. These caspases cleave the cytoplasmic protein gasdermin D, and its
amino-terminal fragments form pores in the plasma membrane to induce pyroptosis. In addition, other members belonging to the gasdermin family induce pyroptosis after being cleaved by certain proteases. Therefore, it is now proposed to redefine pyroptosis as gasdermin-dependent cell death. Among them, gasdermin E was found to be cleaved by
caspase-3, and the boundary between pyroptosis and apoptosis is being blurred.
はじめに
パイロトーシスは赤痢菌やサルモネラ菌など、細胞内寄生細菌に感染したマクロファージのカスパーゼ1依存性のプログラム細胞死として発見された。 その後、カスパーゼ1に加え、カスパーゼ4や5(マウスではカスパーゼ11)もパイロトーシスを誘導すること、細胞質蛋白であるガスダーミンDがこれらのカスパーゼによって切断されて生じるアミノ末端側の断片が細胞膜に孔を形成することでパイロトーシスが誘導されることが明らかにされた。さらに、ガスダーミンファミリーに属する他の蛋白も何らかのプロテアーゼによって切断されることで、パイロトーシスを誘導することが判明し、パイロトーシスはガスダーミン依存性細胞死と再定義されつつある。 中でもガスダーミンEはカスパーゼ3によって切断され、パイロトーシスとアポトーシスの境界線は再び不鮮明になってきている。
1. パイロトーシスの発見と命名
パイロトーシス(Pyroptosis)の発見は、赤痢菌やサルモネラ菌に感染したマクロファージの細胞死がカスパーゼ1依存性であるという1996年ごろからのZychlinskyら1)2)の論文まで遡ることができる。 ただし、彼らは当初、この細胞死はアポトーシスであるとしていた。 そのためか、後に、この細胞死が炎症性サイトカインである IL-1βの産生を伴うこと、カスパーゼ3非依存性であることなど、一般的なアポトーシスとは異なる特徴を示すことに気づいたが、この細胞死に新しい名前を付けることはしなかった。 その後、Cooksonら3)は、サルモネラ菌感染によるマクロファージのカスパーゼ1依存性細胞死が速やかな細胞膜の破壊を伴うネクローシス様の細胞死であること、IL-1βなどの産生を伴う炎症誘導性の細胞死であることなどから、アポトーシスとは様式の異なるプログラム細胞死であるとし、炎(炎症)を意味するパイロ(pyro)とプログラム細胞死を意味するトーシス(ptosis)を合成し、パイロトーシスと命名した。
2.パイロトーシスの分子機構
2.1. カスパーゼ1活性化機構
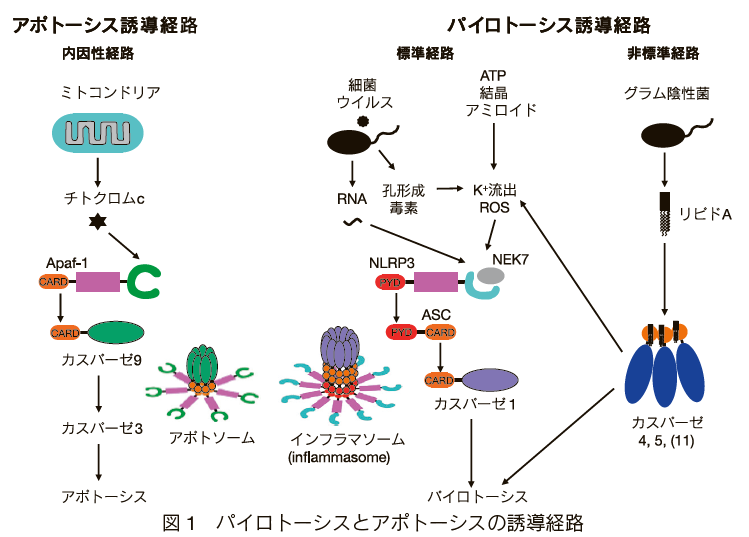
カスパーゼ1の活性化機構は、アポトーシスの内因性経路におけるカスパーゼ9の活性化機構と似ている(図1)。 カスパーゼ9は、ミトコンドリアからサイトゾルに放出されたチトクロムcとApaf-1の複合体7つがスポーク状に寄り集まり、その中央部にカスパーゼ9が集積したアポトゾーム(apoptosome)と呼ばれる超複合体で活性化される(図1、左)。
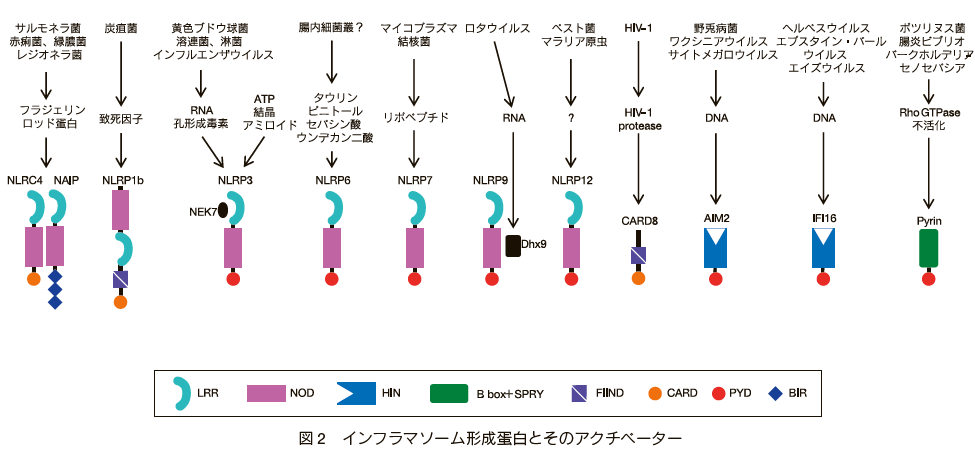
カスパーゼ1の活性化において、Apaf-1に相当する役割を果たす分子は、NLRC4、NLRP1、NLRP3、NLRP6、NLRP7、NLRP9、NLRP12、CARD8、AIM2、IFI16、Pyrinなどの細胞内蛋白質である(図2)。 これらの分子は、様々な病原体に応答して多量体化し、直接あるいはASC と呼ばれるアダプター分子を介してカスパーゼ 1
と結合し、インフラマソームと呼ばれる複合体を形成する。
図1中央に、最も研究の進んでいるインフラマソーム形成蛋白の一つであるNLRP3依存性経路を例として、カスパーゼ1の活性化経路を示した。 NLRP3は細菌やウイルスのRNAおよび孔形成毒素によって活性化される。 また、DAMPs(Danger-associated molecular
patterns、死細胞から放出される自然免疫応答誘導物質)に属すATP、代謝異常に起因する体内物質に属す尿酸結晶、コレステロール結晶、アミロイド、高血糖、酸化脂質など、環境汚染物質に属すアスベストやシリカの結晶、一部の抗がん剤などによっても活性化される。
このような多様な物質によってNLRP3が活性化されるのは、これらの物質によって細胞に誘導されるK+イオンの流出や活性酸素種(ROS)の生成がNLRP3を活性化するためと考えられている。 活性化されたNLRP3は自身が多量体化するとともに、ASCを介してカスパーゼ1と相互作用してインフラマソームを形成する。
また、NLRP3インフラマソームの形成には、有糸分裂で働くキナーゼとして知られていたNEK7が重要な役割を果たしている4)5)。
インフラマソームの形成をきっかけとしてASC自体も重合して繊維状の構造を形成し、最終的にはASCスペックと呼ばれる巨大な凝集塊を形成する。 ASCの重合体もカスパーゼ1の活性化の場となる。 NLRC4やNLRP1は直接カスパーゼ1と結合できるが、ASCとも結合してスペック形成を誘導するため、IL-1βを効率よく産生するためにはASC が必要である6)。
2.2. 非標準的インフラマソーム経路
大腸菌やコレラ菌などの感染、あるいはリポポリサッカライド(LPS)の細胞質への導入でマクロファージはパイロトーシスを起こし、IL-1βやIL-18を放出する。 ところが、この細胞死はカスパーゼ4や5(マウスではカスパーゼ11)に依存し、カスパーゼ1 は必要ない7)8)(図1、左)。 カスパーゼ4/5/11は、LPSのリピドAが直接カスパーゼのCARDに結合することで多量体化し、活性化する9)10)。 一方、IL-1βやIL-18の産生は、カスパーゼ4/5/11の下流でNLRP3インフラマソームが形成され、カスパーゼ 1 が活性化された結果として誘導される。 この経路は非標準的インフラマソーム経路と呼ばれている。この経路でNLRP3インフラマソームが活性化される理由は次項で説明する。
2.3. ガスダーミン:パイロトーシスのエフェクター分子
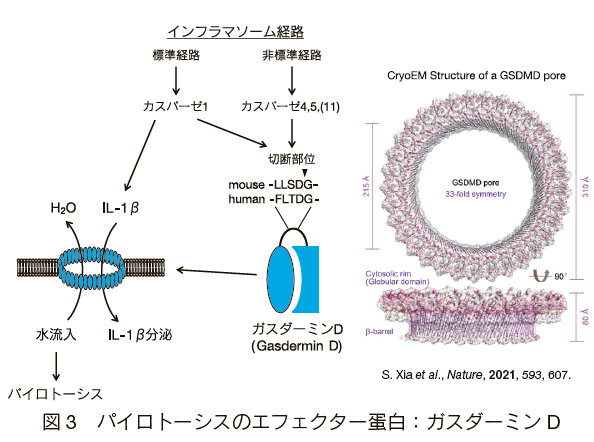
カスパーゼ1/4/5/11がパイロトーシスを誘導するのは、これらのカスパーゼがガスダーミンファミリーに属するガスダーミンDと呼ばれる共通のエフェクター分子を切断することで、細胞死を誘導するためである(図3)11)12)。 ガスダーミンDは53kDaの細胞内蛋白質で、N末ドメインとC末ドメインの間のリンカー領域でカスパーゼ1/4/5/11により切断される。
切断されたN末ドメイン(~31kDa)が多量体化し、細胞膜に孔を形成することでパイロトーシスを誘導する。ガスダーミンDのC末ドメインのみを過剰発現させるとパイロトーシスを抑制することから、普段はC末ドメインがN末ドメインの機能を抑制していると考えられる。
クリオ電子顕微鏡で描出されたガスダーミンDの孔は33回対称性を示すことから、33量体で内径21.5nmの孔を形成すると予想されている13)。この孔径は水やイオンばかりでなく、成熟型のIL-1β(分子径約4.5 nm)などのサイトカインも通過しうる。
非標準的インフラマソーム経路におけるNLRP3の活性化にはガスダーミンDが必要である。また、この経路でのIL-1βの分泌は細胞外K+濃度を高くすると抑制される。 これらの事実から、非標準的インフラマソーム経路におけるNLRP3 の活性化は、ガスダーミンD が形成する孔からK+イオンが流出することで誘導されると考えられる。
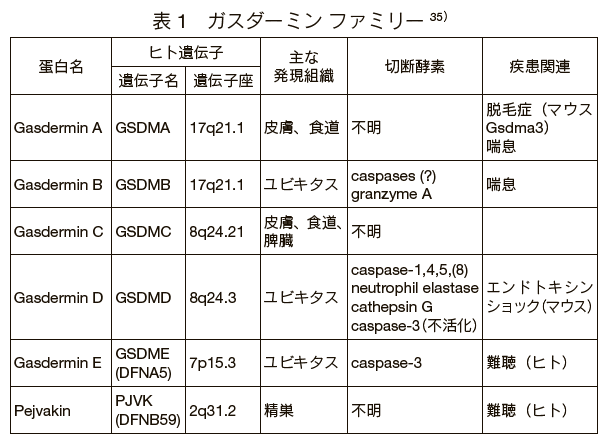
ガスダーミンDはガスダーミンファミリーに属する分子で、このファミリーは、ヒトではガスダーミンA、B、C、D、Eおよびペジバキン(Pejvakin)の6種類の蛋白からなる14)(表1)。 マウスはガスダーミンAのパラログが3種類、ガスダーミンCのパラログが4種類存在する一方、ガスダーミンBは存在しない。
このファミリーのメンバーは、N末ドメインとC末ドメインが短いリンカー領域でつながれた構造を持つ。 リンカー領域はファミリー間で相同性に乏しく、それぞれ異なるメカニズムで活性化されると考えられる。 ガスダーミンD以外のメンバーも、ペジバキンを除き、孔形成領域のみを細胞に発現させると、ネクローシス様の細胞死を誘導する15)。 そのため、Shaoらは、ガスダーミンファミリーが誘導する細胞死をパイロトーシスと呼ぶことを提唱している。
3. パイロトーシスの生理的役割
パイロトーシスの最も重要な役割は、病原体からの生体防御であると考えられる。 病原体に寄生された細胞が死ぬこと自体、病原体が増殖する場を消去することにつながるため、生体防御に役立つと考えられる。
さらに、パイロトーシス細胞からはIL-1β、IL-18、IL-1α、IL-33などのサイトカイン、プロスタグランジンやロイコトリエンなどのエイコサノイド、HMGB1やATPなどのDAMPsが放出される。 これら多様な炎症誘導因子も自然免疫応答を活性化し、感染防御に寄与すると考えられる。
腸管上皮細胞もサルモネラ菌の感染でNLRC4インフラマソーム依存性のパイロトーシスを起こす16)。 また、パイロトーシスを起こした上皮細胞からはIL-18やプロスタグランジンE2が放出される。 マクロファージを含むミエロイド系細胞にNLRC4が発現していても、腸管上皮細胞のNLRC4が発現していないと、腸管のサルモネラ菌排除効率が低下する。 従って、腸管上皮のパイロトーシスは腸管局所におけるサルモネラ菌感染防御に寄与していると考えられる。
4. 疾患とのかかわり
HIVの不稔性感染によるCD4陽性T細胞の死はIFI16依存性のパイロトーシスであると報告されている17)。 CD4陽性T細胞の減少はエイズにおける免疫不全病態の最大の原因であり、これは疾患にかかわるパイロトーシスの一例である。 また、インフラマソーム構成分子やカスパーゼ11、ガスダーミンDの欠損マウスは致死性エンドトキシンショックに抵抗性であることから7)11)18)-20)、パイロトーシスは敗血症に寄与すると考えられる。 ガスダーミンAおよびBの遺伝型が喘息に関与すること、ガスダーミンEとペジバキンの突然変異が難聴の原因となることなどが知られているが(表1)、パイロトーシスとの関連は不明である21)-23)。
種々のインフラマソーム形成蛋白の突然変異は自己炎症性疾患の原因となることが知られている(表2)24)。 自己炎症性疾患とは、感染等の明瞭な原因がないのに自然免疫応答が活性化し、周期性の発熱や多発性の炎症性疾患を発症する疾患群である。 NLRP3やPyrinの突然変異による自己炎症性疾患に対してはIL-1βの阻害薬が有効であるため、パイロトーシスによるIL-1βの過剰産生がこれらの疾患の発症に重要な役割をはたしていると考えられる。
NLRP3は様々な生体物質や外来物質に応答するため、痛風、偽痛風、動脈硬化、石綿肺症、珪肺症、アルツハイマー病、糖尿病など多彩な疾患との関連が示唆されている25)-32)(表3)。


5.アポトーシス細胞のセカンダリーネクローシスもパイロトーシス
アポトーシス細胞は細胞膜のバリア機能を維持したままマクロファージによって速やかに貪食されるため、通常は細胞内成分があまり放出されない。 これは、発生過程や健康な状態で起きるアポトーシスで不要な炎症や自己免疫応答が誘導されないようにするための、アポトーシスの重要な特性である。
ただし、試験管内などマクロファージが存在しない状況、あるいは生体内でも一度に大量の細胞がアポトーシスを起こしてマクロファージの処理能力を超えてしまった状況では、貪食されずに放置されたアポトーシス細胞は、ついには細胞膜の浸透圧調整機能が破綻して水分が流入し、破裂してしまう。これがセカンダリーネクローシスのメカニズムと考えられていた。ところが、この考えに修正が必要となってきた。
最近、試験管内でアポトーシスを誘導した細胞では、カスパーゼ3によってガスダーミンEが切断され、ネクローシス様の細胞死を誘導することが明らかにされた33)34)(表1)。 ガスダーミンEの欠損細胞にアポトーシスを誘導すると、ブレビングやアポトーシス小体の形成は正常に起きるが、セカンダリーネクローシスは抑制される。
つまり、これまで単にアポトーシスに伴う受動的な現象と考えられてきたセカンダリーネクローシスは、実は、パイロトーシス様のプログラムされたイベントだったというわけである。 アポトーシス細胞は放っておいてもいずれ死んでネクローシスを起こすと考えられるのに、なぜ積極的にセカンダリーネクローシスを誘導する必要があるのだろうか。
貪食されないアポトーシス細胞を放置せず、あまり時間を置かずにネクローシスを起こすことに何らかのメリットがある可能性はある。 セカンダリーネクローシスに伴って、少なくともDAMPsは放出されるので、それなりに炎症が誘導され、不足している貪食細胞を呼び寄せることができるのかもしれない。
おわりに
パイロトーシスは当初「カスパーゼ1依存性の炎症誘導性プログラム細胞死」と捉えられていたが、ガスダーミンDの発見を切っ掛けに、パイロトーシスは「ガスダーミンが細胞膜に穴をあけることによる細胞死」と再定義されつつある。 ガスダーミンファミリーの他のメンバーも異なるメカニズムで活性化されてパイロトーシスを誘導することが明らかになりつつあり、パイロトーシスの研究分野はさらに拡大していくことが予想される。 また、様々な疾患との関連が明らかになったことで、治療薬の開発を視野に入れたパイロトーシスの制御法の研究にも拍車がかかると思われる。 この分野への参入を考えていらっしゃる方に、本稿が少しでも参考になれば幸いである。
| [ 著者プロフィール ] | |
| 氏名 | 須田 貴司 (SUDA Takashi) |
|---|---|
| 所属 |
金沢大学がん進展制御研究所 免疫炎症制御研究分野 〒920-1192 石川県金沢市角間町 Tel:076-264-6720 研究室ホームページ: http://dimb.w3.kanazawa-u.ac.jp/ |
| 出身学校 | 大阪大学 大学院医学系研究科 |
| 学位 | 博士(医学) |
| 専門分野 | がん、免疫、プログラム細胞死 |
