CLAMP F405-Signal Boosting

免疫染色用青色蛍光基質
- 表面抗原の発現量を高感度に測定可能
- 高い選択性と滞留性を実現した染色技術
-
製品コードC554 CLAMP F405-Signal Boosting
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 10 μl | ¥55,100 | 342-09991 |
性質
細胞の特徴を解析するために、抗体を用いた表面抗原の検出法が汎用されており、サンプルに含まれる細胞のタイプの特定や、異常な細胞の検出などに用いられています。表面抗原の検出、すなわち細胞表面タンパク質の特異的検出には、蛍光標識抗体を用いた方法が広く利用されてい ますが、発現量の少ない表面抗原に対してこの方法は感度が低く、適用が困難な場合があります。
CLAMP F405-Signal Boostingは、既存品の課題である検出感度を解決した色素です。
※本製品は九州大学の片山佳樹先生から技術指導、情報提供いただき開発した製品です。
マニュアル
技術情報
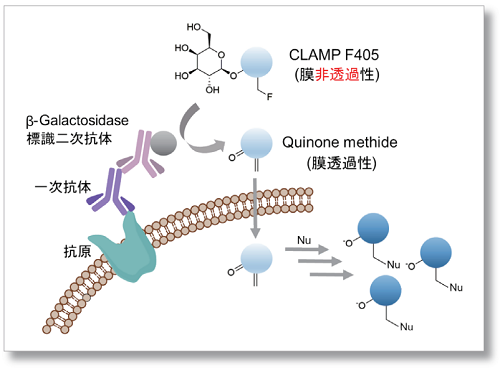
測定原理
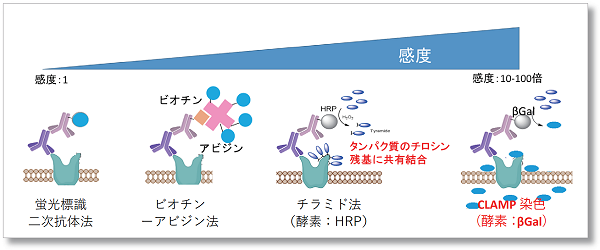
本技術では、細胞表面タンパク質に対する一次抗体、 β-Galactosidase標識二次抗体、およびβ-Galactosidaseの蛍光基質CLAMP F405を使用します。この蛍光基質は、無蛍光で細胞膜非透過性という性質を有しております。細胞表面タンパク質を介して細胞表面にβ-ガラクトシダーゼが存在すると、この蛍光基質が反応して、キノンメチド構造を有する化合物を生成します。この反応生成物は細胞膜透過性を有しているため、細胞内に入り込み、細胞内のチオールやアミノ基などと反応して共有結合を形成し、蛍光を発します。この反応は抗原の量に依存したβ-Galactosidaseの存在により、色素が反応し細胞内に蓄積していきます。
このようなメカニズムで、細胞表面タンパク質特異的かつ低発現な抗原に対しても高感度に細胞を蛍光染色することが可能となります。
参考文献:Noguchi, K. et al., “β-Galactosidase-Catalyzed Fluorescent Reporter Labeling of Living Cells for Sensitive Detection of Cell Surface Antigens”, Bioconjugate Chem., 2020, 31(7), 1740–1744.
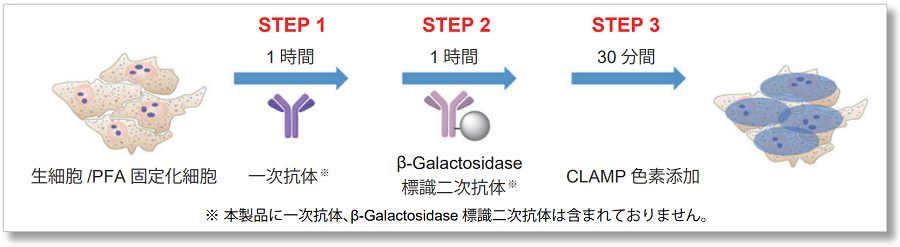
簡単な操作で高感度検出
操作は一般的な二次抗体法と同じです。目的のタンパク質を認識する一次抗体を標識後、βガラクトシダーゼ標識二次抗体を標識し、染色液を添加するだけで検出が可能です。

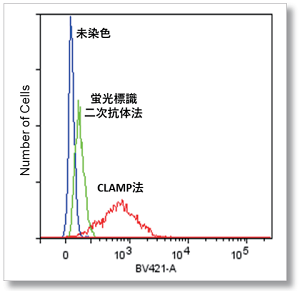
使用細胞:HeLa 細胞 抗原:CD44
検出装置:(左) 蛍光顕微鏡 Ex = 340 - 380 nm, Em = 435 - 485 nm
(右) フローサイトメーター Ex = 405 nm, Em = 425 - 575 nm
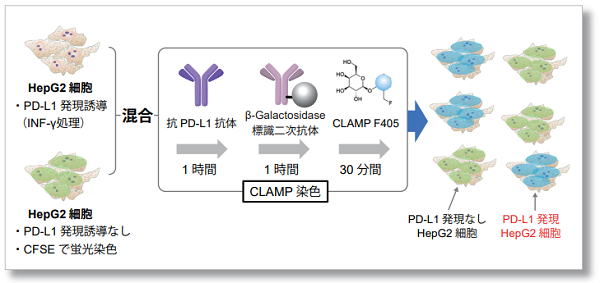
実験例:PD-L1発現HepG2細胞の染色例
PD-L1発現誘導させたHepG2細胞とCFSEで染色したコントロール細胞を準備し、この二つの細胞を混合したサンプルをCLAMP法を用いてPD-L1発現細胞の検出を行いました。CLAMP法にて染色された細胞はCFSE染色細胞とは局在が一致せず、しっかりと染め分けていることが確認できました。これにより、二次抗体法では検出困難であったHepG2細胞のPD-L1発現を正確に染め分けられていることが分かりました。
※CFSE: 5- or 6-(N-Succinimidyloxycarbonyl)fluorescein 3‘,6’-diacetate
<操作手順>
・付着細胞の場合
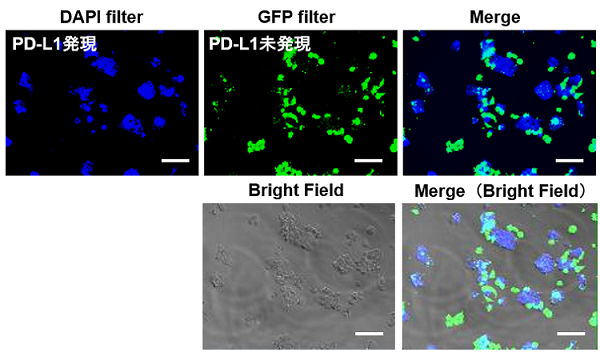
細胞が隣り合う状況においても、PD-L1発現細胞のみが染色され、その他の細胞への誤染色は確認されませんでした。


・シングルセル解析例 [SIEVEWELLTM(東京応化工業株式会社)]

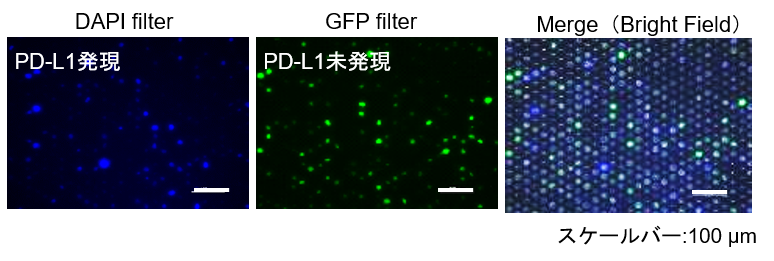
シングルセルに分離・培養可能なSIEVEWELLTMとCLAMP染色法を組み合わせることで目的の細胞を高精度に分離できます。また、細胞ピッキングシステムを併用することで、希少な細胞の分離や、より厳密な細胞の分離が期待されます。
詳細は東京応化工業株式会社様のWebページをご参照ください。https://www.sievewell.com/ja/how-it-works
実験例:FFPE組織切片-ヒト小腸での測定実績
ヒト小腸のFFPE組織切片上でαSMA(α-smooth muscle actin)とケラチンを、それぞれCLAMP法とチラミド法(TSA法: Tyramide signal amplification)で検出しました。結果、鮮明に染め分けができており、他の染色法との多重染色が可能であることが分かりました。組織切片のCLAMP法に関する詳細なプロトコルは参考文献の1をご参照ください。
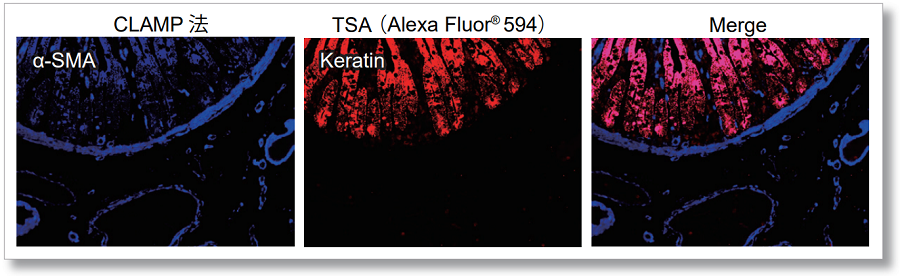
※画像提供:京都大学医学部附属病院病理診断科 平田勝啓先生
各プロトコルの具体的な実験例
-
プロトコル1(実験例:HeLa細胞のCD44抗原の高感度染色)
-
取扱説明書のプロトコル1に則り、本色素を用いてHeLa細胞のCD44抗原を生細胞の条件にて検出しました。結果、染色していない群と明瞭な蛍光輝度の差が観察され、高感度に表面抗原の検出ができることがわかりました。
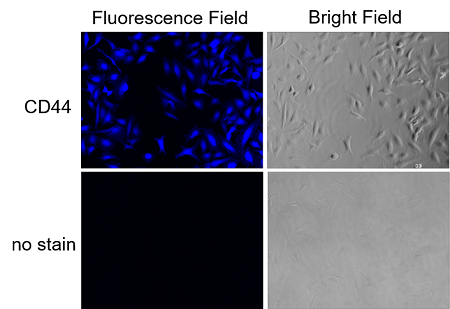
<実験操作> 1. 96-well マイクロプレートにHeLa細胞懸濁液(1 x 105 cell/ml)を100 μl/wellで播種し、5% CO2 インキュベーター(37℃)内で一晩培養した。 2. 上清を除去した後、MEM (10% FBS) 100 μlで2回洗浄した。 3. 2 μg/ml 抗CD44抗体 (ab189524、Abcam社) /MEM (10% FBS) 100 μlを加え、5% CO2 インキュベーター(37℃)内で 1 時間静置した。 4. 上清を除去した後、MEM (10% FBS) 100 μlで2回洗浄した。 5. x500 β-Galactosidase標識抗ウサギ抗体(ab136774, Abcam社)/MEM (10% FBS) 100 μlを加え、5% CO2 インキュベーター(37℃)内で 1 時間静置した。 6. 上清を除去した後、HBSS 100 μl で2回洗浄した。 7. Staining Solution 100 μlを加え、 5% CO2 インキュベーター(37℃)内で 30分間静置した。 8. 上清を除去した後、HBSS 100 μl で3回洗浄した。 9. 蛍光顕微鏡で観察した。(DAPI filter: Ex = 320-360 nm, Em = 435-480 nm)
-
プロトコル2 (実験例:フローサイトメーターを用いたHeLa細胞のCD44抗原の検出)
-
取扱説明書プロトコル2の操作に則り、HeLa細胞のCD44抗原をフローサイトメーターを用いて測定しました。その際、比較対象として蛍光2次抗体法と比較を行いました。結果、フローサイトメーターを用いて高感度に測定可能であることがわかりました。
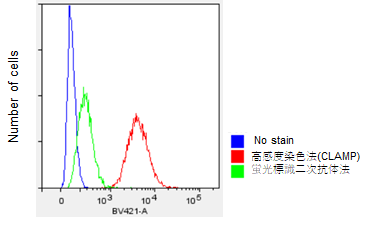
<実験操作> 1. MEM培地(10% FBS)で培養したHeLa細胞をスクレーパーにより回収し、マイクロチューブに2 x 105 cells/tubeになるように分注した。 2. 300 x gで5分間遠心し、上清を除去した。 3. 2 μg/ml ウサギ抗CD44抗体(ab189524, abcam社)/MEM培地(10% FBS)500 μlを加え、ピペッティングにより懸濁した。 4. 37℃、1時間静置した。 5. 洗浄工程を行った。 I. 300 x gで5分間遠心し、上清を除去した。 II. MEM培地(10% FBS)500 μl を加え、ピペッティングにより懸濁した。 III. 300 x gで5分間遠心し、上清を除去した。 IV. ステップII - IIIをもう一度行った。 6. x500 β-Galactosidase標識抗ウサギ抗体 (ab16774、Abcam社) /MEM培地(10% FBS)500 μlを加え,ピペッティングにより懸濁した。(蛍光標識二次抗体法としてはAlexa Fluor405標識抗ウサギ抗体 (ab175652, Abcam社) を用いた。) 7. 37℃で一時間静置した。 8. 操作5と同じ洗浄工程を行った。(MEM(10% FBS)をHBSSに変更した。) 9. Staining Solution Floating 500 μlを加え、ピペッティングにより懸濁した。 10. 37℃で30分間チューブローテーター(RVM-101、サイニクス社)で攪拌した。 11. 300 x gで5分間遠心し、上清を除去した。 12. HBSS 500 μl を添加し、ピペッティングにより懸濁した。 13. フローサイトメーター(LSR Fortessa X-20、BD社製)で測定した。 ※BV421 filter set (Ex:405 nm, Em:430-470 nm) で測定した。
-
プロトコル3 (実験例:固定HeLa細胞のCD44抗原の高感度染色)
-
取扱説明書のプロトコル3に則り、本色素を用いて固定HeLa細胞のCD44抗原を生細胞の条件にて検出しました。結果、染色していない群と明瞭な蛍光輝度の差が観察され、高感度に表面抗原の検出ができることがわかりました。

<実験操作> PFA固定細胞の準備
1. 96-well マイクロプレートにHeLa細胞懸濁液(1 x 105 cell/ml)を100 μl/wellで播種した。 2. 37℃、5% CO2インキュベーターで一晩インキュベートした。 3. 上清を除去した後、PBS 100 μlで2回洗浄した。 4. 4% PFA/PBS 100 μl を加え、室温で30分間静置した。 5. 上清を除去した後、0.1% Triton-X100/PBS 100 μlを加え、室温で30分間静置した。 6. 上清を除去した後、Blocking Buffer (10% Blocking One/PBS) 100 μlを加え、室温で30分間静置した。 染色工程
1. 上清を除去した後、2 μg/ml 抗CD44抗体 (ab189524, Abcam社) /Blocking Buffer 100 μlを加え、室温で1時間静置した。 2. 上清を除去した後、Blocking Buffer 100 μlで2回洗浄した。 3. x500 β-Galactosidase標識抗ウサギ抗体 (ab16774、Abcam社) /Blocking Buffer 100 μlを加え、室温で1時間静置した。 4. 上清を除去した後、Blocking Buffer 100 μlで2回洗浄した。 5. Staining Solution 100 μlを加え、37℃で30分間静置した。 6. 上清を除去した後、PBS 100 μlで3回洗浄した。 7. 蛍光顕微鏡で観察した。(DAPI filter: Ex = 320-360 nm, Em = 435-480 nm)
-
プロトコル4 (実験例:固定MOLT4細胞のPD1抗原の高感度染色及び蛍光二次抗体法との比較)
-
取扱説明書プロトコル4の操作に則り、固定MOLT4細胞のPD1抗原をフローサイトメーターを用いて測定しました。その際、比較対象として蛍光2次抗体法と比較を行いました。結果、フローサイトメーターを用いて高感度に測定可能であることがわかりました。
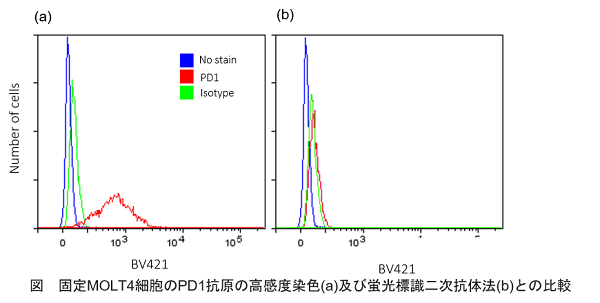
<実験操作> PFA固定MOLT4細胞の準備
1. 1.5 ml マイクロチューブにMOLT4細胞の細胞懸濁液 (2 x 105 cells/tube)を準備した。 2. 300 x gで5分間遠心し、上清を除去した。 3. 4% PFA/PBS 500 μlを加え、ピペッティングにより懸濁した。 4. 室温で30分間静置した後、300 x gで5分間遠心した。 5. 上清を除去した後、0.1% TritonX-100/PBS 500 μlを加え、ピペッティングにより懸濁した。 6. 室温で30分間静置した後、300 x gで5分間遠心した。 7. 上清を除去した後、Blocking Buffer (10% Blocking One/PBS) 500 μlを加え、ピペッティングにより懸濁した。 8. 上清を除去した後、HBSS 100 μl で3回洗浄した。 9. 室温で30分間静置し、300 x gで5分間遠心した後、上清を除去し、染色工程に使用した。 染色工程
1. 1 μg/ml マウス 抗PD1抗体(ab52587, abcam社)/Blocking Buffer 500 μlを加え、ピペッティングにより懸濁した。(IsotypeはIgG1KAPPA Isotype control (401408、 BioLegend社)を用いた。) 2. 室温で1時間静置した。 3. 下記洗浄工程を行った。 I. 300 x gで5分間遠心し、上清を除去する。 II. Blocking Buffer 500 μl を加え、ピペッティングにより懸濁する。 III. 300 x gで5分間遠心し、上清を除去する。 IV. ステップII - IIIをもう一度行う。 4. X3,000 β-Galactosidase-標識抗マウス抗体(ab136775、 Abcam社) /Blocking Solution 500 μlを加え、ピペッティングにより懸濁した。(蛍光標識二次抗体法としてはx3,000 Alexa Fluor 405標識抗マウス抗体(ab175660、Abcam社)を用いた。 5. 室温で1時間静置した。 6. 操作3と同じ洗浄工程を行った。 7. Staining Solution Floating 500 μlを加え,ピペッティングにより懸濁した。 8. 37℃で30分間チューブローテーターで攪拌した。 9. 300 x gで5分間遠心し、上清を除去する。 10. Blocking Buffer 500 μlを加え、ピペッティングにより懸濁した。 11. フローサイトメーター(LSR Fortessa X-20、BD社製)で測定した。 ※ BV421 filter set (Ex:405 nm, Em:430-470 nm) で測定した。
-
プロトコル5 (実験例:マウス肝臓凍結組織切片のActinの高感度染色)
-
取扱説明書プロトコル5の操作に則り、マウス肝臓凍結組織切片のActinを蛍光顕微鏡を用いて測定しました。その際、比較対象として1次抗体不使用時のCLAMP法と通常のCLAMP法を比較しました。結果、CLAMP法は高感度かつ選択的にActin染色が測定可能であることがわかりました。
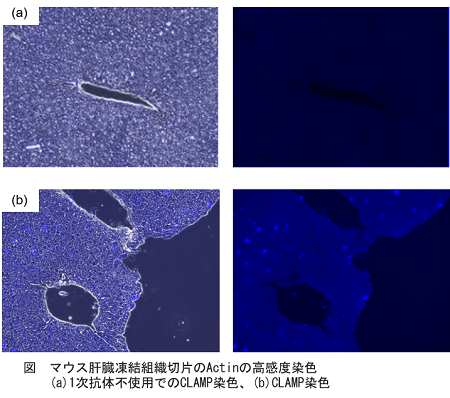
<実験操作> PFA固定
1. 凍結組織切片/スライドガラスを常温に戻した。 2. 組織切片の周囲に撥水ペンを用いて境界を描いた。 3. 4% PFA/PBS 100 μlを添加し、室温で30分間静置した。 4. 溶液を除去した後、0.1% Triton-X100/PBS 100 μlを添加し、室温で30分間静置した。 5. 溶液を除去した後、Blocking Buffer (10% Blocking One/PBS) 100 μlを添加し、室温で30分間静置した。 染色工程
1. 溶液を除去した後、2 μg/ml 抗actin抗体 (GTX109639、GeneTex社)/Blocking Buffer 100 μlを添加し、室温で1時間静置した。 2. 溶液を除去した後、Blocking Buffer 100 μlで2回洗浄した。 3. x500 β-Galactosidase標識抗ウサギ抗体 (ab16774、Abcam社)/Blocking Buffer 100 μlを加え、室温で1時間静置した。 4. 溶液を除去した後、Blocking Buffer 100 μlで2回洗浄した。 5. Staining Solution 100 μlを添加し、37℃で30分間静置した。 6. 溶液を除去した後、PBS 100 μlで3回洗浄した。 7. 蛍光顕微鏡で観察した。(DAPI filter: Ex = 320-360 nm, Em = 435-480 nm)
-
プロトコル6 (実験例:マウス肝臓FFPE組織切片のActinの高感度染色)
-
取扱説明書プロトコル6の操作に則り、マウス肝臓FFPE組織切片のActinを蛍光顕微鏡を用いて測定しました。その際、比較対象として1次抗体不使用時のCLAMP法と通常のCLAMP法を比較しました。結果、CLAMP法は高感度かつ選択的にActin染色が測定可能であることがわかりました。
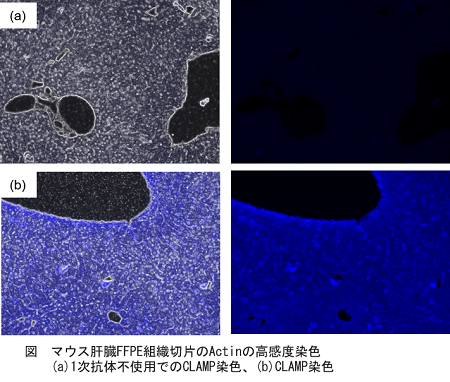
<実験操作> 抗原の賦活化
1. FFPE組織切片/スライドガラスを用意した。 2. 60℃で 1時間静置した。 3. 室温で15分間静置した。
※ 以下の作業工程では、湿潤器を用いて切片を乾燥させないようにした。4. レモゾールに室温で 5 分間浸漬した。この操作をもう一度行った。 5. エタノールに室温で5分間浸漬した。 6. 90% エタノールに室温で5分間浸漬した。 7. 80% エタノールに室温で5分間浸漬した。 8. 超純水、PBSの順で浸漬し洗浄した。 9. 抗原賦活化液 (pH9)に浸漬し、95℃で40分間加温した (電気圧力鍋使用)。 10. 室温で1時間静置した。 11. 超純水、PBSの順で浸漬し洗浄した。 染色操作
1. 組織切片の周囲に撥水ペンを用いて境界を作った。 2. Blocking Buffer 100 μlを添加し、室温で30 分間静置した。 3. 溶液を除去した後、2 μg/ml 抗actin抗体 (GTX109639、GeneTex社) /Blocking Buffer 100 μl を添加し室温で1時間静置した。 4. 溶液を除去した後、PBS 100 μl を添加し3分間静置することで洗浄した。この操作をさらに2回行った。 5. x500 β-Galactosidase標識抗ウサギ二次抗体 (ab16774、Abcam社) /Blocking Buffer 100 μlを加え、室温で1時間静置した。 6. 溶液を除去した後、PBS 100 μl を添加し3分間静置することで洗浄した。この操作をさらに2回行った。 7. Staining Solution 100 μlを添加し 37℃で 30分間静置した。 8. 溶液を除去した後、PBS 100 μl を添加し3分間静置することで洗浄した。この操作をさらに2回行った。 9. 蛍光顕微鏡で観察した。
参考文献
| 文献No. | 対象サンプル | 引用(リンク) |
|---|---|---|
| 1 | 組織 (ヒト扁桃腺、 十二指腸) |
Hirata, M., et al. "Galactosidase-catalyzed fluorescence amplification method (GAFAM): sensitive fluorescent immunohistochemistry using novel fluorogenic β-galactosidase substrates and its application in multiplex immunostaining." Histochem Cell Biol (2022). DOI:10.1007/s00418-022-02162-5. |
よくある質問
-
Q
染色実績のある細胞種、抗原を教えてください。
-
A
下記実績がございます。
サンプルの種類 測定対象 測定抗原 測定方法 Cells HeLa cells CD44, GLUT1 蛍光イメージング、FCM Cells HeLa cells CD63, CD9 蛍光イメージング Cells A549 cells CD44 蛍光イメージング Cells HepG2 cells PD-L1 蛍光イメージング Cells HL60 cells CD44, CD33 蛍光イメージング、FCM Cells MOLT4 cells PD-1, CD44 FCM Cells T2 cells 自己抗体 FCM Cells myocyte cells 自己抗体 蛍光イメージング Cells bjab cells classI抗原 蛍光イメージング Cells 赤血球 表面抗原 FCM Cells マクロファージ化
させたTHP-1 細胞ABCA 1 蛍光イメージング tissue FFPE組織切片
(マウス:肝臓)Actin 蛍光イメージング tissue FFPE組織切片
(ヒト:腎臓)Actin 蛍光イメージング tissue FFPE組織切片
(ヒト:大腸、肺)p16 蛍光イメージング tissue FFPE組織切片
(ヒト:小腸)CD45,α-SMA 蛍光イメージング tissue 凍結組織切片
(マウス:脳)Iba1 蛍光イメージング
-
Q
染色したサンプルは、保存できますか。
-
A
生細胞の場合、染色後にPFA固定後、PBS中で冷蔵1週間保存可能です。また、固定細胞は染色後、PBS中で冷蔵1週間保存可能です。
-
Q
内在性のβGalactosidaseは影響しませんか。
-
A
生細胞の場合、CLAMP F405は膜透過性がないため、内在性のβGalactosidaseと反応しません。また、固定細胞・組織の場合、PBS中での染色を行う条件ではバックグラウンド蛍光の上昇は見られません。
-
Q
βGal標識二次抗体は入手可能ですか。
-
A
弊社では、一次抗体やβ-galactosidase標識抗体は販売しておりません。下記に使用実績のある抗体を示します。
Origin Company Catalog# human arigo biolaboratories ARG21670 mouse arigo biolaboratories ARG21521 Human arigo biolaboratories ARG23882 human arigo biolaboratories ARG24060 rat arigo biolaboratories ARG21691 mouse abcam ab136775 rat abcam ab136716 goat abcam ab136712 rabbit abcam ab136774 mouse abcam ab130781 mouse southernbiotech 1010-06 mouse southernbiotech 1020-06 mouse southernbiotech 1030-06 human southernbiotech 2010-06 human southernbiotech 2040-06 human southernbiotech 2060-06 rat southernbiotech 3030-06 rabbit southernbiotech 4010-06 mouse sigma aldrich 401607
-
Q
Staining SolutionをPBS, HBSS以外で調製することは可能ですか。
-
A
中性以外の緩衝液や培地等を用いた場合、染色反応に影響があるため使用できません。
-
Q
推奨の測定条件を教えてください。
-
A
落射型顕微鏡の場合:DAPI filter 励起フィルター320-380 nm, 蛍光フィルター435-485 nm
共焦点顕微鏡の場合:Ex = 405 nm, Em = 425-475 nm
フローサイトメーターの場合:励起 405nm、蛍光フィルター:BV421, Pacific Blue (450/50 nm)
-
Q
CLAMP F405-Signal Boosting のDMSO溶液は、凍結融解を繰り返しても安定ですか。
-
A
20回まで凍結融解を行っても性能に影響しないことを確認しております。
-
Q
Staining Solution は調製して保存できますか。
-
A
Staining Solutionは保存できません。用時調製してください。
-
Q
バックグラウンド蛍光が高い場合はどうすればいいですか。
-
A
マニュアルに記載している“抗体濃度の検討”に従い、適切な一次抗体・二次抗体の濃度を選択してください。また、浮遊細胞を染色する場合には、チューブローテーターなどを用いて懸濁状態を維持しながら染色することにより、バックグラウンドを下げることが可能です。
-
Q
蛍光が観察されない場合は、どうすればいいですか。
-
A
Staining Solutionを改めて調製し、37℃で30-60分染色を行ってください。それでも蛍光が観察されない場合、一次/二次抗体の濃度が適切でなかった可能性がありますので、マニュアルに記載している“抗体濃度の検討”に従い、適切な抗体濃度を選択してください。