DPPH Antioxidant Assay Kit

抗酸化能測定キット
- キット化したDPPH法で抗酸化能を再現よく検出
- 試薬の調製手間を大幅削減
- 再現性の高いデータを実現
- 従来の課題を解決
-
製品コードD678 DPPH Antioxidant Assay Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 tests | ¥8,000 | 347-09561 |
| 500 tests | ¥23,700 | 343-09563 |
| 100 tests | ・DPPH Reagent ・Trolox Standard ・Assay Buffer |
×1 ×1 11 ml×1 |
|---|---|---|
| 500 tests | ・DPPH Reagent ・Trolox Standard ・Assay Buffer |
×5 ×5 55 ml×1 |
-

食品機能評価 微生物検出 食品機能評価、微生物検出関連の製品を一冊に集約。
〇食品機能評価・抗酸化能測定・ACE阻害性活性・脂肪滴染色蛍光試薬・老化細胞検出
〇微生物検出・微生物染色試薬・微生物増殖アッセイキット
性質
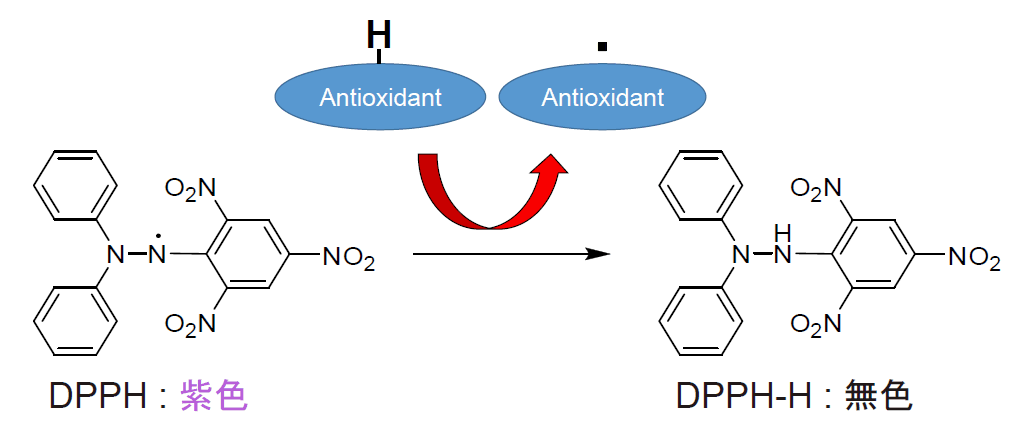
近年、体内の抗酸化力低下が様々な疾患の発症や健康障害に関与していることが示唆されており、抗酸化活性を有する食品(抗酸化食品)への期待が増えています。高知大学の島村らは、測定施設間差の少ない抗酸化活性評価法としてDPPH (2,2-Diphenyl-1-picrylhydrazyl)を用いた測定法を報告しています1)。本製品は島村らの測定法に準拠したマイクロプレート法による評価法です。DPPH による測定法をマニュアル化し、また安定した一定品質の試薬をキット化することで、これまで課題となっていたデータのバラつきや試薬調製の煩雑さを抑えることができました。
本製品は、高知大学 農林海洋科学部 農芸化学科 島村智子先生のご指導の下、製品化しました。
1) T. Shimamura et al., Anal. Sci., 2014, 30, 717 - 721
マニュアル
技術情報
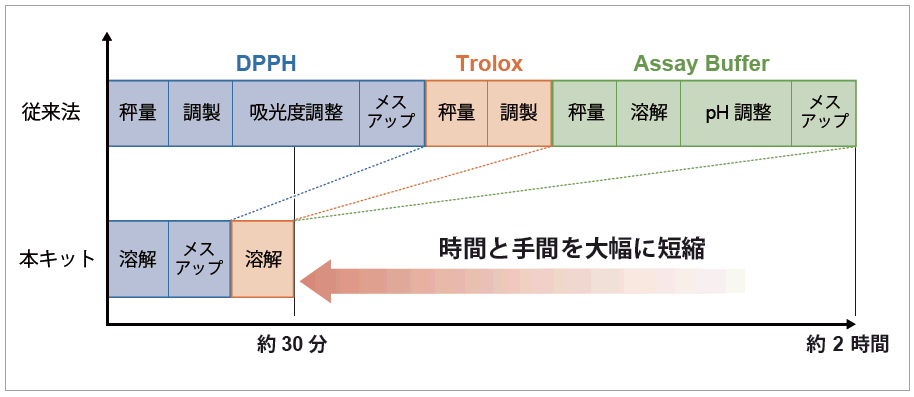
簡単な準備
DPPH およびTrolox は溶液状態で不安定なため用時調製が必要ですが、特に測定に影響を与えるDPPH は、吸光度による含量確認まで行う必要があり、試薬調製には長い時間を要していました。本キットでは測定に必要な試薬が小分けされており、測定前の簡単な準備で、直ぐに実験を開始できます。
(DPPH の溶解操作には超音波洗浄機が必要です)
測定原理
測定方法
96 穴マイクロプレートに試薬とサンプルを添加し、30 分間反応するだけの簡単な操作です。
従来の課題を解決
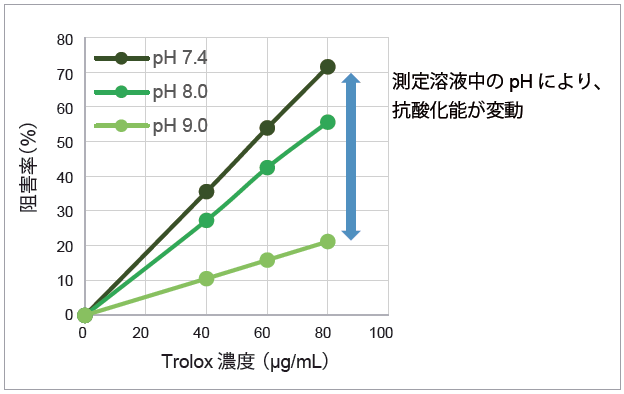
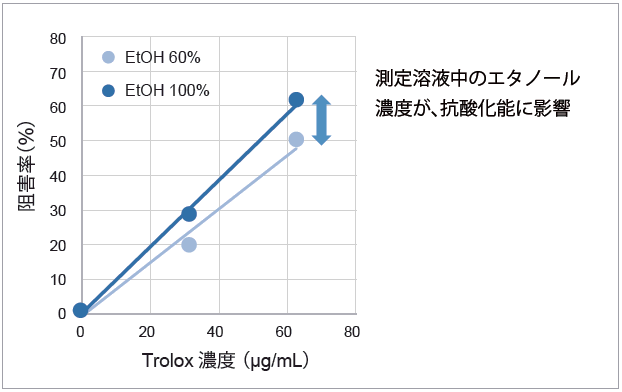
DPPH による抗酸化活性の測定では、溶液中のpH や溶媒濃度が測定に影響します。本製品では、これらの影響を最小限に抑えるためのプロトコルと解析法を採用しています。
|
測定時のpHによる影響 |
サンプル溶媒の影響 |
IC50値のばらつき
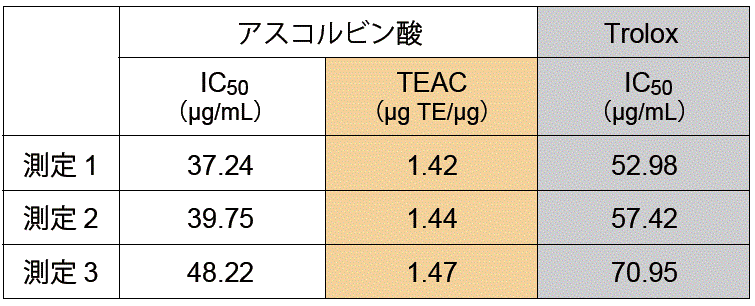
サンプルの抗酸化能をIC50 値のみで解析すると、僅かな測定条件の差でデータがばらつきます。
標準物質(Trolox)をサンプルと同時に測定し、抗酸化能をTrolox等価活性値(TEAC)として算出することで、再現性の高い測定値が得られます。
TEAC( μg TE/μg)= Trolox IC50 (μg/ml)/ Sample IC50( μg/ml)
測定例
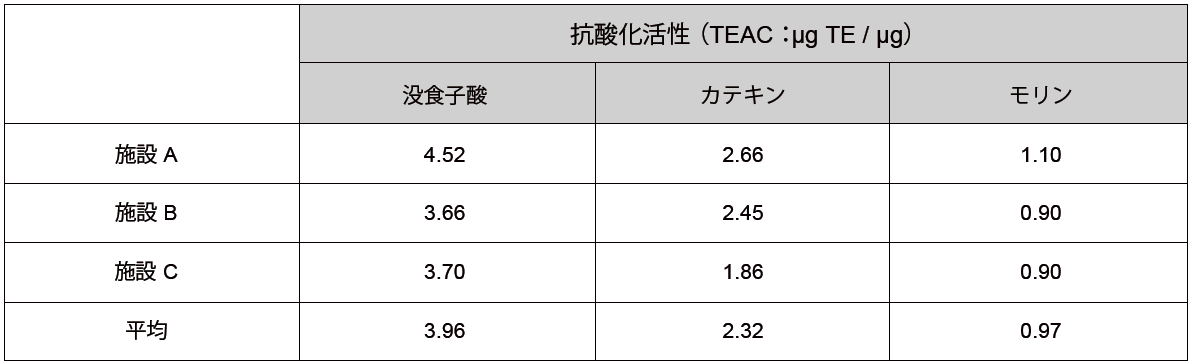
施設間差の確認
3 施設において、本DPPH 法による抗酸化物質の測定を行いました。実験では、既知の抗酸化物質である没食子酸、カテキン、モリンをサンプルとしてキュベットを用いた分光光度計による測定を行い、Trolox 等価活性値(TEAC)として算出しました。結果、施設間で測定値の差は殆どみられませんでした。
参照元:T. Shimamura et al., NipponShokuhin Kagaku Kogaku Kaishi, 2007, 54, 482 - 487
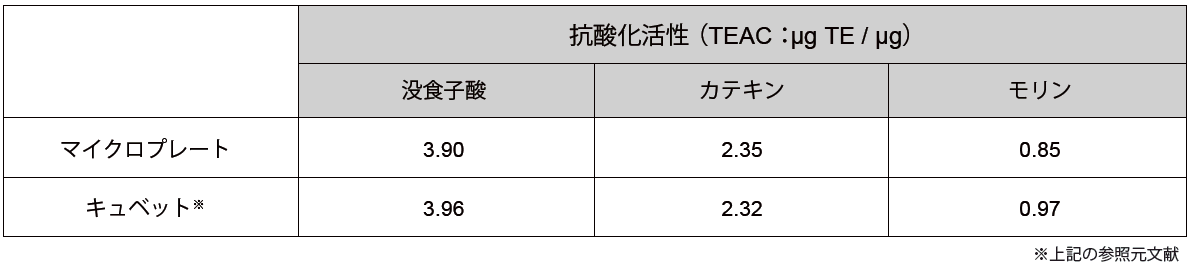
マイクロプレートとキュベットによるデータの相関
上記の実験と同様に、3 種類の抗酸化物質をマイクロプレートを用いて測定し、Trolox 等価活性値として算出しました。結果、測定値はほぼ同等の結果が得られました。本キットではマイクロプレートを用いた測定となります。
参考情報
本製品を使用した食品中のフェノール類のDPPH測定とフェノール化合物の抗酸化活性の機械学習による構造相関による抗酸化能の予測を行なった論文(参考文献9)が公開されました。論文(参考文献7~9)には色々な化合物の測定した値が掲載されています。
技術や使用製品に関する補足
【セミナーアーカイブを配信中です。】
【講演】 90 分
1. 『抗酸化評価法の標準化の試み - キット開発までの道のり -』
2. 『食品成分の構造から考える抗酸化能』
【パネルディスカッション】 60 分
テーマ:食品と化合物の抗酸化測定と機械学習の未来
参考文献
| 文献No. | 対象サンプル | 引用(リンク) |
|---|---|---|
| 1 | 化合物 (芳香族ポリケチド) |
Enjuro Harunari, Chiaki Imada, Yasuhiro Igarashi, "⑯Konamycins A and B and Rubromycins CA1 and CA2, Aromatic Polyketides from the Tunicate-Derived Streptomyces hyaluromycini MB-PO13T", J. Nat. Prod., 2019, 82, (6), 1609-1615. |
| 2 | 農産品抽出物 (ピーマン、生姜、茄子) |
Hiroki Ishida, Naoki Yamasaki, Yuuki Otsuka, Daichi Mori, Tomoko Shimamura, Takuya Hasegawa, Shuhei Ogo, Tadaharu Ueda, "Electrochemical Antioxidant Capacity Measurement: A Downsized System and Its Application to Agricultural Crops", Anal. Sci., 2021, doi:10.2116/analsci.21P217. |
| 3 | 生物活性ペプチド (骨格筋加水分解物) |
M. A. Maky and T. Zendo, "Generation and Characterization of Novel Bioactive Peptides from Fish and Beef Hydrolysates", Appl. Sci., 2021, doi:10.3390/app112110452. |
| 4 | ドーパミン | S. Kato, K. Kuwata, "Pro-/anti-oxidative properties of dopamine on membrane lipid peroxidation upon X-ray irradiation", Radiat. Phys. Chem., 2021, doi:10.1016/j.radphyschem.2021.109518. |
| 5 | 食用キノコ抽出物 | F. F. Sofian, N. Kikuchi, T. Koseki, Y. Kanno, S. Uesugi, Y. Shiono, "Antioxidant p-terphenyl compound, isolated from edible mushroom, Boletopsis leucomelas", Biosci., Biotechnol., Biochem., 2022, doi:10.1093/bbb/zbab224. |
| 6 | コロイド粒子 | S. Jin, S. Kim, D. S. Kim, D. Son and M. Shin, "Optically Anisotropic Topical Hemostatic Coacervate for Naked-Eye Identification of Blood Coagulation", Adv. Funct. Mater., 2022, doi:10.1002/adfm.202110320. |
| 7 | 化合物 (ポリフェノール) |
Moeka Yamauchi, Yukino Kitamura, Haruka Nagano, Junya Kawatsu, Hiroaki Gotoh, "DPPH Measurements and Structure—Activity Relationship Studies on the Antioxidant Capacity of Phenols", Antioxidants, 2024, 13(3), 309. |
| 8 | 化合物 (ポリフェノール) |
Moeka Yamauchi, Yukino Kitamura, Chihiro Tada, Riku Kato, Hiroaki Gotoh "Kinetic and thermodynamic evaluation of antioxidant reactions: factors influencing the radical scavenging properties of phenolic compounds in foods", J. Sci. Food Agric., 2025, 105(14), 8186. |
| 9 | 化合物 (ポリフェノール) |
Kato Riku, Chihiro Tada, Moeka Yamauchi, Yuto Matsumoto, Hiroaki Gotoh. "DPPH Measurement for Phenols and Prediction of Antioxidant Activity of Phenolic Compounds in Food", Curr. Issues Mol. Biol., 2026, 48(1), 12. |
よくある質問
-
Q
IC50値がばらつくのですが、注意点はありますか?
-
A
(1) DPPH Reagentのチューブに溶け残りがないかご確認ください。
DPPHは溶けづらいため超音波洗浄機をお使い頂き、溶け残りなないよう、注意深く溶解して頂く必要があります。
特にチューブ底の先端にDPPHが溶け残ることがありますので、取扱説明書に記載の通り数回エタノールをチューブに移し入れ、エタノールに着色がなくなったことを確認しご使用ください。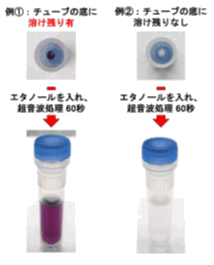
(2) サンプルの希釈間隔が広い場合や、阻害曲線が飽和しているポイント(下図)で測定した場合IC50値が大きく変動することがあります。そのため、予備実験にて最適な濃度域を確認されることをお勧めします。
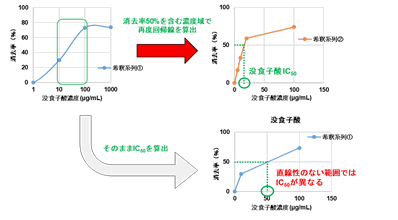
-
Q
ボルテックスやピペッティングでDPPHを溶解しても良いですか?
-
A
DPPHは溶解しにくいため、ボルテックスのみでの溶解やピペッティング操作での溶解はできません。
溶け残りがIC50のばらつきの原因となりますので、必ず超音波洗浄機をお使いください。
-
Q
測定可能なサンプル数について教えて下さい。
-
A
<100 tests使用時>
・本キットは96穴マイクロプレート1枚分を測定できる試薬となります。
・データ信頼性を確保するため、n=3での測定をお勧めしております。そのため、測定可能なサンプル数は、n:3で測定したことを想定し下記の通り算出しています。
・1キットあたりのDPPH Reagent量は100 well分になります。
(Blank2はDPPH Reagentを使用しないため、下記内訳のwell数にはカウントしていません)
未知サンプルの場合: 1サンプル
・小社キットで測定実績がない場合、1キットで1サンプル分の測定が可能です。
<予備実験時の使用ウェル数:最適濃度域の確認>
サンプル:8(8点の希釈系列) X 3(n:3) = 24 well
Blank:1(Blank1) X 3(n:3) = 3 well
<IC50値の算出時の使用ウェル数>
サンプル:8(8点の希釈系列) X 3(n:3) = 24 well
Trolox: 4(4点の希釈系列) X 3(n:3) = 12 well
Blank:1(Blank1) X 3(n:3) = 3 well
*予備実験不要のサンプルの場合、もう1サンプル測定が可能。
IC50値が既知の場合: 3サンプル
・小社キットでIC50値を既に測定した実績のあるサンプルの場合、3サンプルの測定が可能です。
小社キットでIC50値を測定されていない場合は、未知サンプルとして予備実験をされることを推奨いたします。
<IC50値の算出時の使用ウェル数>
サンプル:8(8点の希釈系列) X 3(n:3) X 3(サンプル数) = 72 well
Trolox: 4(4点の希釈系列) X 3(n:3) = 12 well
Blank:1(Blank1) X 3(n:3) = 3 welll
<500 tests使用時>
・本キットはDPPHが1プレート毎に測定できるように5本組みとなっております。
・下記内容は、500 testsをまとめて測定する場合の測定可能なサンプル数です。1プレート毎に測定する場合は、上記の100test使用時のサンプル数を参照ください。
・1キットあたりのDPPH Reagent量は500 well分になります。
(Blank2はDPPH Reagentを使用しないため、下記内訳のwell数にはカウントしていません)
未知サンプルの場合: 8サンプル
・小社キットで測定実績がない場合、1キットで8サンプル分の測定が可能です。
<予備実験時の使用ウェル数:最適濃度域の確認>
サンプル:8(8点の希釈系列) X 3(n:3) X 8 (8サンプル)= 192 well
Blank:1(Blank1) X 3(n:3) X 3 (3 プレート) = 9 well
<IC50値の算出時の使用ウェル数>
サンプル:8(8点の希釈系列) X 3(n:3) X 8 (8サンプル)= 192 welll
Trolox: 4(4点の希釈系列) X 3(n:3) X 5 (5 プレート) = 60 well
Blank:1(Blank1) X 3(n:3) X 3 (3 プレート) = 9 well
-
Q
反応から測定までの時間が長くなった場合、測定値に影響しますか?
-
A
反応時間が長くなると、測定値が変化する可能性があります。
再現精度のよい結果を得るためにも、取扱説明書に記載のインキュベーション(25℃、30分、暗所)後は速やかに測定ください。
複数のプレートを測定する場合、各プレート毎の測定までの時間を合わせてください。
-
Q
食品の前処理方法を教えて下さい。
-
A
前処理方法として下記の実施例があります。
<茶葉>
1) 茶葉試料 5 g に100℃ の超純水 50 ml を加える。
2) 100℃ で 10 分間攪拌して抽出する。
3) 10 分後、超純水を用いて 55 g に重量調整を行い、綿ろ過する。
4) 抽出液を遠心管に取り、23℃、4000×g で 10 分間遠心する。
5) 上清をメンブレンフィルター (pore si0ze 0.45μm) でろ過したろ液を測定試料とする。
<ピーマン・パプリカ>
1) 試料は凍結乾燥したものをミキサーで粉末状にする。
2) 粉末試料 0.5 g に海砂 2.5 g を加え、抽出溶媒MWAを 5 ml添加する。
(MWA組成 メタノール:超純水:酢酸=90:9.5:0.5 の比率で混合した溶液)
3) 10 秒間の攪拌後、超音波洗浄層を用いて37℃、5 分間の超音波処理をする。
4) 23℃、1600×g で 10 分間遠心し、上清を回収する。
5) 沈殿物に再度、MWAを5 ml 添加し、3)~4) の処理・回収を 3 回繰り返す。
6) 回収した上清をMWAを用いて25 mlに定容し、測定試料とする。
-
Q
サンプルに濁りがありますが測定できますか? また、測定ができるかどうか確認方法はありますか?
-
A
<濁りのあるサンプルについて>
測定サンプルの濁りは測定に影響を与えます。
サンプルを溶解する実績のある溶媒は、水、エタノール、メタノール、MWA、DMSOです。
※MWAの組成 メタノール:超純水:酢酸=90:9.5:0.5 の比率で混合した溶液
※DMSOではTEAC値が高くでる可能性があります
サンプルが完全に溶けきれず濁りがある場合には、ろ過を行ないサンプルを調製して下さい。
濁り成分が活性物質の場合、抗酸化活性は測定できません。
サンプルを溶解する溶媒が水の場合には、SOD Assay Kit-WSTでの使用も可能です。
DPPH法と反応機序が異なるため、2つの指標での測定をおすすめします。
また、カロテン類や濃く紫色に着色したサンプルでは測定が難しいため、
他の方法での測定をおすすめします。
<確認方法について>
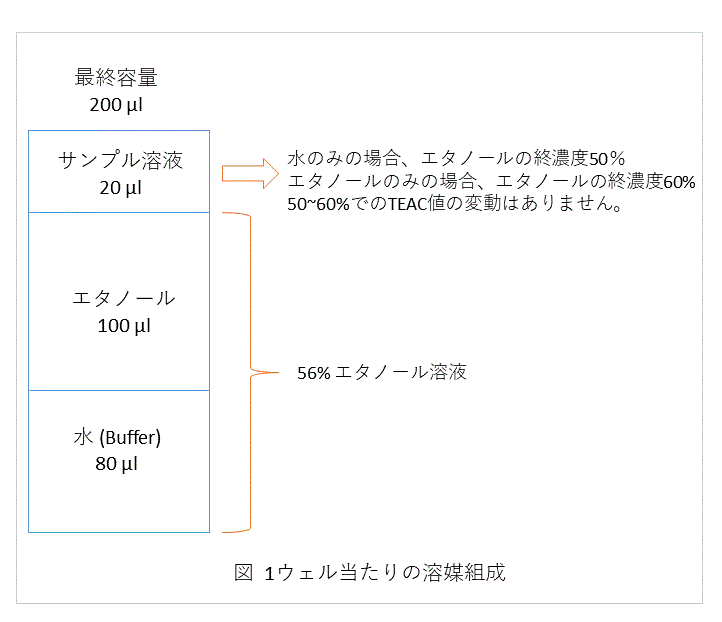
本キットは測定前のウェルは、図のような組成になります。
測定前に濁りがあるかをチェックする方法として、
56%エタノール (水:エタノール=4:5) 180 µlにサンプル溶液 20 µl を加えた時に濁らないかをチェックして下さい。
濁る場合には、サンプルの濃度を薄くして、濁らない程度に調整して下さい。
特に、タンパク質を豊富に含む試料(例えば、牛乳など)はタンパク質の凝集を起こします。
取扱条件
| 保存条件: 冷蔵 |