Microbial Viability Assay Kit-WST
微生物増殖アッセイキット
- 寒天培地法や微量液体希釈法に比べ短時間での検出が可能である
- マイクロプレートを使った多検体処理が可能である
- 培地成分による影響を受けにくい製品である
-
製品コードM439 Microbial Viability Assay Kit-WST
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 tests | ¥7,700 | 348-08913 |
| 500 tests | ¥27,200 | 342-08911 |
| 100 tests | ・WST Solution ・Electron Mediator Reagent (DMSO Solution) |
1 ml×1 0.1 ml×1 |
|---|---|---|
| 500 tests | ・WST Solution ・Electron Mediator Reagent (DMSO Solution) |
1 ml×5 0.5 ml×1 |
性質
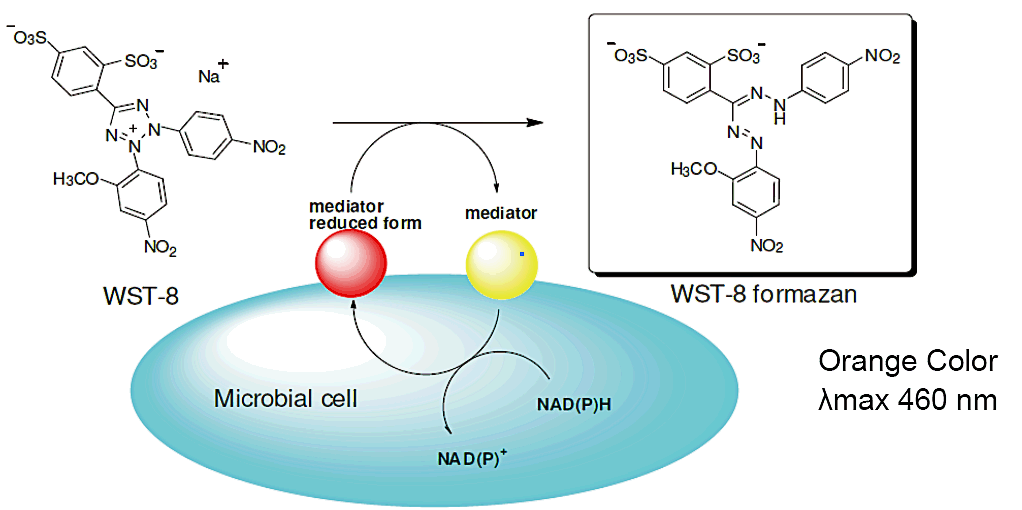
水溶性テトラゾリウムであるWST-8(特許2757348)を発色試薬として用いた微生物の比色検出キットです。
微生物はエネルギー代謝活動により細胞内にNAD(P)Hを生成しますが、WST-8は電子メディエーターを介する事で、このNAD(P)Hにより還元され水溶性formazan(オレンジ色)を生成します。このformazanの生成量は微生物のエネルギー代謝活性に比例するため、オレンジ色への呈色を見ることで、その微生物の生存率や活性度合を確認できます。
本品は福岡県工業技術センター生物食品研究所との共同開発製品です。
技術情報
評価にかかる時間を大幅に短縮することが可能
微生物の生存率は一般的にコロニー形成や増殖による濁りを目視評価されますが、時間が長くかかったり操作に熟練を要するなどの煩雑な点がありました。本キットでは大腸菌の場合、寒天培地法では通常22時間の培養が必要なのに対し、本キットでは8時間培養での評価が可能となりました。(1 CFU/ml)
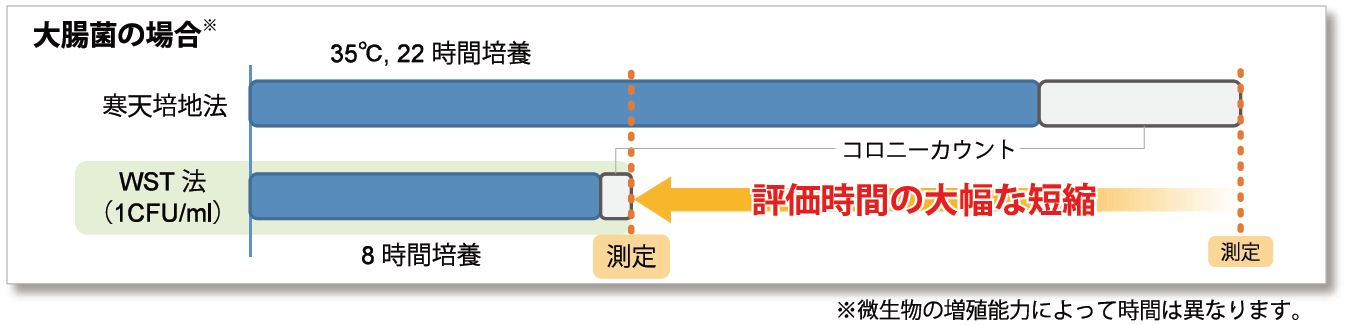
また、培養後のコロニーカウントも試薬を添加するだけの簡単操作です。
測定の際は、96ウェルマイクロプレートに微生物懸濁液を準備して試薬を添加後、インキュベーター内で微生物の代謝活性により発色させます。
 微生物懸濁液に試薬を添加 |
 インキュベーター内で発色反応 |
 吸光度検出 |
大腸菌の増殖アッセイ例
<測定手順>
① 大腸菌(NBRC3972)を TSBYE 培地中で前培養した(37℃、16 時間)。
② Mueller-Hinton(以下, MHB)を用いて約108 CFU/ml となるように前培養した大腸菌を希釈・調製し、さらにMHBを用いて10 倍希釈系列で菌懸濁液を作製した。
③ 96 ウェルマイクロプレートに、マルチチャンネルピペットを用いて各菌体密度の大腸菌を各ウェルへ190 μl ずつ分注した。
④ さらに、マルチチャンネルピペットを用いて各ウェルへ検出試薬10 μl を添加した。
⑤ 培地の蒸散とコンタミネーションを防ぐために、マイクロプレートに透明圧着シール(PCR用など)を貼り、吸光マイクロプレートリーダ(VersaMax, 日本モレキュラーデバイス)へセットした。
⑥ カイネティック測定モードで460 nm における吸光度を15 分おきに24 時間まで経時的に測定した(37℃)。
<測定結果及び定量性の確認>
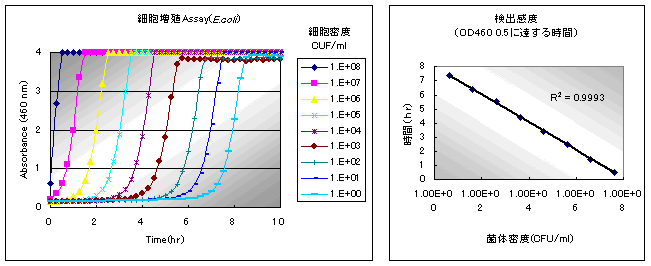
下図は、大腸菌の増殖アッセイを経時的に示したものです。マイクロプレートの最左列が高密度(約108 CFU/ml)、右に行くにつれて低密度になっており、約1時間おきに1列ずつ発色がみられることがわかりました。

下図 は大腸菌の増殖アッセイの結果をグラフ化したものです。目視でも十分発色の確認が可能な吸光度変化0.5 を示すのに必要な時間(h)をy軸に、それぞれの菌体密度(CFU/ml)をx軸にプロットしたところ、下記のような直線関係式が導かれ、大腸菌の定量性を確認することができました。
y= - 0.43Ln(x) + 8.01
ここでx=1、すなわち1 CFU/ml の時、y=8.01 となることから、1 個の微生物を検出すのに約8 時間必要であることがわかります。つまり、約8 時間培養して吸光度変化がなければ大腸菌陰性と判定できます。
わかりにくい濁度から見やすい色の変化へ
薬剤感受性試験の例
<測定手順>
① 黄色ブドウ球菌(SA) およびメチシリン耐性黄色ブドウ球菌(MRSA) を96 ウェルプレートに播種後、各濃度に調整した抗生物質を添加した。
② 6時間、37℃でインキュベート後、試薬を添加し更に2時間発色反応を行った。
<測定結果及び定量性の確認>
結果、生存細胞が存在するウェルのみ発色がみられ、目視にて容易に抗生物質の抗菌効果を確認できた。
SA : Staphylococcus aureus
MRSA : Methicillin-resistant Staphylococcus aureus
詳しくはこちらの文献をご確認ください。
発色原理
微生物はエネルギー代謝活動により細胞内にNAD(P)Hを生成します。
WST-8は電子メディエーターを介する事で、このNAD(P)Hによって還元され、水溶性formazan(オレンジ色)を生成します。
このformazanの生成量は、微生物のエネルギー代謝活性に比例するため、オレンジ色への呈色を見ることで、その微生物の生存率や活性度合を確認することができます。
測定実績のある微生物
| 真菌(カビ類):Mould | 真菌(酵母類):Yeast |
|
Alternaria alternata NBR+B40:B56C31805 Aspergillus flavus NBRC4295 Aspergillus fumigatus NBRC33022 Aspergillus niger NBRC105649 Aspergillus terreus NBRC6346 Aspergillus ustus NBRC4128 Aureobasidium pullulans NBRC6353 Chaetomium globosum NBRC6347z Cladosporium cladosporioides NBRC6348 Exophiala dermatitidis NBRC6421 Paecilomyces variotii NBRC33284 Penicillium citrinum NBRC6352 Penicillium pinzophilum NBRC33285 Phoma citricarpa NBRC5287 Pseudallescheria boydii NBRC32229 Rhizopus oryzae NBRC31005 Sporothrix schenckii NBRC32961 Trichoderma virens NBRC6355 Trichophyton rubrum NBRC 5807 |
Candida albicans ATCC90028 Candida albicans JCM 1542 Candida albicans SC5314 Candida krusei NBRC1395 Candida parapsilosis NBRC1396 Candida utilis Cryptococcus albidus NBRC0378 Cryptococcus neoformans ATCC66031 Saccharomyces cerevisiae NBRC2347 Trichosporon asahii NBRC103889 Trichosporon asahii M9459 Trichosporon asahii M9925 Zygosaccharomyces rouxi |
| グラム陽性菌:Gram-positive | グラム陰性菌:Gram-negative |
|
Bacillus cereus Bacillus subtillis Corynebacterium glutamicum Enterococcus faecalis Enterococcus faecalis FSCC 146002 Lactobacillus casei Listeria monocytogenes Micrococcus luteus Staphylococcus aureus Staphylococcus aureus NBRC13276 Staphylococcus aureus ATCC 25923 Staphylococcus epidermidis Staphylococcus epidermidis ATCC 14990 Staphylococcus epidermidis FSCC 223011 Streptococcus mutans NCTC 10449 Streptococcus mutans UA 159 |
Acetobacter sp. Acinetobacter baumannii ATCC 19606 Campylobacter concisus ATCC 33237 Enterobacter cloacae FSCC145003 Escherichia coli 1.1369 Escherichia coli ATCC 25922 Escherichia coli BW25113 Escherichia coli K-12 Fusobacterium nucleatum subsp. polymorphum JCM 12990 Klebsiella pneumoniae FSCC167002 Proteus mirablils Pseudomonas aeruginosa Pseudomonas aeruginosa NBRC13275 Pseudomonas aeruginosa ATCC 27853 Salmonella enteritidis Salmonella typhimurium Serratia marcescens Stenotrophomonas maltophilia ATCC 51331 Vivrio parahaemolyticus Yersinia enterocollica |
参考文献
| 文献No. | 対象サンプル | 引用(リンク) |
|---|---|---|
| 1) | <真菌(酵母)> ・Candida albicans JCM 1542 |
A. Azuma, N. Akiba and S. Minakuchi, "Hydrophilic surface modification of acrylic denture base material by silica coating and its influence on Candida albicans adherence", J. Med. Dent. Sci.., 2012, 59, (1), 1-7. |
| 2) | <グラム陰性菌> ・Escherichia coli BW25113 |
H. Y. Oh, J. O. Lee and O. B. Kim, "Increase of organic solvent tolerance of Escherichia coli by the deletion of two regulator genes, fadR and marR", Appl. Microbiol. Biotechnol.., 2012, 96, (6), 1619-27. |
| 3) | <グラム陰性菌> ・Escherichia coli K-12 |
T. Nakayashiki, N. Saito, R. Takeuchi, H. Kadokura, K. Nakahigashi, B. L. Wanner and H. Mori, "The tRNA thiolation pathway modulates the intracellular redox state in Escherichia coli", J. Bacteriol.., 2013, 195, (9), 2039-49. |
| 4) | <グラム陽性菌> ・Streptococcus mutans UA 159 <グラム陰性菌> ・Escherichia coli 1.1369 |
S. He, P. Zhou, L. Wang, X. Xiong, Y. Zhang, Y. Deng and S. Wei, "Antibiotic-decorated titanium with enhanced antibacterial activity through adhesive polydopamine for dental/bone implant", J. R. Soc. Interface., 2014, 11, (95). |
| 5) | <真菌(カビ)> ・Trichophyton rubrum NBRC 5807 |
K. Z. Hein, H. Takahashi, T. Tsumori, Y. Yasui, Y. Nanjoh, T. Toga, Z. Wu, J. Grötzinger, S. Jung, J. Wehkamp, B. O. Schroeder, J. M. Schroeder and E. Morita, "Disulphide-reduced psoriasin is a human apoptosis-inducing broad-spectrum fungicide", Proc. Natl. Acad. Sci. U.S.A.., 2015, 112, (42), 13039-44. |
| 6) | <真菌(カビ)> ・Trichophyton rubrum |
S. Arai, T. Yoshino, T. Fujimura, S. Maruyama, T. Nakano, A. Mukuno, N. Sato and K. Katsuoka, "Mycostatic effect of recombinant dermcidin against Trichophyton rubrum and reduced dermcidin expression in the sweat of tinea pedis patients", J. Dermatol.., 2015, 42, (1), 70-6. |
| 7) | <グラム陽性菌> ・Staphylococcus aureus NBRC13276 <グラム陰性菌> ・Pseudomonas aeruginosa NBRC13275 |
T. Tsukatani, T. Kawaguchi, H. Suenaga, M. Shiga and T. Ikegami, "RAPID AND SIMPLE DETERMINATION OF MINIMUM BIOFILM ERADICATION CONCENTRATION BY A COLORIMETRIC MICROBIAL VIABILITY ASSAY BASED ON REDUCTION OF A WATER-TETRAZOLIUM SALT AND COMBINATED EFFECT OF ANTIBIOTICS AGAINST MICROBIAL BIOFILM", J Microbiol Biotechnol Food Sci.., 2016, 6, (1), 677. |
| 8) | <グラム陽性菌> ・Streptococcus mutans NCTC 10449 |
M. Hashimoto, H. Yanagiuchi, H. Kitagawa and Y. Honda, "Inhibitory Effect of Platinum Nanoparticles on Biofilm Formation of Oral Bacteria", Nano Biomed., 2017, 9, (2), 77-82. |
| 9) | <グラム陽性菌> ・Enterococcus faecalis FSCC 146002 ・Staphylococcus aureus ATCC 25923 ・Staphylococcus epidermidis FSCC 223011 <グラム陰性菌> ・Acinetobacter baumannii ATCC 19606 ・Enterobacter cloacae FSCC 145003 ・Escherichia coli ATCC 25922 ・Klebsiella pneumoniae FSCC 167002 ・Pseudomonas aeruginosa ATCC 27853 ・Stenotrophomonas maltophilia ATCC 51331 |
Z. Xu, X. Zhao, X. Chen, Z. Chen and Z. Xia, "Antimicrobial effect of gallium nitrate against bacteria encountered in burn wound infections", RSC Adv.., 2017, 7, 52266-52273. |
| 10) | <真菌(酵母)> ・Candida albicans SC5314 |
J. Nagao, T. Cho, M. Mitarai, K. Iohara, K. Hayama, S. Abe and Y. Tanaka, "Antifungal activity in vitro and in vivo of a salmon protamine peptide and its derived cyclic peptide against Candida albicans", FEMS Yeast Res.., 2017, 17, (1). |
| 11) | <真菌(カビ)> ・Trichosporon asahii M9459 ・Trichosporon asahii M9925 |
T. Ichikawa, C. Hirata, M. Takei, N. Tagami, H. Murasawa and R. Ikeda, "Cell surface hydrophobicity and colony morphology of Trichosporon asahii clinical isolates", Yeast., 2017, 34, (3), 129-137. |
| 12) | ・土壌微生物 | M. Kamitakahara, S. Takahashi, T. Yokoi, C. Inoue and K. Ioku, "Preparation of spherical porous hydroxyapatite granules as support materials for microorganisms", JCS Japan., 2018, 126, (9), 732-735. |
| 13) | <グラム陽性菌> ・Staphylococcus epidermidis ATCC 14990 |
F. Boschetto, T. Adachi, S. Horiguchi, D. Fainozzi, F. Parmigiani, E. Marin, W. Zhu, B. McEntire, T. Yamamoto, N. Kanamura, O. Mazda, E. Ohgitani and G. Pezzotti, "Monitoring metabolic reactions in Staphylococcus epidermidis exposed to silicon nitride using in situ time-lapse Raman spectroscopy", J Biomed Opt.., 2018,(5), 1-10. |
| 14) | <グラム陰性菌> ・Campylobacter concisus ATCC 33237 ・Fusobacterium nucleatum subsp. polymorphum JCM 12990 |
T. Nambu, D. Wang, C. Mashimo, H. Maruyama, K. Kashiwagi, K. Yoshikawa, K. Yamamoto and T. Okinaga, "Nitric Oxide Donor Modulates a Multispecies Oral Bacterial Community-An In Vitro Study", Microorganisms., 2019, 7, (9), 353. |
| 15) | ・Staphylococcus aures | S. Zhang, X. Qu, J. Jiao, H. Tang, M. Wang. Y. Wang, H. Yang, W. Yuan and B. Yue, "Felodipine enhances aminoglycosides efficacy against implant infections caused by methicillin-resistant Staphylococcus aureus, persisters and biofilms", Bioact. Mater., 2021, doi: 10.1016/j.bioactmat.2021.11.019. |
よくある質問
-
Q
1cmや0.25cmのセルを使って測定できますか?
-
A
基本的には測定は可能です。
但し、96ウエルマイクロプレートと比較して、発色試薬量を多く必要としますので、実際に測定可能な検体数が減少します。
-
Q
糸状菌での使用実績はありますか?
-
A
Aspergillus属の麹菌を使用した実績があります。
-
Q
菌の増殖試験を行う場合、インキュベート時間はどれくらい行えばよいでしょうか?
-
A
微生物種(菌)の細胞密度により、インキュベート時間が異なります。
例えば、細胞密度が1x106 CFU/mLで、約6時間後にコンフルエントに達する場合、2~5.5時間の間でインキュベートすることで、菌数を確認することができます。
-
Q
偏性嫌気性菌の測定は可能ですか?
-
A
偏性嫌気性菌は、酸素に暴露することで死滅し、十分な発色が得られないため測定できません。
-
Q
微生物の測定実績を教えて下さい。
-
A
本製品ページの「技術情報」に微生物の測定実績を記載しております。 「測定実績のある微生物」の表をご参照ください。
取扱条件
| 保存条件: 冷蔵 | |
|
危険・有害 シンボルマーク |

|
|---|---|