Glucose Uptake Plate Assay Kit

グルコース取り込みプレート検出キット
- グルコース取り込み能力を蛍光プレートリーダーで簡便に測定できる
- 洗浄操作が不要なNon-washタイプ
- 試薬を加えるだけの簡単な操作
-
製品コードUP08 Glucose Uptake Plate Assay Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 tests | ¥55,000 | 347-10311 |
| 500 tests | ¥98,000 | 343-10313 |
【注意点】
測定にはクリアボトムのプレートと下方励起・下方蛍光測定が可能なプレートリーダーをご使用下さい。
| 100 tests | Glucose Uptake Probe-Green Quenching Buffer |
×1 11 ml×1 |
|---|---|---|
| 500 tests | Glucose Uptake Probe-Green Quenching Buffer |
×5 11 ml×5 |
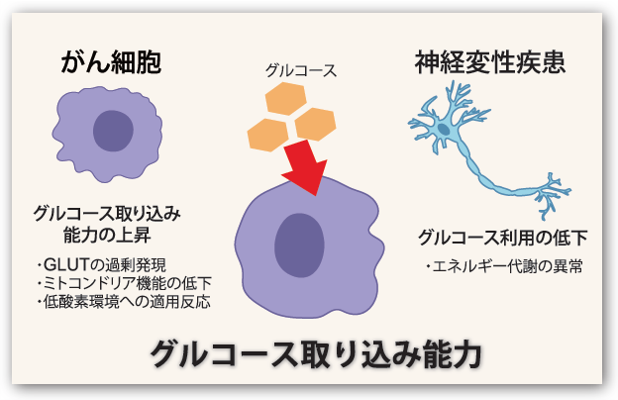
グルコース取り込みと疾患の関連について
細胞が栄養素を取り込みエネルギーを産生する「代謝」は、近年、遺伝子発現をはじめとする多様な細胞機能の制御にも関与していることが明らかになってきています。
がん細胞では、グルコースの取り込みが著しく亢進しています。このような代謝特性はWarburg効果と呼ばれ、グルコーストランスポーター(GLUT)の過剰発現、ミトコンドリア機能の低下、低酸素環境への適応反応など、複数の機構によって制御されています。これらの変化は、がんの悪性度や治療抵抗性の指標として注目されています。
一方、アルツハイマー病などの神経変性疾患では、グルコース利用の低下と代謝異常が神経機能障害と深く関係していることが示されています。
このように、グルコース代謝の可視化は病態理解と治療開発において重要な指標となっています。
マニュアル
技術情報
原理
細胞はさまざまな栄養素を取り込み、細胞内代謝を介してエネルギーを産生しています。このような栄養代謝は細胞外環境や細胞の状態、細胞の種類などによって異なっており、近年このような栄養代謝が単なるエネルギー産生だけでなく、遺伝子発現を含むさまざまな細胞機能制御にも関与していることが明らかとなっています。
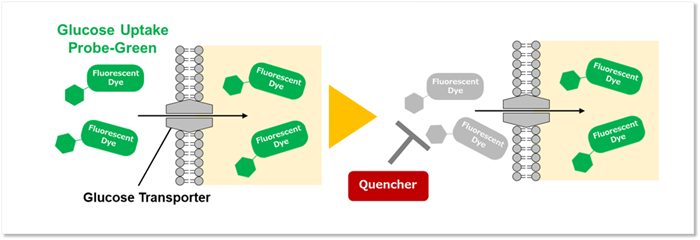
グルコースは、主要な栄養素の一つであり、グルコースの取り込みや代謝を理解することは細胞機能を解明する上で非常に重要となります。本キットに含まれる蛍光標識グルコース誘導体 Glucose Uptake Probe-Greenはグルコーストランスポーターを介して細胞内に取り込まれるため、プレートリーダーで蛍光測定をすることで細胞のグルコース取り込み能力を測定することが可能です。
また、細胞内に取り込まれなかったGlucose Uptake Probe-Greenの蛍光を消去するQuenching Bufferも組み込まれているため、細胞の洗浄を行う必要がなく、簡便にプレートリーダーで測定することができます。
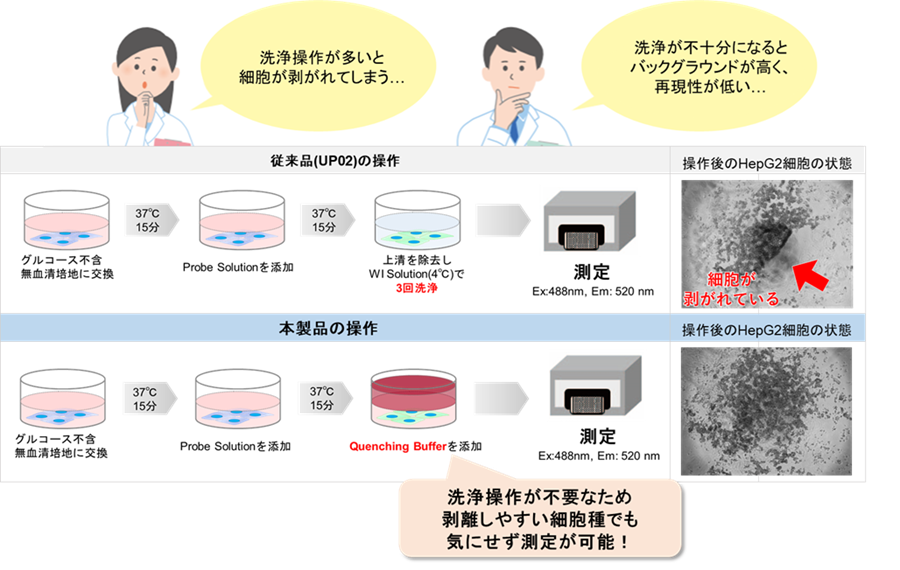
マイクロプレートアッセイの課題をQuenching Bufferで解決!!
本製品にはQuenching Bufferを同梱しており試薬添加後の洗浄は不要です。以下のようなお客様の課題に対応しています。
比較表
Glucose Uptake Assay Kit-Green (製品コード:UP02)との比較表を下記に示します。
本製品はProbe working solutionの洗浄操作がないため、プレートアッセイを簡便に行いたい方、細胞剥離を避けたい方向けのプレートアッセイ用のグルコース取り込みキットです。
一方、Glucose Uptake Assay Kit-Green(製品コード:UP02)は洗浄操作による剥離の懸念がない細胞種でのプレートアッセイやフローサイトメーター、イメージングでの評価をご要望の場合にご使用をお薦めしております。
| 同仁化学研究所 | ||
|---|---|---|
| 品コード | UP08 | UP02 |
| 製品名 |
本製品 |
|
|
対応装置 |
プレートリーダー |
蛍光顕微鏡、プレートリーダー、 |
| Wash Type |
ー |
〇 |
|
Non-Wash Type |
〇 |
ー |
|
測定対象 |
生細胞 |
生細胞 |
剥離しやすい細胞種でも測定できる
細胞が剥離しにくい操作方法のため、細胞が剥離することによるばらつきを抑えて測定可能です。
 |
培地交換時に剥がれてしまう細胞種をご使用の場合 |
<操作>
1. 1 mg/ml Poly-D-Lysin (以下、PDL) をPBS(-)で10倍希釈した。
2. 96-well マイクロプレート (655090 : greiner社) に希釈したPDL溶液を150 µlずつ添加し、室温で1時間静置した。
3. PBS(-) 200 µlで3回洗浄した。
4. MEM培地 (10% FBS、1% penicillin-streptomycin) で調製したHEK293細胞 (1.2 × 105 cells/well) をPDLコートした96-well マイクロプレート に播種し、5% CO2インキュベーター(37℃)内で一晩培養した。
5. 900 mM 2-Deoxy-D-glucose (2-DG) 22 µl (final 100 mM 2-DG) を添加し、インキュベーター(37℃、5%CO2存在下)で2.5時間静置した。
6. 上清を除去した後、DMEM (glucose-free、serum-free、37℃) 200 µlで2回洗浄した。
7. DMEM (glucose-free、serum-free、37℃) 200 µlを各ウェルに添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
8. 上清を除去した後、DMEM (glucose-free、serum-free、37℃)を用いて調製したProbe working solution 100 µlを添加し、インキュベーター(37℃、5%CO2存在下)で30分間静置した。
9. Quenching Buffer (37℃) 100 µlを添加した。
10. プレートリーダー (機種 :TECAN社 Infinite m200 PRO、ボトムリーディング、Ex/Em=488/520 nm) 測定を行った。
※従来品(UP02)は操作9以降、UP02の取扱説明書に従い操作し、測定を行った。
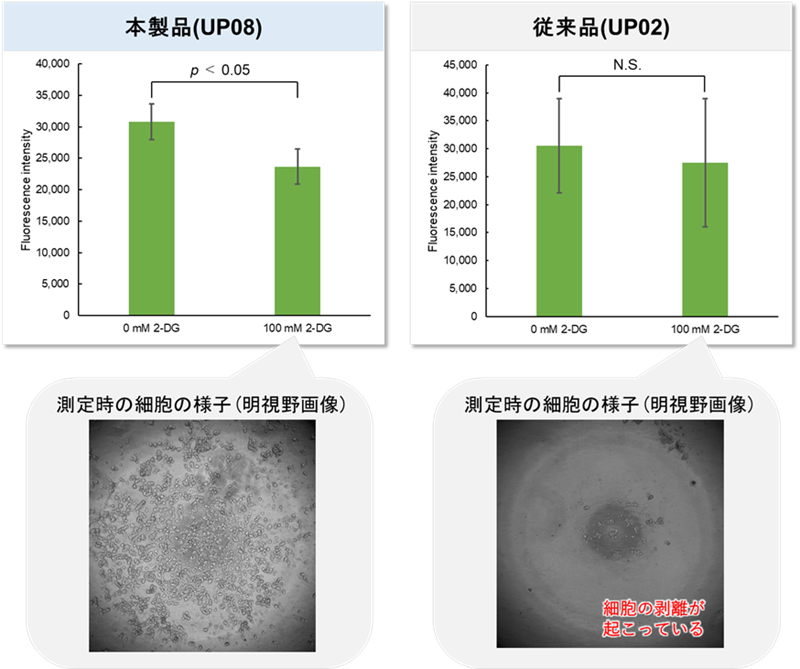
実験例:D-グルコース競合によるGlucose Uptake Probeの取り込み阻害
A549細胞におけるグルコース取込み能を、本製品を用いて評価しました。
High-glucose(25 mmol/l)の条件ではD-グルコースとGlucose Uptake Probeの競合阻害が起るため、Glucose-free(0 mmol/l)の条件と比較して蛍光強度が低下する結果が得られました。
このことから、Glucose Uptake Probeの取り込みがグルコース取込み能の指標となることが確認されました。
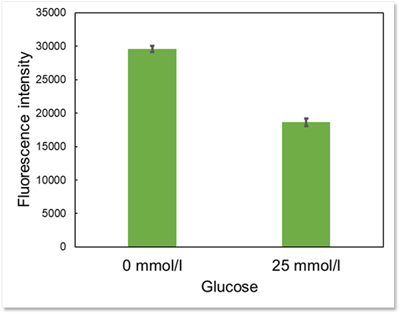
細胞:A549細胞
検出波長:Ex : 488 nm, Em : 520 nm
実験例:Cytochalasin BによるGlucose Uptake Probeの取り込み阻害
本キットを用いてグルコーストランスポーター阻害剤Cytochalasin BによるHepG2細胞のGlucose Uptake Probeの取り込み阻害を数値化することができました。
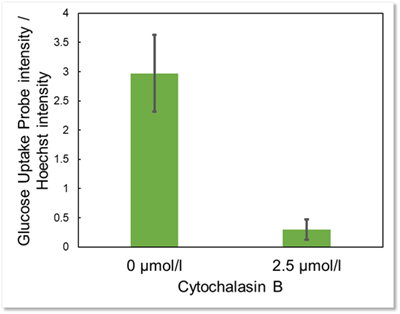
細胞:HepG2細胞
培養条件:2.5 µmol/l Cytochalasin B / DMEM (25 mmol/l Glucose, 10% FBS, 1%P/S), 37℃, 一晩
検出波長:Ex : 488 nm, Em : 520 nm
*Hoechst 33342の蛍光強度で補正
蛍光特性
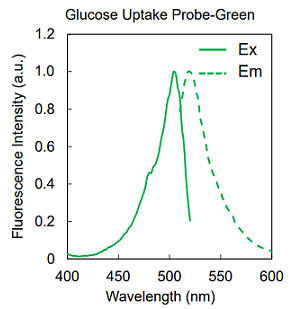
図 Glucose Uptake Probe-Greenの励起・蛍光スペクトル
よくある質問
-
Q
Glucose Uptake Assay Kit-Green(製品コード:UP02)との違いを教えてください。
-
A
本製品はProbe working solutionの洗浄操作がないため、プレートアッセイを簡便に行いたい方、細胞剥離を避けたい方向けのプレートアッセイ用のグルコース取り込みキットです。
一方、Glucose Uptake Assay Kit-Green(製品コード:UP02)はプレートアッセイだけでなく、フローサイトやイメージングが可能なキットです。
-
Q
Glucose Uptake Probe-Greenはどのグルコーストランスポーターを介して取り込まれるのでしょうか?
-
A
複数のトランスポーターを介して細胞内へ取り込まれていると推測されますが、各グルコーストランスポーターに対する特異性や親和性に関する詳細なデータはございません。
-
Q
Glucose Uptake Probe-Greenは細胞内に取り込まれた後、分解・代謝されるのでしょうか?
-
A
蛍光色素部位は安定な構造を有しているため、実験操作内において分解されることはございません。グルコース部位は、構造上ヘキソキナーゼによるリン酸化を受けることが考えられますが、それ以降の代謝は行われないと考えられます。
-
Q
Glucose Uptake Probe-Greenを生細胞へ取り込ませた後、固定することは可能でしょうか?
-
A
プローブが細胞内から漏出するため、染色後の細胞を固定することはできません。
-
Q
使用実績のある細胞種を教えてください。
-
A
下記の細胞において使用実績があります。
細胞 ヒト肺胞基底上皮腺癌細胞 A549 ヒト肝癌由来細胞 HepG2 ヒト胎児腎細胞 HEK293
-
Q
阻害剤や取り込み能力を変化させる実験の実績を教えてください。
-
A
下記の細胞において阻害剤や取り込み能力を変化させる実験の実績があります。
細胞
Probe stock solutionの希釈倍率
染色時間
阻害剤や取り込み能力を
変化させる実験
ヒト肝癌由来細胞 HepG2 ×500 15分 Cytochalasin B ヒト胎児腎細胞 HEK293 ×500 30分 2-DG
-
Q
プレートリーダーで測定する際、どのプレートを使用すればいいでしょうか。
-
A
ボトムリーディングで蛍光検出する必要があるため、96穴クリアボトムのブラックプレートをご使用ください。
-
Q
蛍光シグナルの変化が観察されない場合はどうすればいいですか?
-
A
初期検討としてプローブ濃度(250~1,000倍希釈)や染色時間(15分~1時間程度)をご検討ください。
-
Q
Probe working solutionは保存可能でしょうか?
-
A
Probe working solutionは保存できません。Probe stock solutionは冷凍保存が一か月間可能です。
-
Q
Glucose Uptake Probe-Greenに細胞毒性はありますか?
-
A
弊社製品のCell Counting Kit-8 (製品コード:CK04)を用いてA549細胞におけるプローブの細胞毒性を調査した結果、細胞毒性は確認されませんでした。
-
Q
グルコースの定量はできますか?
-
A
本製品を用いてグルコースを定量することはできません。
培地中のグルコース消費量や細胞内のグルコース量を定量したい場合は、Glucose Assay Kit-WST (製品コード:G264) をご使用ください。
-
Q
取り込まれた色素の定量はできますか?
-
A
取り込まれた色素の定量を行う事はできません。本色素は、グルコース取り込み能力の増減を確認するための色素となります。
-
Q
蛍光顕微鏡でのイメージングやフローサイトメーターの測定に使用できますか?
-
A
本製品は蛍光顕微鏡でのイメージングやフローサイトメーターの測定には使用できません。
細胞内に取り込まれたプローブのイメージングやフローサイトを行いたい場合は、Glucose Uptake Assay Kit-Green(製品コード:UP02)をご使用ください。
-
Q
Quenching Bufferを添加後、プローブはどのくらいの時間、細胞内に保持されますか?
-
A
Quenching Buffer添加後、プローブは徐々に細胞外へ排出されます。測定間差を減らすため、Quenching Buffer添加後10分以内に測定することを推奨します。ただし、細胞の種類によって異なることが考えられます。
-
Q
グルコース不含無血清培地への培地交換で細胞が剥がれてしまう場合はどうしたらいいですか?
-
A
グルコース不含無血清培地への培地交換で細胞が剥がれてしまう場合は、下記操作手順のようにPoly-D-Lysine(PDL)コートしたプレートでご検討ください。
<操作>
1. 1 mg/ml Poly-D-Lysine (以下、PDL) をPBS(-)で10倍希釈した。
2. 96-well マイクロプレート (655090 : greiner社) に希釈したPDL溶液を150 µlずつ添加し、室温で1時間静置した。
3. PBS(-) 200 µlで3回洗浄した。
4. MEM培地 (10% FBS、1% penicillin-streptomycin) で調製したHEK293細胞 (1.2 × 105 cells/well) をPDLコートした96-well マイクロプレート に播種し、5% CO2インキュベーター(37℃)内で一晩培養した。
5. 900 mM 2-Deoxy-D-glucose (2-DG) 22 µl (final 100 mM 2-DG) を添加し、インキュベーター(37℃、5%CO2存在下)で2.5時間静置した。
6. 上清を除去した後、DMEM (glucose-free、serum-free、37℃) 200 µlで2回洗浄した。
7. DMEM (glucose-free、serum-free、37℃) 200 µlを各ウェルに添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
8. 上清を除去した後、DMEM (glucose-free、serum-free、37℃)を用いて調製したProbe working solution 100 µlを添加し、インキュベーター(37℃、5%CO2存在下)で30分間静置した。
9. Quenching Buffer (37℃) 100 µlを添加した。
10. プレートリーダー (機種 :TECAN社 Infinite m200 PRO、ボトムリーディング、Ex/Em=488/520 nm) 測定を行った。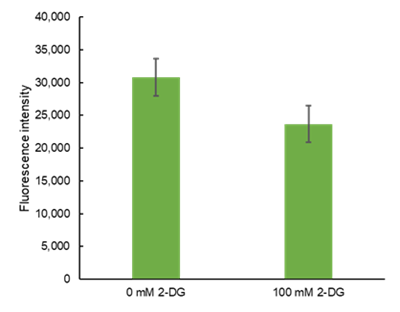
取扱条件
| 保存条件:冷蔵 |













