VI. どのようにして検出するのか
1. 酵素の特徴
2. 主な酵素標識抗体の検出試薬
EIAでは、酵素に基質を加えて生成される色素を吸光(呈色)、蛍光または化学発光などで検出する。HRPの場合はTMBやDAB、ALPの場合はpNPPといった基質が一般的に利用されてきたが、近年はさまざまな種類の基質やキットが各社から発売されている。検出感度は「化学発光>蛍光>吸光(呈色)」の順に高いと言われている。研究者自身の検出系と求める感度を基に選択していただくとよい。
※1 ELISAには水溶性の発色基質であるTMBがよく用いられる。DABは非水溶性である為、ELISAにはあまり用いられない。
VII. キットを用いた反応・精製
1. 少量抗体(10 μg)へ30分以内に標識可能なキット
Ab-10 Rapid Labeling Kitは、10 μgの抗体を30分以内に標識できるように設計されている。キット付属の標識剤は、活性エステル基を導入しているため、抗体と混合するだけで安定な共有結合を形成する。本キットには標識に必要なすべての試薬が含まれている。
本製品の標識操作により、抗体中のアミノ基に標識体が結合します。そのため抗体によっては抗原認識能が失われる場合があります。ご不明な点がありましたら小社カスタマーサポートへお問合せ下さい。

2. フィルトレーションチューブを利用した反応・精製を行うキット(50-200 μg抗体・タンパク質に対応)
小社のLabeling Kitは活性化試薬とフィルトレーションチューブ(分子分画30K)により抗体を簡便に標識できるように設計されている。活性化試薬は抗体(もしくは還元処理した抗体)を指定の緩衝液中で混合するだけで、抗体(もしくは還元処理した抗体)に標識することが可能である。活性化試薬は、50~200 μgの抗体を標識する量に最適化されており、標識後に残ったビオチン化試薬や蛍光色素などの低分子試薬は、遠心操作により除去することが可能である。一方、標識後に残った酵素や蛍光タンパク質などの高分子は、遠心により除去することはできないが、反応液中で活性基が加水分解されるため、免疫反応後に洗浄操作を行えば大きな影響を及ぼさないと考えられる。前処理―反応―精製までの全ての操作を一つのフィルトレーションチューブ上で行うことができ、いずれのキットを用いても概ね3時間以内に標識体を得ることができる。次項にフィルトレーションチューブについての説明を記載している。
 |
 |
|
※ ヒンジ部以外のS-S結合が還元される場合があります。
図11 NH2標識とSH標識の操作手順
|
|
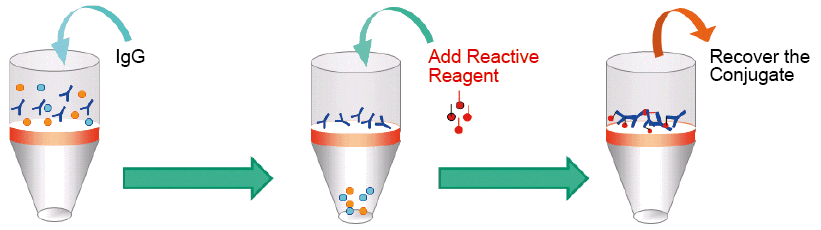
図12 フィルトレーションチューブを利用した精製の模式図
|
本キットでは30Kの分画分子量を持つフィルトレーションチューブが装着されているため、標識対象のタンパク質分子量は、50,000以上と設定されている。分子量146,000程度のIgG抗体を標識する場合には何ら問題ないが、分子量50,000以下のタンパク質のアミノ基に標識をする場合は、別途、分画分子量の小さいフィルトレーションチューブをご用意いただくことで、標識が可能である。
分子量50,000 以下のタンパク質を用いる場合
<準備するもの>
・フィルトレーションチューブ(10K ※) Pall社 ナノセップ遠心ろ過デバイス(Pall社Code: OD010C33)
※ 標識したいタンパク質の分子量によって、適当なものをご選択いただきたい。
<標識方法>
キットの取り扱い説明書に従って操作する(タンパク質量は50~200 μgにする)。ただし、フィルトレーションチューブの分画分子量が小さくなると遠心時間が長くなる可能性があるので、液残りがある場合は遠心時間を延長する必要がある。遠心速度を上げることは、回収率の低下につながるので、お勧めしない。
<注意事項>
蛍光タンパク質(R-Phycoerythrin, Allophycocyanin)を標識時にフィルトレーションチューブで遠心濃縮すると、サンプルによっては凝集する場合がある。その場合は遠心して上澄を使用する、もしくはフィルトレーションチューブは用いず、ゲルろ過カラムを用いることで解決できる場合がある。併せてのトラブルシューティングを参照いただきたい。
VIII. 抗体へのビオチン標識方法
1. なぜビオチン化抗体がよく使用されているのか?
ビオチンはストレプトアビジンと特異的に結合し、また結合力も強い(Ka=10-16M)ことで知られている。この特徴を利用した様々なアプリケーションが利用されている。特に抗体の検出や精製において汎用されている技術である。蛍光色素や酵素、ビーズを標識したストレプトアビジンが多数市販されていることも汎用されている理由の一つであり、一度抗体にビオチンを標識した後は実験毎で必要なストレプトアビジン標識体を選択することが可能である。
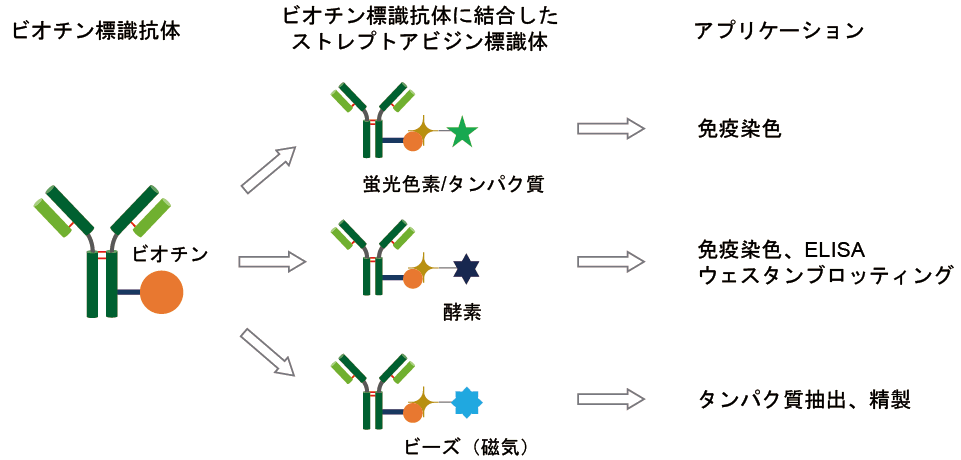
2. キットを用いた標識方法
操作上の注意点などの詳細については、取扱説明書をご参照いただきたい。なお、キットの取扱説明書は小社HPからダウンロードが可能である。
3. キットを用いビオチン標識した抗体の使用例
1) ミトコンドリアの染色例
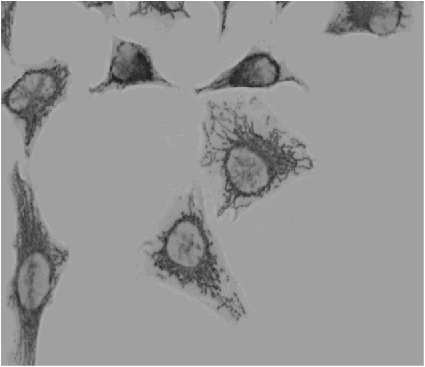 |
図14 抗ミトコンドリア抗体をAb-10 Rapid Biotin Labeling Kitを用いてビオチン化し、固定化後のHeLa細胞に添加し免疫反応後、Peroxidase標識ストレプトアビジン及びDAB(Code: D006)添加によりミトコンドリアを染色。
|
2) フローサイトメトリー測定例
抗CD44抗体をAb-10 Rapid Biotin Labeling Kit又は、Biotin Labeling Kit-NH2を用いてビオチン化後、Biotin標識抗CD44抗体及びFluorescein標識ストレプトアビジンでHL60細胞を免疫染色した。
両キットより標識した抗CD44抗体は、同等の感度を示したことから、10 μgから50-200 μgに抗体量が増えた場合でもスケールアップが可能である。
|
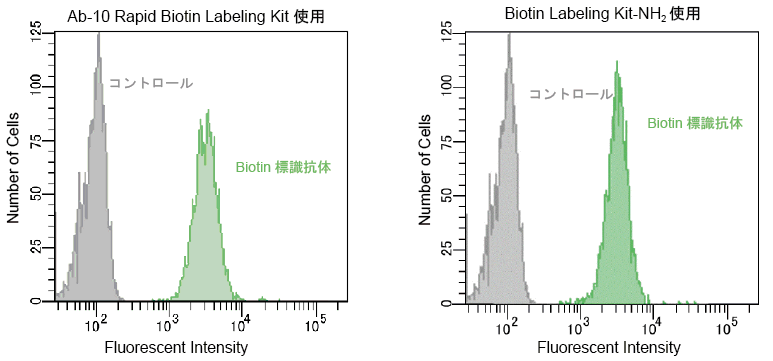
図15 Ab-10 Rapid Biotin Labeling KitとBiotin Labeling Kit-NH2を用いた場合のフローサイトメトリー測定による感度比較
|
3) ラット肺動脈におけるニトログアノシンの染色例
Anti-Nitroguanosine monoclonal antibody(Clone#NO2G52) 50 μgをBiotin Labeling Kit - NH2(Code: LK03)を用いてビオチン標識し、肺高血圧剤(モノクロタリン)を投与したラットの肺動脈凍結切片を染色した。肺動脈近傍で8-ニトログアノシンが検出されており、モノクロタリン投与により肺動脈周辺でひきおこされた炎症によるNO産生が示唆された。
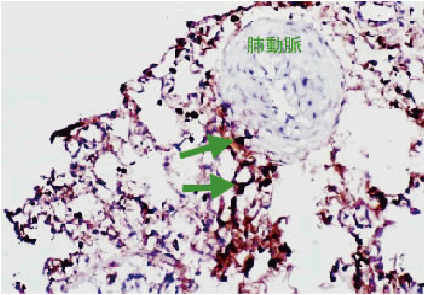 |
図 16 ビオチン標識Anti-Nitroguanosine monoclonal抗体を用いて染色した肺高血圧剤(モノクロタリン)投与ラット肺動脈凍結切片の組織免疫染色像(x200, HRP標識ストレプトアビジン/DAB染色)
画像提供:
北里大学医療衛生学部微生物学教室
北里英郎先生
|
IX.抗体への蛍光色素標識
1. 蛍光色素を用いた多重染色の問題点
多重染色法は、同一の試料で複数の分子を同時に検出しその局在を比較することができるという有用な手法である。励起・蛍光波長の異なる二種類以上の蛍光色素を使用すれば、モノクロCCDカメラや共焦点レーザー顕微鏡などで蛍光をデジタルデータとして取り込んだ後、緑、赤、青の擬似カラーを付けた画像を重ね合わせる(マージする)ことも可能である。
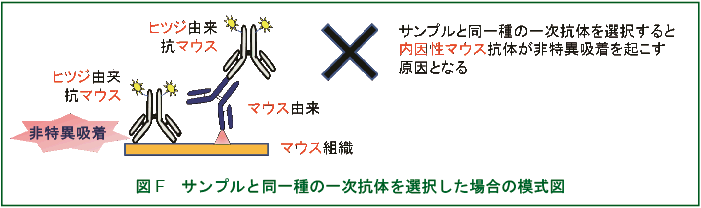
ただし、多重染色を間接法で行う場合は、二次抗体の非特異的な吸着を防止するために以下のことに注意しなければならない。
|
1)
|
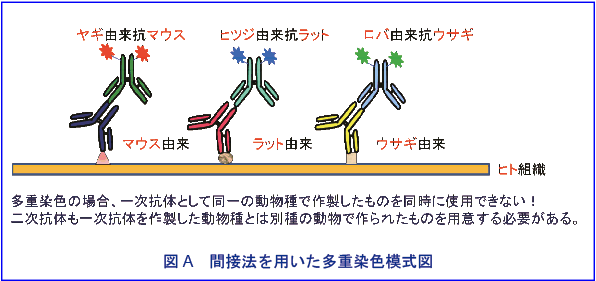
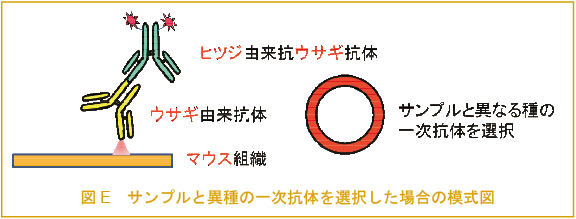
一次抗体として同一の動物種で作製したものを同時に使用できない(図A)。
|
|
2)
|
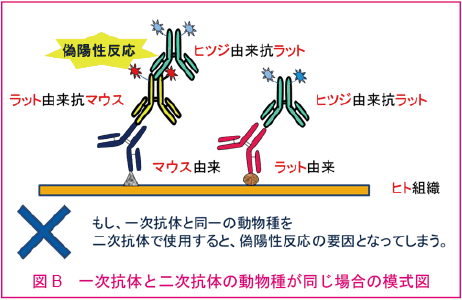
二次抗体は一次抗体を作製した動物とは別種の動物で作られたものを用意しなければならない(図A, B)。
|
|
3)
|
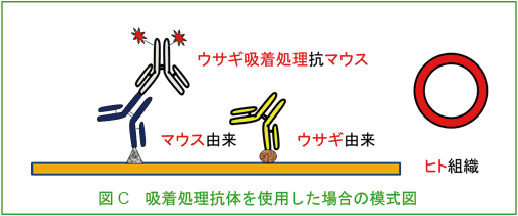
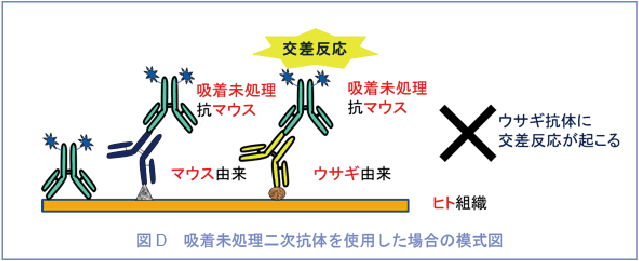
二次抗体は多重染色用のもの(交差反応※1を防ぐために他の動物の血清で吸着処理※2したもの)を使用しなければならない(図C, D)。
|
|
4)
|
サンプルの細胞腫と同一の動物種で作製した一次抗体は、使用できない(図E, F)。
|
※1 交差反応とは
二次抗体は一次抗体のホスト動物種に反応する抗体を選ぶが、その二次抗体が他の動物種に対しても多少反応してしまう。これを交差反応と呼ぶ。交差反応の影響を抑える方法の一つとして、吸着処理という方法がある。
※2 吸着処理とは
予め交差反応を示す可能性のある動物の血清を固定化したビーズを充填したカラムに二次抗体溶液を添加し、それらの血清と反応する抗体をあらかじめ除く処理のこと。
2. 多重染色における直接法の利点
上記のような間接法同時染色の問題点は、多重染色を別々に行う手法やブロッキング剤を用いて解決する方法もあるが、直接標識法を用いれば簡単に解決することが可能である(図G)。また、操作数も格段に減るので、手間も簡素化することができるし、二次抗体の影響も回避できる。
|
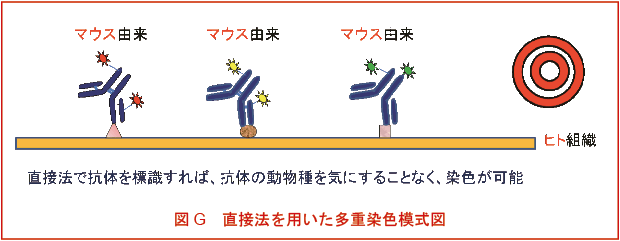
図18 直接法を用いた多重染色模式図
|
3. キットを用いた標識方法
蛍光色素標識キットとして、Fluorescein Labeling Kit - NH2, HiLyte FluorTM 555 / 647 / 750, ICG Labeling Kit - NH2 及び Ab-10 Rapid Fluorescein, Ab-10 Rapid HiLyte FluorTM 555 / 647 Labeling Kit が小社から販売されているのでご活用いただきたい。
操作上の注意点など詳細については、取り扱い説明書をご参照いただきたい。なお、キットの取り扱い説明書は小社HPからダウンロードが可能である。
4. キットを用い蛍光標識した抗体の使用例
1) アクチン及びミトコンドリアの多重染色例
Ab-10 Rapid FluoresceinまたはAb-10 Rapid HiLyte FluorTM 647 Labeling Kitを用いて蛍光標識した抗ミトコンドリア抗体(10 μg)と、Ab-10 Rapid HiLyte FluorTM 555 Labeling Kitを用いて蛍光標識した抗アクチン抗体(10 μg)及びDAPI核染色試薬を固定化後のHeLa細胞に添加し免疫染色した。
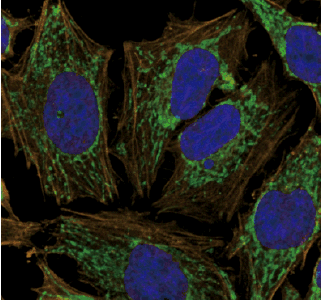 |
細胞:HeLa細胞
ミトコンドリア(緑):Fluorescein標識抗体
アクチン(黄):HiLyte FluorTM 555標識抗体
核(青):DAPI
|
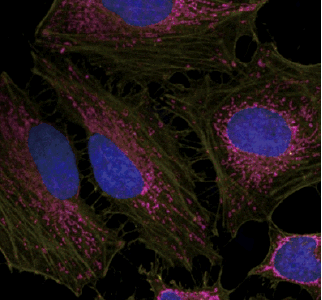 |
細胞:HeLa細胞
ミトコンドリア(赤): HiLyte FluorTM 647標識抗体
アクチン(黄):HiLyte FluorTM 555標識抗体
核(青):DAPI
|
2) HL60細胞でのCD44検出例
抗CD44抗体(10 μg)をAb-10 Rapid Fluorescein Labeling Kitを用いてFluorescein標識後HL60細胞を免疫染色した。
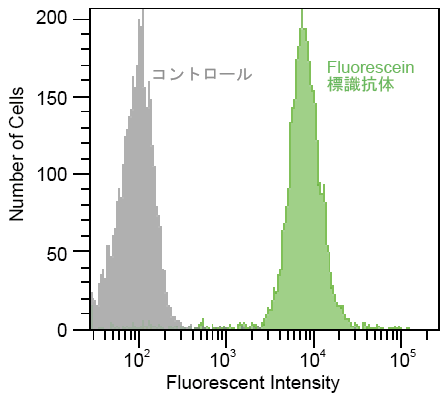 |
<フィルター>
Ex : 488 nm
Em: 515-545 nm
|
|
図20 Fluorescein標識抗CD44抗体を用いたHL60細胞のフローサイトメトリーによる検出例
|
3) 組織免疫染色例
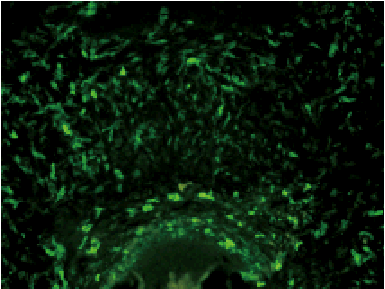 |
画像提供:
東京医科歯科大学 大学院 医歯学総合研究科 髄生物学分野 楊光艶先生、川島伸之先生
|
|
図21 Fluorescein標識抗ラットI-A抗原抗体を用いて染色したラット下顎骨凍結切片の免疫組織染色像
|
X. 抗体への蛍光タンパク質標識
1. 蛍光タンパク質を標識する利点
蛍光タンパク質がフルオレセインなどの低分子の蛍光色素に比べて優れている点を以下に示す。
|
・
|
蛍光タンパク質アロフィコシアニン(APC)は1分子あたり6個の発色団をもち、フィコエリスリン(R-PE)は1分子 あたり30個の発色団を含んでいるので、それぞれタンパク質1分子あたりの蛍光強度が高い。
|
|
・
|
励起スペクトルの幅が広いため、種々の波長で励起が可能である。
|
|
・
|
他のタンパク質と結合しても、蛍光色素の特性が変化しない。
|
|

図22 APC 励起蛍光スペクトル
|

図23 R-PE 励起蛍光スペクトル
|
2. キットを用いた標識方法
操作上の注意点など詳細については、取り扱い説明書をご参照いただきたい。なお、キットの取り扱い説明書は小社HPからダウンロードが可能である。
3. キットを用い蛍光タンパク質を標識した抗体の使用例
1) HL60細胞でのCD13検出例
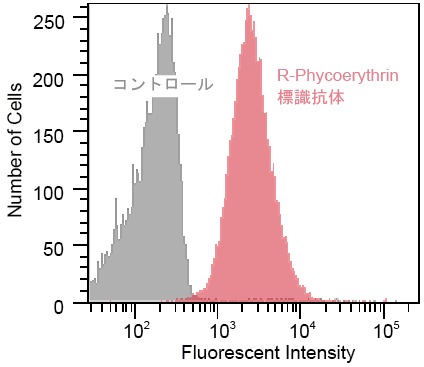
マウス抗CD13抗体(10 μg)をAb-10 Rapid R-Phycoerythrin Labeling Kitを用いてR-Phycoerythrin標識しHL60細胞を免疫染色した。
抗CD44抗体(10 μg)をAb-10 Rapid Fluorescein Labeling Kitを用いてFluorescein標識後HL60細胞を免疫染色した。
 |
<フィルター>
Ex : 488 nm
Em: 564-606 nm
|
| 図24 R-PE標識抗CD13抗体を用いたHL60細胞のフローサイトメトリーによる検出例 |
2) HPB-NULL細胞での使用例
Anti-CD179aモノクロ-ナル抗体HSL-96をR-Phycoerythrin Labeling Kit-NH2 (Code: LK23)を用いて蛍光標識した後、B-precursor ALL細胞株HPB-NULLを染色し、フローサイトメトリーにより二次抗体を用いた間接法と比較した。
直接法では間接法と比べ、陰性画分のバックグラウンドが低く、ほぼ同等の蛍光強度を示し、直接法で標識した抗体においても十分な検出反応を行うことが可能である。
|
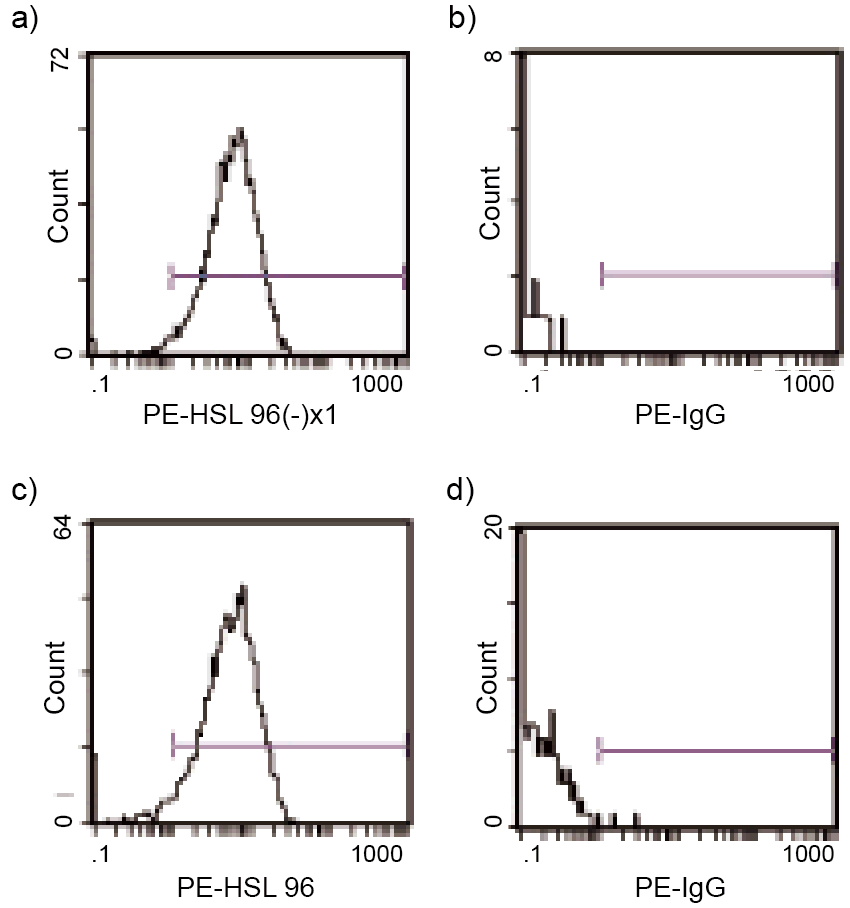
図25 各方法によるフローサイトメトリー測定例
|
a) 直接法: PE-標識HSL-96(R-PE Labeling Kit - NH2)
b) 直接法: PE-標識IgGコントロール
c) 二次抗体法(間接法): 精製HSL-96 + PE標識二次抗体
d) 二次抗体法(間接法): IgGコントロール + PE標識二次抗体
データ提供:
国立成育医療センター研究所
発生・分化研究部 河信敬先生
HSL96抗体提供:
東京医科歯科大学 大学院 医歯学総合研究科
免疫アレルギー学分野 烏山一先生
|
トラブルシューティング
1) アルカリホスファターゼや蛍光タンパク質標識抗体の精製方法
アルカリホスファターゼ標識抗体や蛍光タンパク標識抗体は、アフィニティカラムによる精製で使用される酸性溶離液によって、酵素や蛍光タンパク質が失活するため、アフィニティカラムによる精製法は使用できない。したがって、これらの標識抗体を精製するには、中性条件下のゲル濾過などで精製する必要がある。ただし、抗体の分子量と未反応の酵素もしくは蛍光タンパク質の分子量には大差がないので、非常に長いカラムを使用する必要がある。また、精製の回収率等を考慮すると、ゲル濾過による精製には多くの標識抗体が必要であり、50~200 μgという少量の抗体を標識することを目的とした小社キットに適した方法とはいえない。
反応性を保持した未反応物が原因となるバックグラウンドの上昇が観察される場合は、標識操作の際、活性反応物の濃度を薄めて反応に使用することによって、バックグラウンドの上昇を抑える事ができる可能性がある。
例)R-Phycoerythrin Labeling Kit-NH2(Code: LK23)の場合
【取扱説明書の操作方法】
操作5 Reaction Buffer 10 μlをNH2-Reactive R-Phycoerythrinに加え、よく溶解する。
操作6 NH2-Reactive R-Phycoerythrinを含む溶液をIgGが濃縮されているFiltration Tubeの膜フィルター上に加える。
上記の操作を以下のように変更する。
【バックグラウンドの上昇が観察される場合の操作方法】
操作5 Reaction Buffer 20 μlをNH2-Reactive R-Phycoerythrinに加え、よく溶解する。
操作6 NH2-Reactive R-Phycoerythrinを含む溶液10 μlをIgGが濃縮されているFiltration Tubeの膜フィルター上に加える。