細胞の栄養素取込みアッセイ データ集
・本ページで掲載されてる測定データ 表中のリンクをクリックすると表示されます。
|
取り込み栄養素 |
細胞 |
薬剤・刺激 等 |
データ提供元 |
|---|---|---|---|
| グルコース | ヒト肝がん細胞 (HepG2 cell) |
グルコーストランスポーター阻害剤 (Cytochalasin B) |
小社測定データ |
| グルコース | マウス結腸がん細胞 (Colon26 cell) |
Boric acid, Glucosamine, 2-Deoxy glucose |
前田 浩 先生(株式会社バイオダイナミクス研究所) |
| グルコース | マウス肺がん細胞 (3LL cell) |
解糖系を阻害する化合物 | 鵜殿平一郎先生(岡山大学大学院医歯薬学総合研究科) |
| グルコース | ヒトアストロサイトーマ (U-251MG cell) |
X線照射 | 加藤信哉先生(三重大学 先端科学研究支援センター) |
| グルコース | マウス活性化T細胞 (CD4+T cell) |
解糖系酵素Pgam1欠損細胞 | 山下政克先生(愛媛大学大学院医学系研究科) |
| グルコース | マウス前駆脂肪細胞 (3T3L1 cell) |
マウス前駆脂肪細胞の脂肪細胞への分化 | 松村欣宏先生(東京大学先端科学技術研究センター) |
| グルコース | マウス前駆脂肪細胞 (3T3L1 cell) |
Insulin | 小社測定データ |
| アミノ酸 | ヒト乳がん細胞 (MCF7 cell) |
野生型およびLAT-1過剰発現細胞 | 齊藤康弘先生(慶應義塾大学先端生命科学研究所) |
| アミノ酸 | ヒト子宮頸がん細胞 (HeLa cell) |
LAT阻害剤 (BCH: 2-Aminobicyclo[2.2.1]heptane-2-carboxylic acid) |
小社測定データ |
| アミノ酸 | マウス筋芽細胞 (C2C12 cell) |
卵白ペプチド | 松原守先生(岐阜医療科学大学) |
| シスチン | ヒトアストロサイトーマ (U251 cell) |
野生型およびxCTノックアウト細胞 | 加藤裕教先生(京都大学大学院 生命科学研究科) |
| シスチン | ヒト肺がん細胞(A549 cell) ヒト大腸がん細胞(HCT116 cell) |
xCT阻害剤(スルファサラジン) | 佐谷秀行先生(慶應義塾大学医学部先端医科学研究所) |
| シスチン | ヒトサルコーマ細胞 (HT1080 cell) |
野生型、xCTノックアウト、 xCT過剰発現細胞 |
佐藤英世先生(新潟大学 医学部) |
| シスチン | ヒト肝がん細胞 (HepG2 cell) |
Diethyl maleate | 小社測定データ |
| グルコース, アミノ酸, シスチン, 脂質 |
ヒト肺がん細胞 (A549 cell) |
xCT阻害剤(Erastin) | 小社測定データ |
はじめに
細胞はさまざまな栄養素(グルコース、脂肪酸、アミノ酸など)を取り込み、細胞内代謝を介して細胞の増殖・生存に必要なタンパク質、脂質、核酸およびエネルギーの産生、あるいは細胞内レドックスの維持に寄与している。このような栄養代謝は細胞外環境や細胞の状態、細胞の種類などによって異なっており、近年このような栄養代謝が遺伝子発現を含むさまざまな細胞機能制御にも関与していることが明らかとなっており、注目されている。
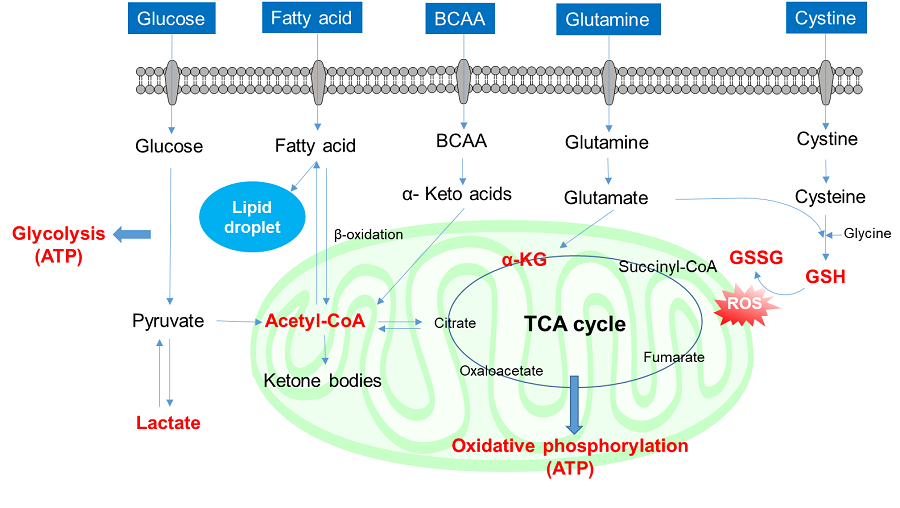
1. グルコース取り込みと細胞内代謝
グルコースは最も重要な栄養素の一つであり、主にグルコーストランスポーター(GLUT)を介して細胞内に取り込まれる。取り込まれたグルコースは、細胞内で代謝されてエネルギー源であるATPの産生や細胞の構成成分である核酸や脂質の合成に利用される。グルコースは細胞内に取り込まれた後、種々の酵素によって代謝され、ピルビン酸へと変換される(解糖系)。その後、ピルビン酸はミトコンドリア内でアセチル-CoAを経由してクエン酸回路(TCAサイクル)に組み込まれ、ATP産生に必要なNADHやFADHの産生に利用される。ATPは解糖系やTCAサイクルの過程でも産生されるが、ミトコンドリアにおけるNADHやFADHを用いた酸化的リン酸化が最も効率的であり、主要なATP産生を担っている。
がん細胞はその高い増殖能を維持するため、大量のグルコースを取り込み、代謝していることが知られている。がん細胞では主に解糖系を用いてATP産生を行うため、解糖系をターゲットとした抗がん剤の開発が古くから進められている。未だ有効な抗がん剤の開発には至っていないが、現在でも解糖系はがん細胞の主要な薬剤ターゲットであり、がん細胞の代謝を理解する上で最も重要な経路である。
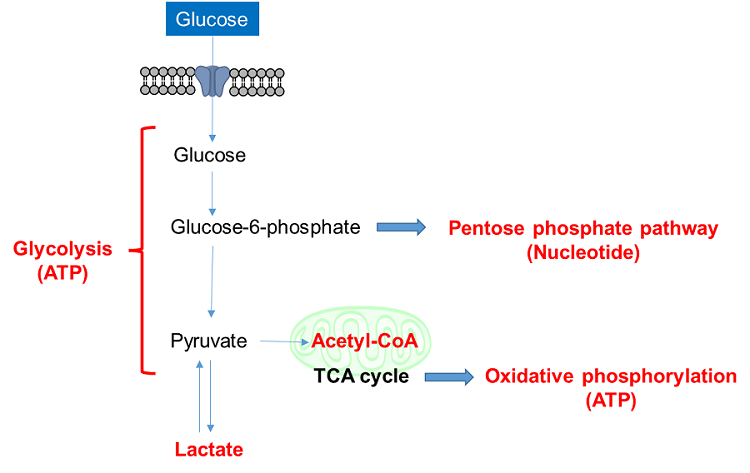
1-1. グルコース取り込みアッセイ法
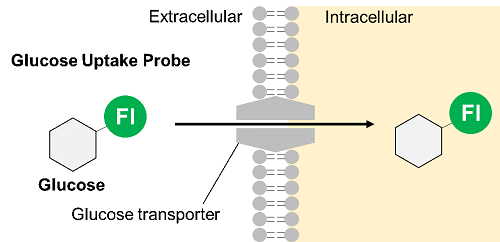
細胞のグルコース取り込み能力を評価する方法として、放射性同位体標識グルコースを用いた方法が古くから用いられている。しかし、放射性化合物であるため、操作が煩雑であり汎用性に欠ける。また2-Deoxy-D-glucose (2-DG) を用いた酵素サイクリング法は比色あるいは蛍光によるプレートアッセイが可能であるが、細胞のイメージングやフローサイトメトリーには適用できない。そのため最近では蛍光標識グルコース誘導体 2-NBDG を用いた方法が広く利用されている。しかしながら、2-NBDG は蛍光強度が弱く感度が低いという課題がある。
そこで当社は2-NBDGに代わる新たな蛍光標識グルコース誘導体 Glucose Uptake Probe (Blue, Green, Red)を開発した。 Glucose Uptake Probe は2-NBDG に比べて非常に明るく、高感度に細胞のグルコース取り込み能力を測定することができる。また、実験系に合わせて3色のプローブから選択することができるため、様々なアプリケーションへの応用が可能である。

|
指標 |
製品名 (表中のリンクから製品の詳細をご覧いただけます) |
|---|---|
|
グルコース取り込み |
1-2. 測定例 -がん細胞のグルコース取り込み-
グルコールトランスポーター阻害剤によるグルコース取り込み阻害
使用細胞: ヒト肝がん細胞, HepG2
使用薬剤: グルコーストランスポーター阻害剤, Cytochalasin B
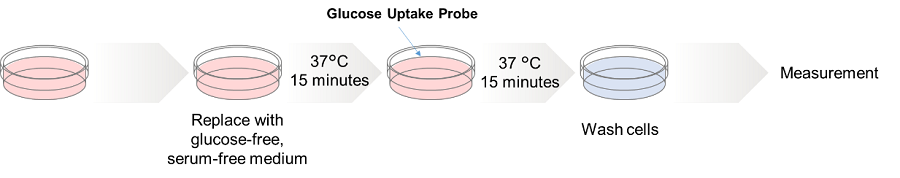
HepG細胞(ヒト肝がん細胞)をグルコーストランスポーター阻害剤Cytochalasin Bを処理した後、Glucose Uptake Probeを用いて細胞のグルコース取り込み能力の変化を蛍光顕微鏡により観察した。その結果、Cytochalasin B処理によってグルコースの取り込み能力は抑制されることが確認された。
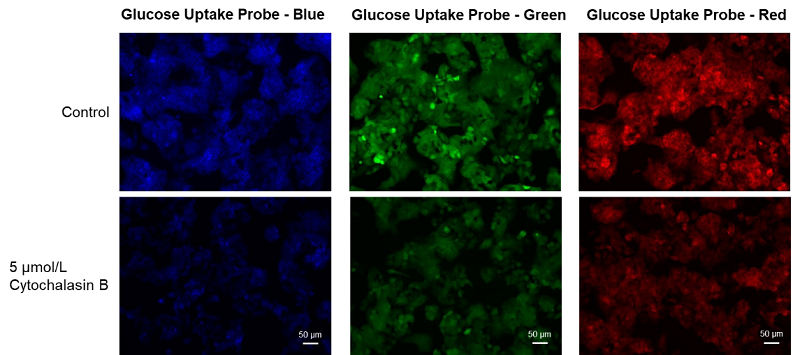
薬剤添加によるグルコース取り込み阻害
前田浩先生(株式会社バイオダイナミクス研究所)よりご提供
使用細胞: マウス結腸がん細胞, Colon26
使用薬剤: Boric acid, Glucosamine, 2-Deoxy glucose
Colon26細胞(マウス結腸がん細胞)に種々の薬剤を添加し、Glucose Uptake Probe-Greenを用いて細胞のグルコース取り込みを測定した結果、薬剤添加によってグルコースの取り込みが抑制され、また薬剤によってその効果は異なっていた。
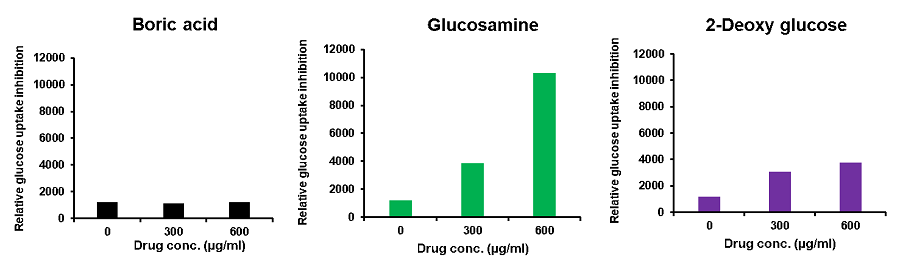
解糖系を阻害する化合物によるグルコール取り込み阻害
鵜殿平一郎先生(岡山大学大学院医歯薬学総合研究科)よりご提供
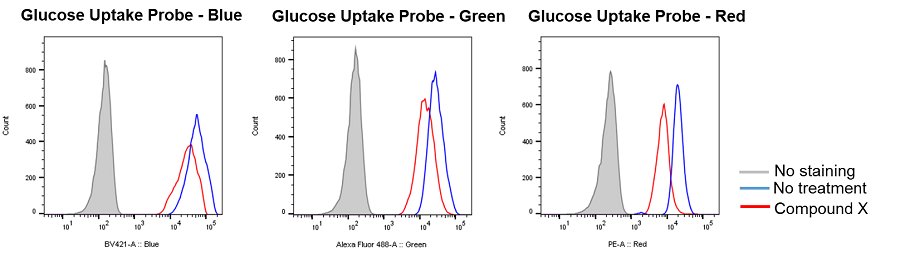
使用細胞: マウス肺がん細胞, 3LL
使用薬剤: 解糖系を阻害する化合物(非開示 Compound Xで表記)
3LL細胞(マウス肺がん細胞)に解糖系を阻害する化合物(Compound X)を添加し、Glucose Uptake Probeを用いて細胞のグルコース取り込みをフローサイトメーターにより測定した結果、Compound Xにより細胞のグルコース取り込みは抑制された。
X線照射によるグルコース取り込み低下
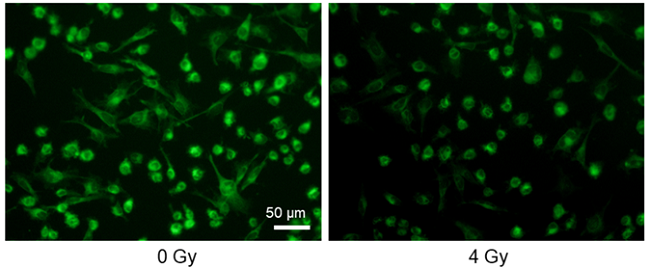
加藤信哉先生(三重大学 先端科学研究支援センター)よりご提供
使用細胞: ヒトアストロサイトーマ細胞, U-251MG
刺激方法: X線照射
U-251MG細胞(ヒトアストロサイトーマ)にX線照射を行うことにより、細胞のグルコース取り込み能力は低下した。
1-3. 測定例 -免疫細胞のグルコース取り込み-
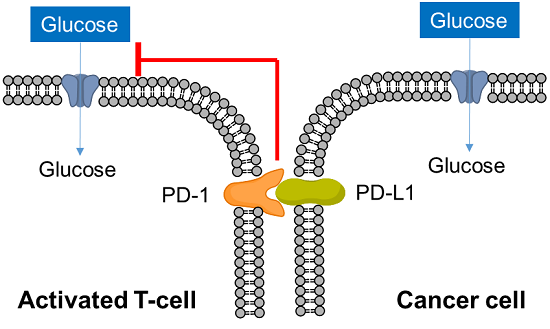
がん細胞を排除するための免疫システムの中心的な役割を果たしているのがT細胞である。近年、T細胞の分化や活性化などの機能制御にも代謝が関与していることが明らかとなり、がん免疫における代謝研究が活発になっている。がん細胞は大量の栄養素を取り込み増殖活性を維持しているが、活性化T細胞もがん細胞を排除するため大量の栄養素、特にグルコースを必要としている。そのため、活性化T細胞とがん細胞は腫瘍局所で“グルコースの奪い合い”という戦いを繰り広げている。
免疫チェックポイント分子である活性化T細胞表面上のPD-1に対し、がん細胞はPD-L1を発現してT細胞の活性を抑制していることはよく知られているが、この相互作用がT細胞のグルコース取り込みを抑制していることが近年の研究によって明らかとなっている。がん細胞はこのように免疫系から回避するために免疫細胞の代謝をも制御しており、がん免疫の研究分野ではがん細胞だけでなく、免疫細胞の代謝を理解することが重要となっている。
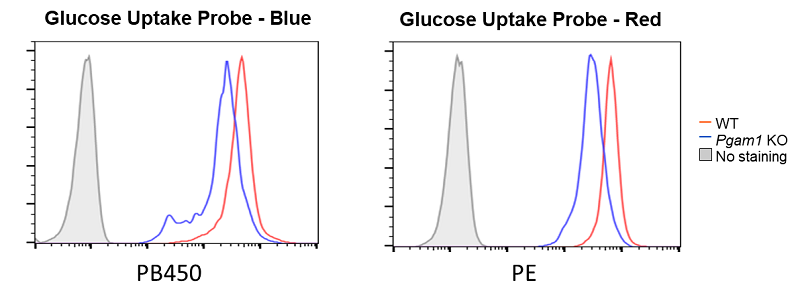
解糖系酵素Pgam1の欠損によるグルコール取り込み低下
山下政克先生(愛媛大学大学院医学系研究科)よりご提供
使用細胞: マウス活性化T細胞, CD4+ T細胞, 解糖系酵素Pgam1欠損
CD4+ T細胞(マウス活性化T細胞)の解糖系酵素Pgam1を欠損させることによりグルコース取り込みが低下することが確認された。
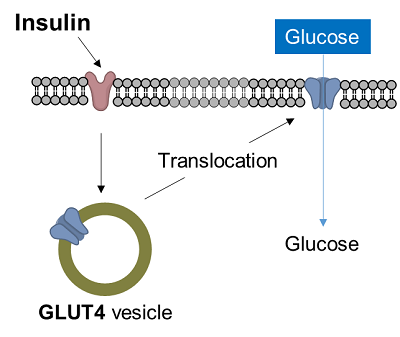
1-4. 測定例 -脂肪細胞のグルコース取り込み-
糖尿病は血液中のグルコースが細胞内に取り込まれず、血糖値が上昇する病気である。筋肉細胞や脂肪細胞では、インスリン刺激によってグルコーストランスポーターの一つであるGLUT4が細胞膜表面に移行し、グルコースの取り込みを促進する。このようなインスリン応答性のグルコース取り込みは、糖尿病と深く関わっており、糖尿病の解明や治療法の開発において重要なターゲットとなっている。
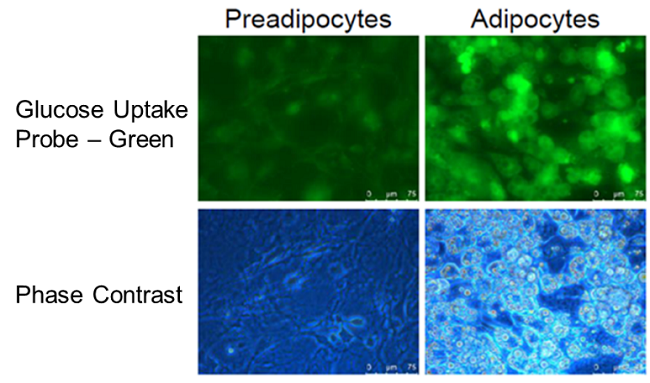
脂肪細胞への分化に伴うグルコース取り込み促進
松村欣宏先生(東京大学先端科学技術研究センター)よりご提供
使用細胞: マウス前駆脂肪細胞, 3T3L1
マウス前駆脂肪細胞の脂肪細胞への分化に伴い、グルコースの取り込み能力が増加したことが確認された。
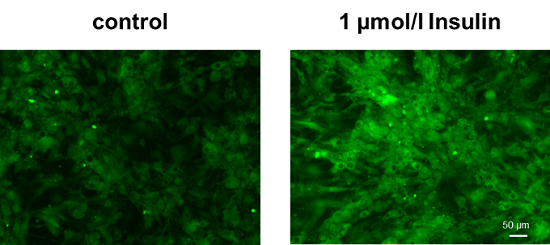
インスリン添加に伴う脂肪細胞のグルコース取り込み促進
使用細胞: マウス前駆脂肪細胞, 3T3L1
マウス前駆脂肪細胞から分化した脂肪細胞に、インスリンを添加することによってグルコースの取り込みが促進した。
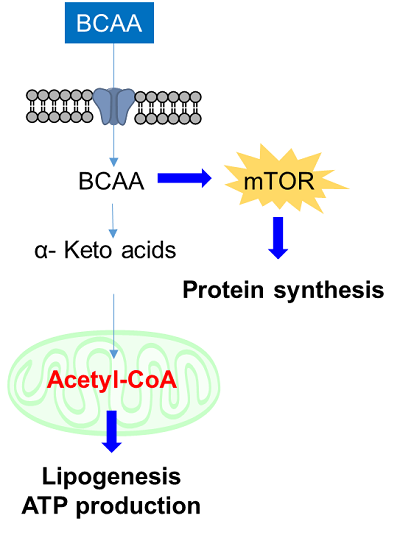
2. アミノ酸取り込みと細胞内代謝
アミノ酸は細胞内のエネルギー産生やタンパク質や脂質、核酸合成に必須の栄養素であり、主にトランスポーターを介して細胞内に取り込まれる。がん細胞では、細胞増殖と亢進した細胞内代謝を維持するために、糖や脂肪酸と同様にアミノ酸を大量に取り込んでおり、アミノ酸トランスポーターは、がんの診断や創薬ターゲットとして注目されている。例えば、L-type amino acid transporter 1 (LAT1)は、多くのがん細胞で特異的に発現しているアミノ酸トランスポーターの一つであり、BCAA(Branched-chain amino acids)を含む必須アミノ酸を取り込むことが知られている。近年、特にBCAAはがん細胞の主要なタンパク質合成やエネルギー産生に関与する必要不可欠な栄養素として注目され、研究が活発に行われている。
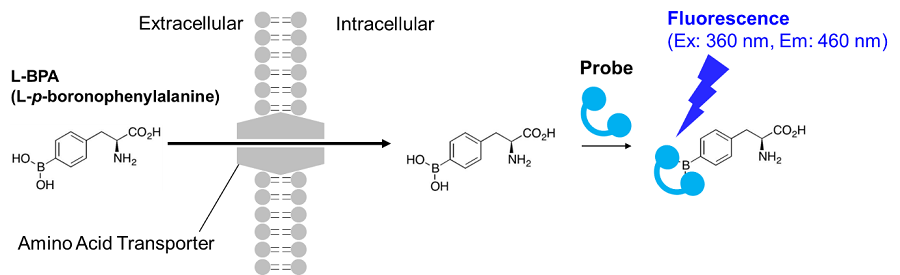
2-2. アミノ酸取り込みアッセイ法
アミノ酸トランスポーター活性を測定する方法として、古くから放射性同位体標識したアミノ酸の取り込みアッセイ法が用いられている。しかし、放射性同位体を使用しているため取り扱いが面倒であり、汎用的とは言えない。そこで当社は、切畑らが開発した蛍光プローブを用いた測定をキット化した。本手法で使用するL-BPA(L-boronophenylalanine)は、がんの治療法の一つであるホウ素中性子補足療法(BNCT)に用いられるアミノ酸類似体であり、アミノ酸トランスポーターであるLAT(Large neutral amino acid transporter)を介して細胞内に取り込まれることが知られている。細胞内に取り込まれたBPAは、BPAと特異的に結合して蛍光を発するプローブによって検出(λex=360 nm, λem= 460 nm)することが可能である。本技術は蛍光イメージング、プレートリーダー測定、フローサイトメトリーに適用可能であり、細胞のアミノ酸取り込み能力の評価やアミノ酸トランスポーター阻害剤のスクリーニングに有用である。
|
指標 |
製品名 (表中のリンクから製品の詳細をご覧いただけます) |
|---|---|
|
アミノ酸取り込み |
2-2. 測定例 -アミノ酸取り込み-
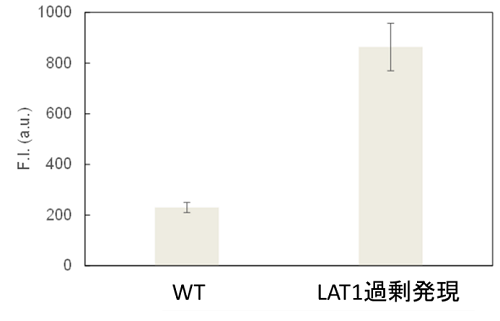
LAT1過剰発現細胞のアミノ酸取り込み促進
齊藤康弘先生(慶應義塾大学先端生命科学研究所)よりご提供
使用細胞: MCF
LAT-1過剰発現MCF7細胞のアミノ酸取り込みは、野生型に比べ大きく増加した。
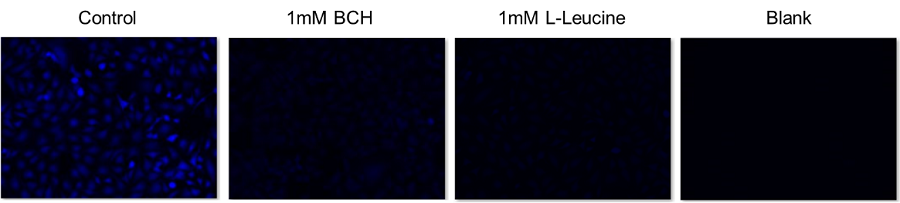
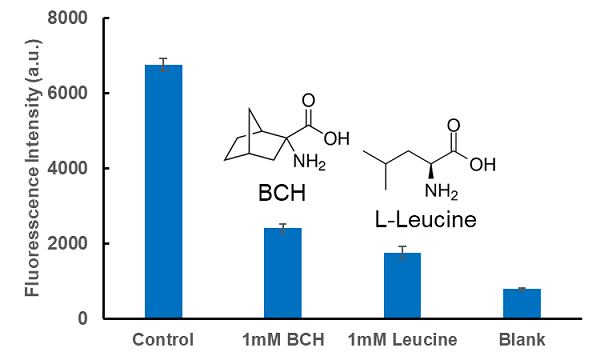
LAT1阻害剤BCHによるアミノ酸取り込み阻害
使用細胞: ヒト子宮頸がん細胞, HeLa
阻害薬剤: LAT1阻害剤, BCH (2-Aminobicyclo[2.2.1]heptane-2-carboxylic acid) および L-Leucine
LAT阻害剤であるBCHおよびBCAAの一つであるL-Leucineを添加することによってBPAの細胞内への取り込みは抑制された。
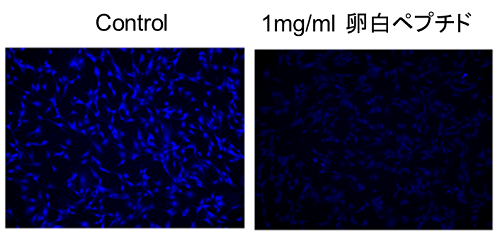
卵白ペプチド添加によるアミノ酸取り込み阻害
松原守先生(岐阜医療科学大学)よりご提供
使用細胞: マウス筋芽細胞, C2C12
卵白ペプチド添加によってアミノ酸の細胞内への取り込みが抑制された。
3. シスチン取り込みと細胞内代謝
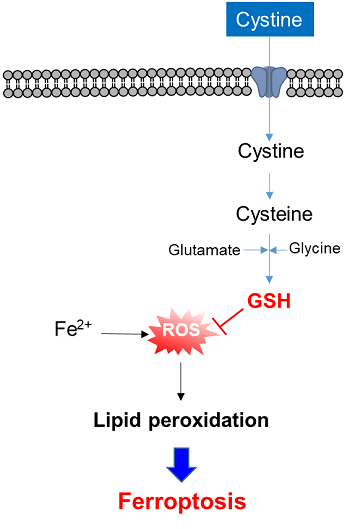
3-1. シスチン取り込みアッセイ法
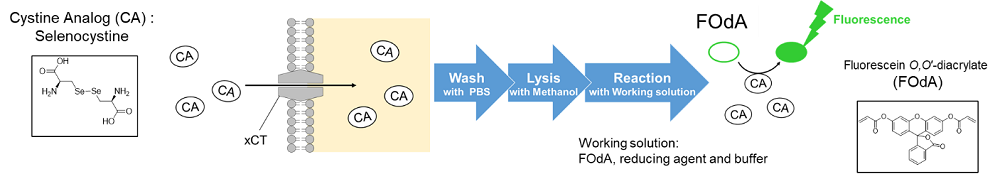
xCT活性を測定する方法として、古くから放射性同位体標識シスチンの取り込みアッセイ法が用いられている。しかし、放射性同位体を使用するため取り扱いが面倒であり、汎用的とは言えない。Cystine Uptake Assay Kitは、xCT活性を蛍光法によって簡便に測定するためのキットである。キットに含まれるCystine Analog (CA) は、シスチンと同様にxCTを経由して細胞内に取り込まれるため、細胞内に取り込まれたCAを蛍光検出することでxCT活性を測定することが可能である。
|
指標 |
製品名 (表中のリンクから製品の詳細をご覧いただけます) |
|---|---|
|
シスチン取り込み |
3-2. 測定例 -シスチン取り込み-
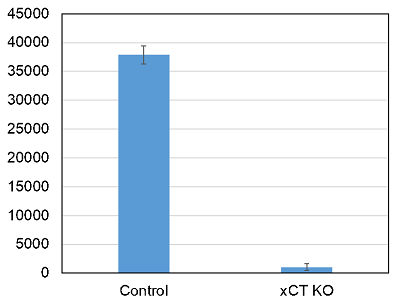
野生型細胞とxCTノックアウト細胞のシスチン取り込み
加藤裕教先生(京都大学大学院 生命科学研究科)よりご提供
使用細胞: ヒトアストロサイト―マ, U251
xCTノックアウト細胞ではほとんどシスチンの取り込みは観察されなかった。
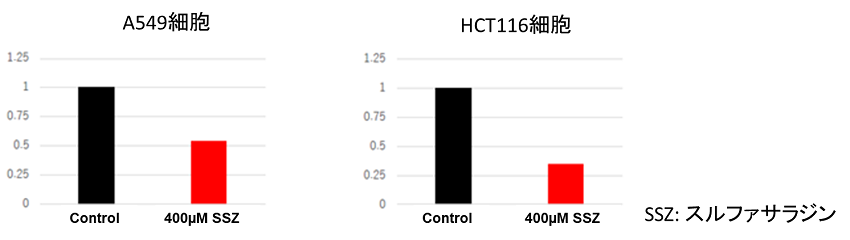
スルファサラジン添加によるシスチン取り込み阻害
佐谷秀行先生(慶應義塾大学医学部先端医科学研究所)よりご提供
使用細胞: ヒト肺がん細胞, A549 / ヒト肺がん細胞, HCT116
使用薬剤: シスチントランスポーター阻害剤, スルファサラジン
xCT阻害剤であるスルファサラジン(SSZ)を添加することによってシスチンの取り込みは抑制された。
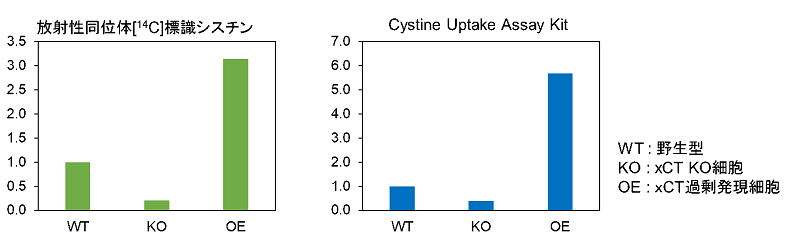
放射性同位体標識法との比較: xCTノックアウトおよび過剰発現細胞のシスチン取り込み
佐藤英世先生(新潟大学 医学部)よりご提供
使用細胞: ヒトサルコーマ細胞, HT1080
本アッセイでは放射性同位体標識シスチンを用いたシスチン取り込みアッセイ法と相関性のあるデータを示した。
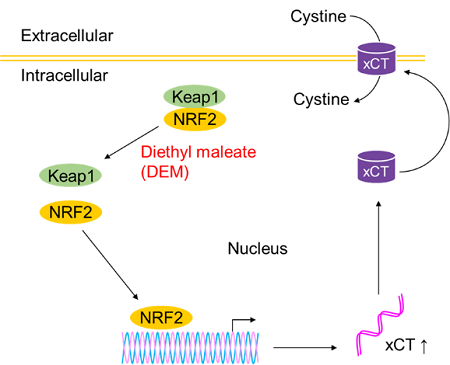
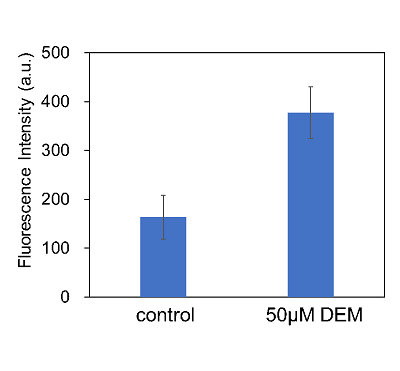
Diethyl maleate(DEM)添加によるシスチン取り込み促進
使用細胞: ヒト肝がん細胞, HepG2
DEM添加によって細胞のシスチン取り込みが促進することが確認された。これはDEM処理によりKeap1がKeap1-Nrf2系を介してxCT発現が誘導されたためだと考えられる。
4. 栄養素取り込み変化のトータル解析
細胞は一つの刺激に対して多くの機能を変化させて応答する。栄養素取り込みもその一つであり、細胞の各栄養素の取り込み変化を総合的に解析することは栄養代謝に関わる細胞機能を解明する上で重要となる。
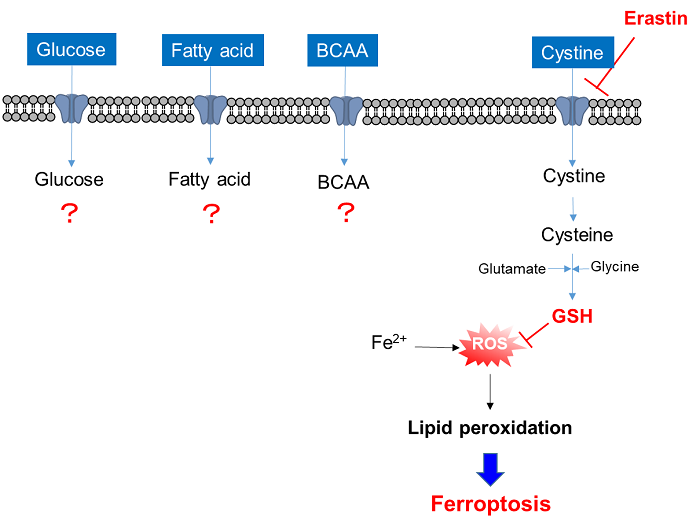
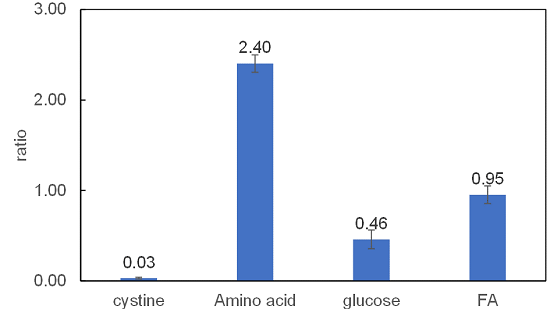
xCT阻害剤Erastin添加による栄養素取り込み変化の解析
使用細胞: ヒト肺がん細胞, A549
使用薬剤: シスチントランスポーター阻害剤, Erastin
xCT阻害剤Erastin添加により、シスチンの取り込みは完全に阻害された。またグルコースの取り込みは抑制され、アミノ酸取り込みは大きく増加した。脂肪酸取り込みはほとんど変化は観察されなかった。詳細は不明であるが、Erastin添加によって栄養代謝がグルコース代謝からアミノ酸代謝にシフトした可能性が考えられる。
関連の学術情報





