MT-1 MitoMP Detection Kit

MT-1ミトコンドリア膜電位検出キット
- 生細胞で使用できる、染色後に固定化できる
- ミトコンドリア膜電位のモニタリングができる
- ミトコンドリア膜電位の変化を高感度に検出できる
-
製品コードMT13 MT-1 MitoMP Detection Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥33,800 | 343-09781 |
<使用回数の目安> 1 set あたり、35 mm dish 30 枚
| 1 set | MT-1 Dye Imaging Buffer (10x) |
20 μl ×3本 11 ml ×1本 |
|---|
性質
ミトコンドリアは酸素を利用しATPを合成することで細胞に必要なエネルギーを産出しており、重要なオルガネラの一つです1)。ミトコンドリア活性の低下や機能障害は、癌や老化、アルツハイマー病やパーキンソン病等の神経変性疾患などと密接にかかわることが知られています2), 3)。そのため、ミトコンドリア活性の指標の一つとしてよく用いられているミトコンドリア膜電位はミトコンドリア関連疾患の有望なターゲットとして広く研究されています。
参考文献
1) K. F. Ferri, et al., J. Exp. Med., 2000, 192, 1081.
2) N. Matsuda, et al., J. Cell Biol., 2010, 189, 211.
3) J. L. Wang, et al., PNAS, 2000, 97, 7124.
ミトコンドリア形態観察・ミトコンドリア膜電位観察のコツ
実験成功のための「購入前の抑えるポイント・実験のコツ」について、実際に小社で取得したデータを用い動画で判りやすく解説しています。
-
① ミトコンドリア形態・動態観察のコツ [2:10~]
1.染色方法の選定
低分子蛍光色素・蛍光タンパクの遺伝子発現・免疫染色法 2.染色色素の特性を理解する
蛍光特性、染色後の結合性、染色の方法 3.観察時の確認事項と検討方法
蛍光の漏込・Z軸の情報・タイムラプスイメージング
-
② ミトコンドリア膜電位観察のコツ [16:17~]
-
既存の低分子色素「JC-1, TMRE,TMRM, MT-1」について 1.各色素の特性
2.耐光性とタイムラプスイメージング
3.固定化操作の影響
マニュアル
技術情報
従来試薬の3つの課題を解決
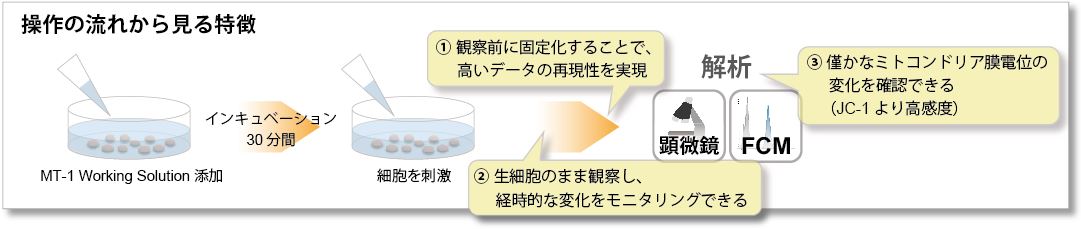
ミトコンドリア膜電位を観察する際、JC-1やTMRE、TMRMが使用されていますが、PFA固定不可、光退色などの試薬特性により、データの再現性に課題がありました。MT-1 MitoMP Detection Kitは、これらの課題を克服したミトコンドリア膜電位の検出キットです。
さらに、本キットに含まれる Imaging Bufferにより、蛍光バックグラウンドと細胞へのダメージを抑えた状態で観察することができます。
① 固定化後も蛍光強度を維持
汎用のミトコンドリア膜電位検出試薬(JC-1、TMRE)は、細胞を固定化処理すると蛍光が失われるため、生細胞を用いる必要があります。一方で僅かな細胞状態の変化によりミトコンドリア膜電位は変動するため、生細胞を用いる際にはデータの再現性取得には細心の注意が必要でした。
MT-1 は、染色後のPFA固定化操作を行っても蛍光が保持されるため、再現性の高い実験を行う事が可能です。
Ex: 530-560 nm, Em: 570-640 nm
スケールバー: 100 μm
細胞:HeLa細胞
② モニタリングが可能
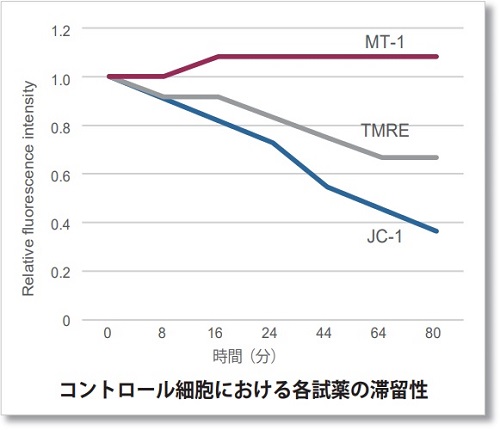
薬剤刺激を行っていないコントロール細胞を各試薬で染色し、蛍光強度の変化を確認しました。結果、JC-1やTMREは染色から約10分程で蛍光強度が低下し、MT-1は一定に蛍光強度を保ちました。
 |
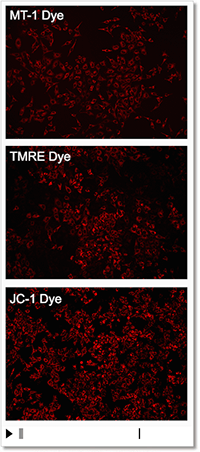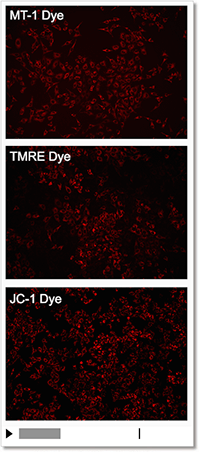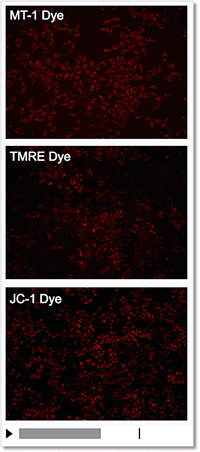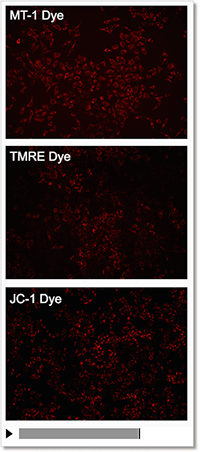 |
| 検出条件 Ex: 530-560 nm, Em: 570-640 nm スケールバー:100 µm 細胞:HeLa細胞 |
③ 高感度検出が可能
わずかなミトコンドリア膜電位の変化は、JC-1では検出困難なケースがあり、その際にTMREが用いられてきました。MT-1はTMREと同等の検出感度を実現しています。
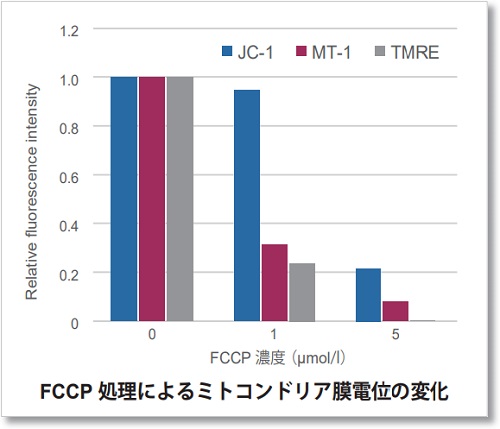
Ex: 530-560 nm, Em: 570-640 nm
細胞:HeLa細胞
各試薬との比較
| 化合物(製品名) | 特徴 |
固定化 |
感度 | モニタリング | 装置の対応 | 検出 |
|---|---|---|---|---|---|---|
|
JC-1 |
※初めての方へオススメ ・JC-1の溶けにくいを解消 ・キット化で簡便な測定 ・論文実績が最も多い |
× | △ | × |  |
緑 Ex :450-490 nm Em:500-550 nm 赤 Ex :530-560 nm Em:570-640 nm |
|
本製品 |
※より詳細に解析したい方へオススメ |
〇 | 〇 | 〇 |  ※プレートリーダーの実績有 |
赤 Ex :530-560 nm Em:570-640 nm |
| TMRE | ・ミトコンドリア膜電位の検出に広く使用されている | × | 〇 | × |  |
赤 Ex :530-560 nm Em:570-640 nm |
操作の流れ
|
|
実験例:脱分極による評価例
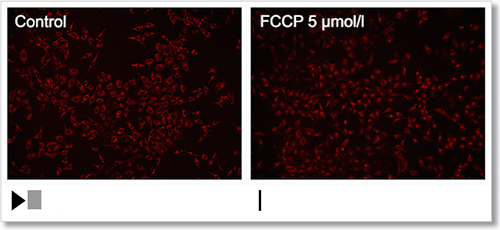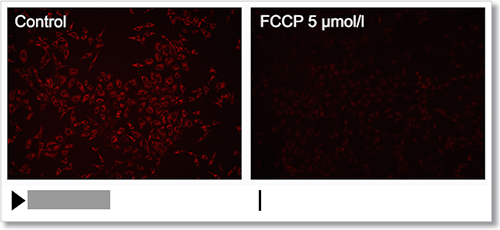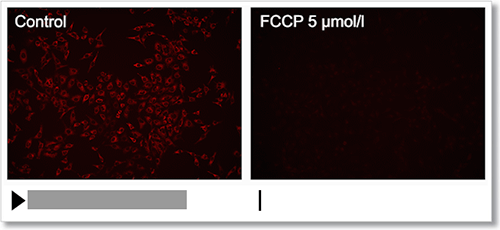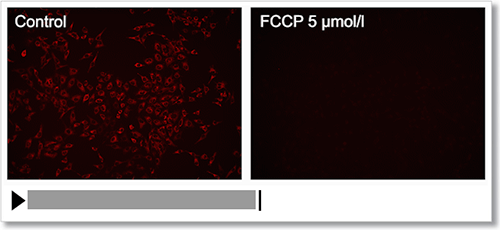
HeLa 細胞を脱分極剤であるcarbonylcyanide-p-trifluoromethoxyphenylhydrazone(FCCP)にて処理し、本キットで膜電位の変化をタイムラプス観察しました。
結果、FCCP で処理した細胞はミトコンドリア膜電位が低下する様子を確認できました。
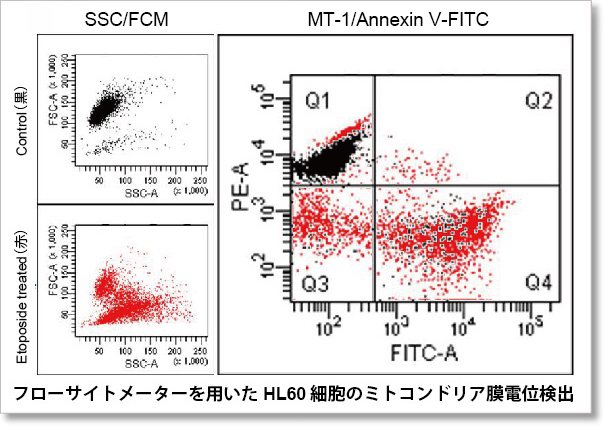
実験例:アポトーシス誘導時のミトコンドリア膜電位変化
あらかじめMT-1で染色したHL60細胞に を添加してアポトーシスを誘導したのち、Annexin V, FITC Conjugate と共染色してフローサイトメトリーで解析しました。
を添加してアポトーシスを誘導したのち、Annexin V, FITC Conjugate と共染色してフローサイトメトリーで解析しました。
結果、Annexin V-FITC由来の蛍光強度変化(緑色蛍光強度の増加)からアポトーシスの進行と、MT-1由来の蛍光強度変化(赤色蛍光強度の低下)からミトコンドリア膜電位の変化が確認されました。
検出条件
Annexin V-FITC(緑): Ex. 488 nm / Em. 500 - 560 nm
ミトコンドリア膜電位(MT-1、赤):Ex 488 nm / Em 564-604 nm
実験例:ミトコンドリアスーパーオキサイドと膜電位の同時測定
HeLa細胞をHBSSにて洗浄後、本製品と小社ミトコンドリアスーパーオキサイド検出試薬(MitoBright ROS Deep Red 製品コード:MT16)を用いて共染色し、発生したミトコンドリアROSと膜電位を同時に観察しました。
その結果、いずれの条件でもミトコンドリアROSの発生に伴うミトコンドリア膜電位の低下を同時に観察することが出来ました。
<実験操作>
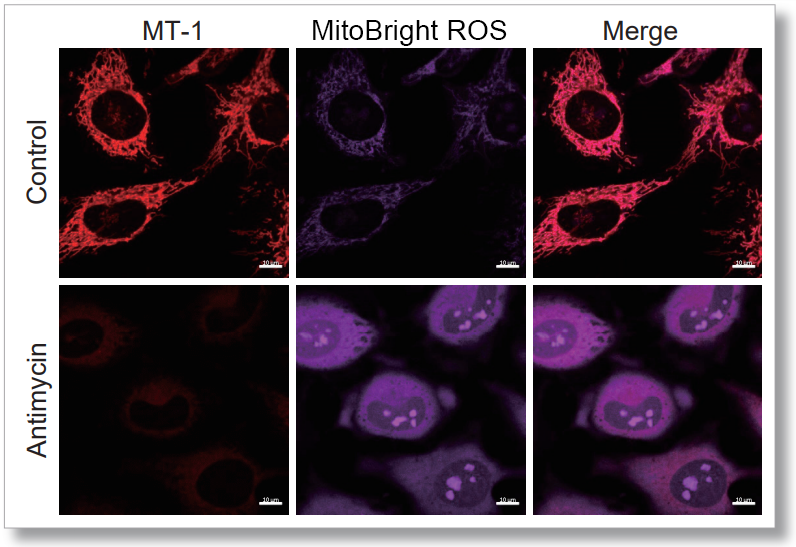
検出条件(共焦点レーザー蛍光顕微鏡)
MT-1: Ex = 561, Em = 560-600 nm
MitoBright ROS: Ex = 633 nm, Em = 640-700 nm
スケールバー:10 µm
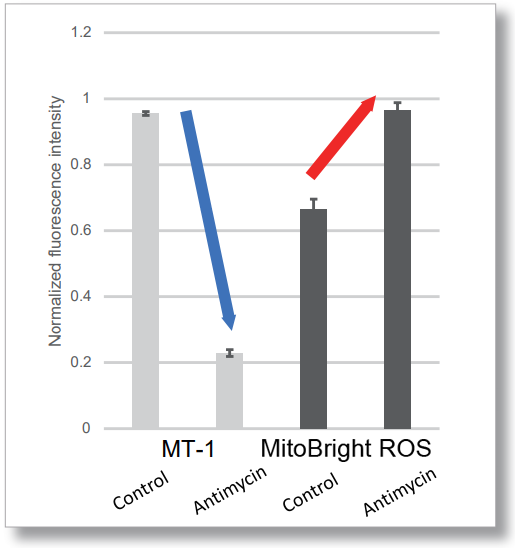
検出条件(マイクロプレートリーダー)Tecan, Infinite M200 Pro
MT-1: Ex = 540-550 nm, Em = 590-610 nm (Gain = 200)
MitoBright ROS :Ex = 545-555 nm, Em = 665-685 nm
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞 (STHdh cell) |
蛍光顕微鏡 | N. Okada, T. Yako, S. Nakamura, M. Shimazawa, H. Hara, "Reduced mitochondrial complex II activity enhances cell death via intracellular reactive oxygen species in STHdhQ111 striatal neurons Q1 with mutant huntingtin", J. Pharmacol. Sci., 2021, doi:10.1016/j.jphs.2021.09.001. |
| 2 | 細胞 (膵臓癌細胞) |
蛍光顕微鏡 | N. Okuni, Y. Honma, T. Urano, K. Tamura, "Romidepsin and  cooperatively induce senescence of pancreatic cancer cells through downregulation of FOXM1 expression and induction of reactive oxygen species/lipid peroxidation", Mol. Biol. Rep., 2022, doi:10.1007/s11033-022-07192-9. cooperatively induce senescence of pancreatic cancer cells through downregulation of FOXM1 expression and induction of reactive oxygen species/lipid peroxidation", Mol. Biol. Rep., 2022, doi:10.1007/s11033-022-07192-9. |
| 3 | 細胞 (BM Cells) |
蛍光顕微鏡 | Y. Aoyagi, Y. Hayashi, Y. Harada, K. Choi, N. Matsumura, D. Sadato, Y. Maemoto, A. Ito, S. Yanagi, D. Starczynowski, H. Harada, "Mitochondrial Fragmentation Triggers Ineffective Hematopoiesis in Myelodysplastic Syndromes", Cancer Discovery, 2022, doi:10.1158/2159-8290.CD-21-0032. |
| 4 | 細胞 (ハエの間接飛行筋肉細胞) |
蛍光顕微鏡 | N. Nozawa, M. Noguchi, K. Shinno, M. Tajima, S. Aizawa, T. Saito, A. Asada, T. Ishii, M. Ishizuka, K. Iijima and K. Ando, " acid and sodium ferrous citrate ameliorate muscle aging and extend healthspan in Drosophila", FEBS Open Bio, 2022, doi:10.1002/2211-5463.13338. acid and sodium ferrous citrate ameliorate muscle aging and extend healthspan in Drosophila", FEBS Open Bio, 2022, doi:10.1002/2211-5463.13338. |
| 5 | 細胞 (悪性中皮腫細胞) |
蛍光顕微鏡 | Y. Sakai, M. Taguchi, Y. Morikawa, H. Miyazono, K. Suenami, Y. Ochiai, E. Yanase, T. Takayama, A. Ikari, T. Matsunaga, "Apoptotic mechanism in human brain microvascular endothelial cells triggered by 40-iodo-α-pyrrolidinononanophenone: Contribution of decrease in antioxidant properties", Toxicol. Lett., 2022, doi:10.1016/j.toxlet.2021.11.018. |
| 6 | 細胞 (MIN6-M9) |
蛍光顕微鏡 | R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, "Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER", 2022, iScience, doi:10.1016/j.isci.2022.104603. |
| 7 | 細胞 (SH-SY5Y) |
フローサイトメーター | M. Hashimoto, M. Fujimoto, K. Konno, M. L. Lee, Y. Yamada, K. Yamashita, C. Toda, M. Tomura, M. Watanabe, O. Inanami and H. Kitamura, "Ubiquitin-Specific Protease 2 in the Ventromedial Hypothalamus Modifies Blood Glucose Levels by Controlling Sympathetic Nervous Activation", J. Neurosci., 2022, doi:10.1523/JNEUROSCI.2504-21.2022. |
| 8 | 細胞 (ヒト皮膚線維芽細胞) |
蛍光顕微鏡 | Y. Takeda and P. Dai, "Chronic Fatty Acid Depletion Induces Uncoupling Protein 1 (UCP1) Expression to Coordinate Mitochondrial Inducible Proton Leak in a Human-Brown-Adipocyte Model", 2022, doi:10.3390/cells11132038. |
| 9 | 細胞 (精子) | 蛍光顕微鏡 | A. Gotoh, M. Takeshima and K. Mizutani, "Near-anoxia induces immobilization and sustains viability of sperm stored in ant queens", Sci. Rep., 2023, doi:10.1038/s41598-023-29705-7. |
| 10 | 細胞 (髄核細胞) |
蛍光顕微鏡 (細胞数補正:Hoechst 33342) |
K. Suyama, D. Sakai, S. Hayashi, N. Qu, H. Terayama, D. Kiyoshima, K. Nagahori and M. Watanabe, "Bag-1 Protects Nucleus Pulposus Cells from Oxidative Stress by Interacting with HSP70", Biomedicines, 2023, doi:10.3390/biomedicines11030863. |
| 11 | 細胞 (HL60, KG1a) |
フローサイトメーター | K Kamachi, H Ureshino, T Watanabe,N Yoshida-Sakai,Y Fukuda-Kurahashi, K Kawasoe,T Hoshiko, Y Yamamoto, Y Kurahashi,and S Kimura , "Combination of a New Oral Demethylating Agent, OR2100, and Venetoclax for Treatment of Acute Myeloid Leukemia", Cancer Res Commun., 2023, doi:10.1158/2767-9764.CRC-22-0259. |
| 12 | 細胞 (RAW264) |
蛍光顕微鏡 | H. Gu, Y. Zhu, J. Yang, R. Jiang, Y. Deng, A. Li, Y. Fang, Q. Wu, H. Tu, H. Chang, J. Wen and X. Jiang, "Liver-Inspired Polyetherketoneketone Scaffolds Simulate Regenerative Signals and Mobilize Anti-Inflammatory Reserves to Reprogram Macrophage Metabolism for Boosted Osteoporotic Osseointegration", Adv sci, 2023, doi:10.1002/advs.202302136. |
よくある質問
-
Q
タイムラプスイメージングする場合の注意点はありますか?
-
A
注意点として、励起光を最小限に抑え、検出感度を上げて撮影してください。
細胞への断続的な励起光の照射は、細胞へのダメージと蛍光色素の分解を引き起こす可能性がありますので、インターバルの時間などをご検討ください。
-
Q
本品で染色後、細胞の固定化は可能ですか?
-
A
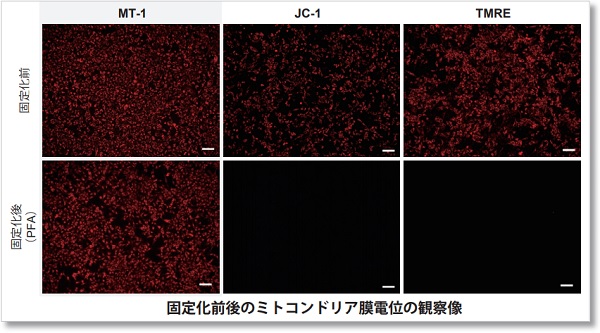
染色後、4% PFAで細胞を固定化できますが、膜透過処理は色素が漏れ出す原因となるためできません。(推奨固定化時間:15-30分)
また、固定化を行った場合、蛍光強度は維持されていますが(左:全体像参照)、MT-1の局在が変化することが確認されております(右:拡大図参照)。そのため、固定化を行った際には、ミトコンドリア膜電位の蛍光強度変化のみをご参照ください。
構造情報を含めてミトコンドリアの膜電位を確認されたい場合には、生細胞で観察されることを推奨いたします。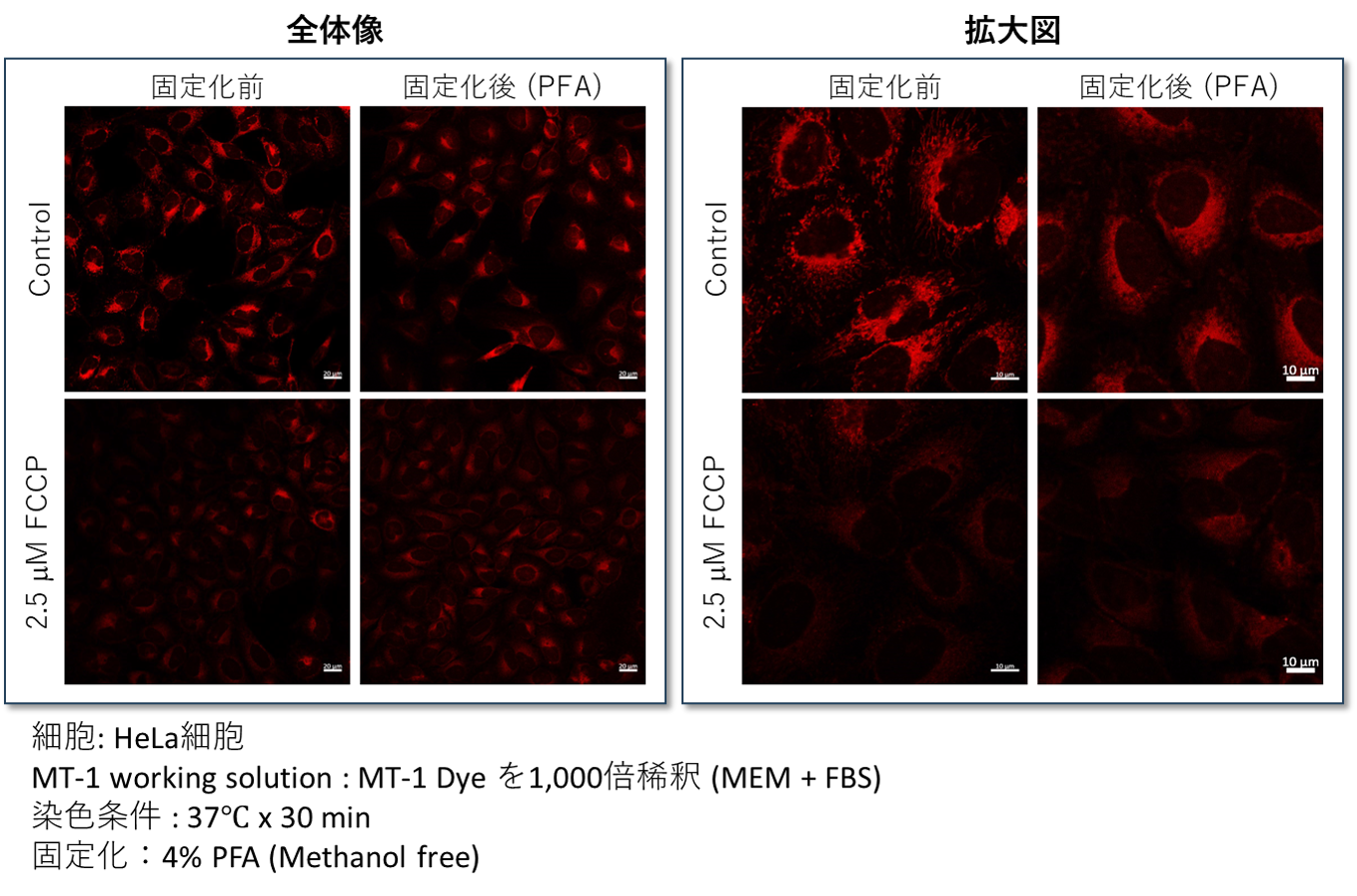
-
Q
細胞を固定化後に染色することは可能ですか?
-
A
ミトコンドリア膜電位に依存してミトコンドリアに集積するため、固定化後の染色はできません。
-
Q
蛍光強度を比較する場合のポジティブコントロールになる実験例はありますか?
-
A
ポジティブコントロールとして、取扱説明書にFCCP(carbonylcyanide-p-trifluoromethoxyphenylhydrazone)を用いた実験例を掲載しています。
-
Q
染色条件を検討する場合、MT-1 Dyeはどれくらいの濃度で使用すればよいですか?
-
A
MT-1 Dyeの濃度は1000倍希釈での使用を推奨しておりますが、染色条件を最適化される場合は以下をご参考ください。
<蛍光強度が弱い場合>
500~1,000倍希釈の間でご検討ください。
<非特異吸着がみられる場合>
1,000~2,000倍希釈の間でご検討ください。
-
Q
HBSSは どのようなものを使用すればよいですか?
-
A
フェノールレッドフリーのHBSS(+)をご使用ください。
(使用実績のあるHBSS)
製品名:HBSS(1x), メーカー:GIBCO, Code:14025-092
-
Q
MT-1 working solutionの添加後、洗浄操作を行わずに観察できますか?
-
A
染色後は未洗浄でも観察可能ですが、未洗浄での長時間観察は細胞毒性を生じる可能性があるため、お勧めしません。
上澄みを除いて、ご使用の培地へ置換することをお勧めします。
-
Q
MT-1 working solutionの調製にバッファーは使用できますか?
-
A
Hanks’ HEPES やHBSSが使用可能です。また、10 % FBS含有MEM、RPMI、MEMを用いて調製することもできます。
-
Q
MT-1で染色後の洗浄には、HBSSの代わりにPBSを使用できますか?
-
A
細胞へのダメージを軽減するため、HBSSの使用を推奨しております。
HBSSがお手元にない場合は培地での洗浄をお勧めします。
取扱条件
| 保存条件: 冷凍,遮光 | |
|
危険・有害 シンボルマーク |

|
|---|---|