PlasMem Bright Green

細胞膜染色試薬 Green
- 生細胞で使用できる、染色後に固定化できる
- 低毒性で試薬の滞留性が高い
- 培地に試薬を加えるだけ
-
製品コードP504 PlasMem Bright Green
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 μl | ¥30,200 | 349-09761 |
<使用回数の目安> 100 μl あたり、35 mm dish 10 枚、μ-Slide 8 well 10 枚
性質
細胞膜は細胞の内外を隔てる役割を担っており、細胞の移動や伸張、神経シグナル伝達などの細胞機能に関係しています。
そのため、細胞膜の異常は細胞の状態やチャネル病のような様々な疾患と密接に関連しており、非常に重要なバイオマーカーの一つとして考えられています。
細胞膜染色の手法として、低分子色素を用いる方法は、簡便な操作方法かつ生細胞で使用できるため、最も広く使われていますが、細胞膜への滞留性や水溶性低下等課題があります。
PlasMem Bright色素はこれまでの既存の低分子色素の課題を克服した製品です。PlasMem Bright色素を用いて細胞膜の観察を行った場合、染色後一日以上細胞膜を染色し続けることが可能です。
(スケールバー:10 µm)
参考文献) Masataka Takahashi et al., "Amphipathic Fluorescent Dyes for Sensitive and Long-Term Monitoring of Plasma Membranes".bioRxiv., 2020, doi:10.1101/2020.11.16.379206.
マニュアル
技術情報
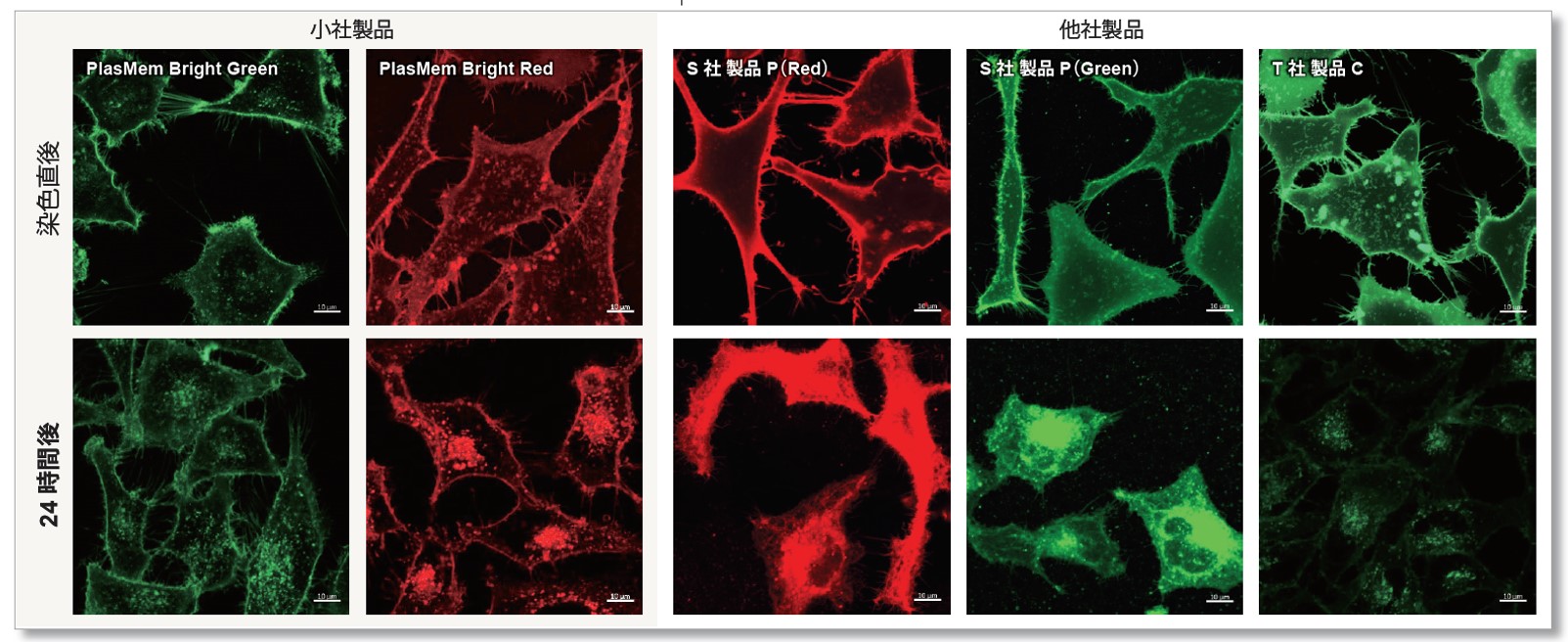
他社製品との比較
PlasMem Bright シリーズでは、既存の膜染色試薬の課題(細胞毒性、滞留性、実験系を選ばない使い勝手)を大幅に改善しました。
また色素のラインナップにより、多重染色時の色素選択が容易に行えるようになりました。
| 製品名 | 細胞毒性※1 | 滞留性※2 | 染色後の洗浄 | 血清入り培地の使用 | 染色後の固定化 |
|---|---|---|---|---|---|
| PlasMem Bright (Green, Red) | 低 | 24 時間 | 不要 | 可 | 可(PFA) |
| S社 製品P | ー | 0.5 時間 | 必要 | 不可 | 可 |
| T社 製品D | ー | 0.5 時間 | 必要 | 可 | 不可 |
| T社 製品C | 高 | 1.5 時間 | 必要 | 可 | 可(PFA) |
※1 各染色試薬で染色後、神経細胞の形態変化(軸索の凝集)を比較した場合。
※2 試薬滞留性は細胞種により異なる場合がございます。(上記はHeLa細胞およびSH-SY5Y細胞を用いた際の実績)
細胞膜への長期滞留性
各細胞膜染色試薬で染色したHeLa 細胞を24 時間培養したのち、それぞれの蛍光画像を比較しました。
結果、 PlasMem Bright シリーズは他社製品と比較して長時間、膜に滞留することが確認されました。
 (スケールバー:10 µm) |
実験例:ES細胞コロニー内部の細胞膜染色
マウスES細胞をゼラチンコートしたガラスボトムディッシュで4日間培養し、得られたコロニーをPlasMem Bright Green(200倍希釈)で15分間染色、培地交換後に共焦点顕微鏡(Zeiss: LSM710)にて観察しました。
結果、コロニー内部にある細胞の膜もPlasMemBright Greenで可視化できました。
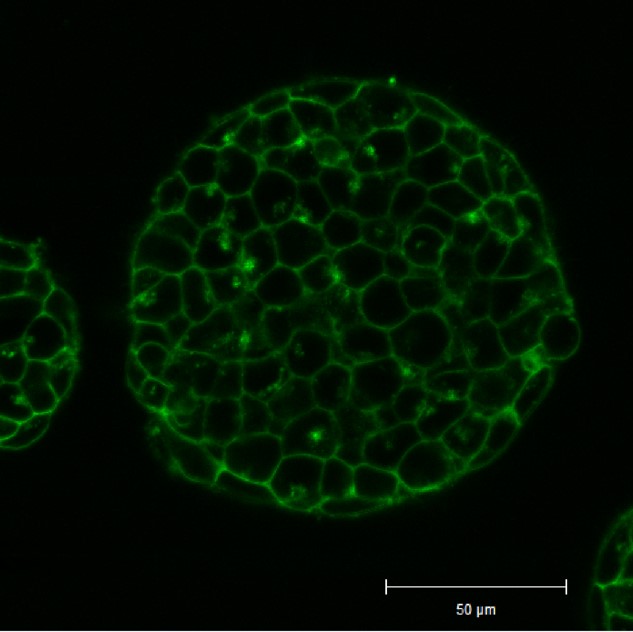
<観察条件>
細胞膜(PlasMem Bright Green、緑): Ex. 488 nm / Em. 500 - 560 nm
※本データは、慶應義塾大学 医学部 石津 大嗣先生よりご提供頂きました。
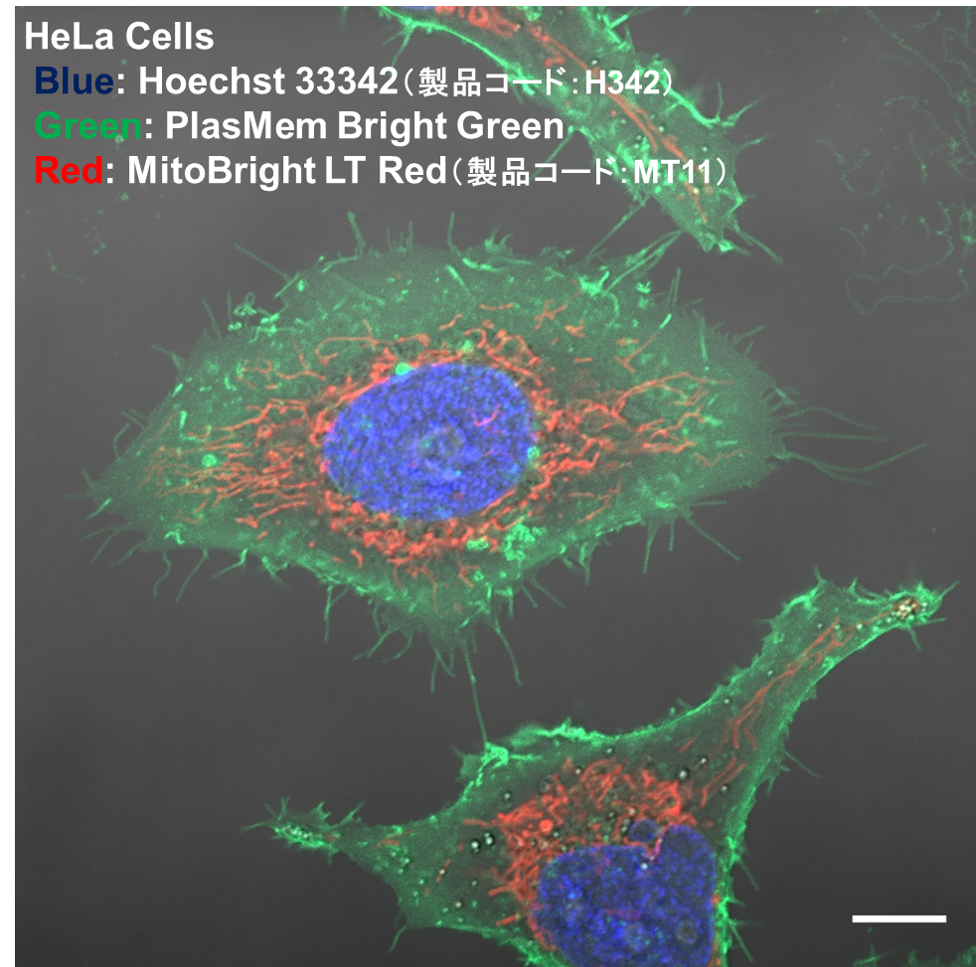
実験例:神経細胞の形態と軸索内のミトコンドリア局在観察
神経芽細胞であるSH-SY5Yより分化誘導した神経細胞をPlasMem Bright Green(緑)、MitoBright LT Red(赤)ならびにHoechst 33342(青)で染色したところ、神経細胞の形状と軸索内のミトコンドリアの局在が鮮明に観察されました。
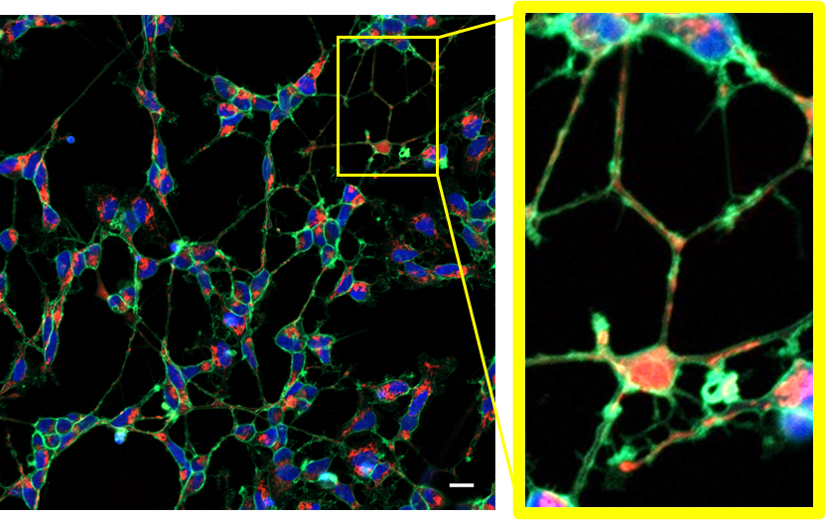
(スケールバー:20 µm)
<観察条件>
細胞膜(PlasMem Bright Green、緑): Ex. 488 nm / Em. 500 - 560 nm
ミトコンドリア(MitoBright LT Red、赤):Ex. 561 nm / Em. 560 - 620 nm
核(Hoechst 33342、青):Ex. 405 nm / Em. 400 - 450 nm
<実験操作>
(1) 神経芽細胞(SH-SY5Y)を神経細胞に分化誘導
(2) 上澄みを除去し、培地で調製したPlasMem Bright Green(200倍希釈)、Hoechst 33342(終濃度:5 µg/ml) および MitoBright LT Red(終濃度:0.1 µmol/l)を添加
(3) 30分間インキュベート
(4) 上澄みを除去し、HBSSを添加
(5) 蛍光顕微鏡で観察
実験例:神経芽細胞(SH-SY5Y)中のミトコンドリア検出
神経芽細胞であるSH-SY5YをPlasMem Bright Green(緑)、MitoBright LT Red(赤)ならびにHoechst 33342(青)で染色し、共焦点蛍光顕微鏡で3D画像を取得しました。
結果として鮮明な細胞の形態とミトコンドリアや核の局在が観察されました。
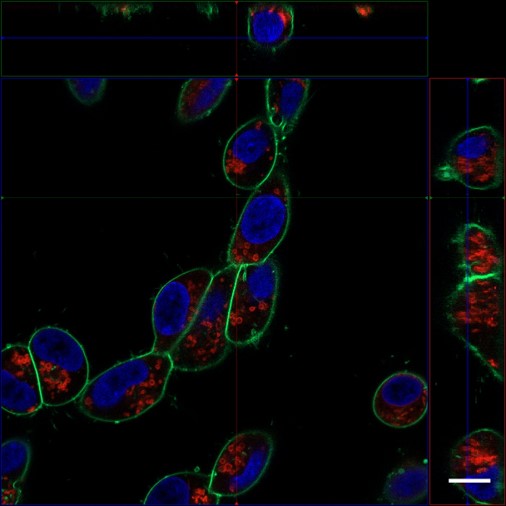 (スケールバー:10 µm)
(スケールバー:10 µm)
| <観察条件> | |
| 細胞膜(PlasMem Bright Green、緑) | :Ex. 488 nm / Em. 500 - 560 nm |
| ミトコンドリア(MitoBright LT Red、赤) | :Ex. 561 nm / Em. 560 - 620 nm |
| 核(Hoechst 33342、青) | :Ex. 405 nm / Em. 400 - 450 nm |
<実験操作>
(1) SH-SY5Y細胞をHBSSで洗浄
(2) 培地で調製した PlasMem Bright Green(200倍希釈)、Hoechst 33342(終濃度:5 µg/ml)および MitoBright LT Red(終濃度:0.1 µmol/l)を添加
(3) 10分間インキュベート
(4) 細胞をHBSSで2回洗浄
(5) 蛍光顕微鏡で観察
実験例:脳由来マウス神経芽細胞腫のタイムラプスイメージング
N1E-115細胞を培地で200倍希釈したPlasMem Bright Greenで30分間染色してタイムラプスイメージングを行ったところ、樹状突起や突起内の流動性が鮮明に観察されました。
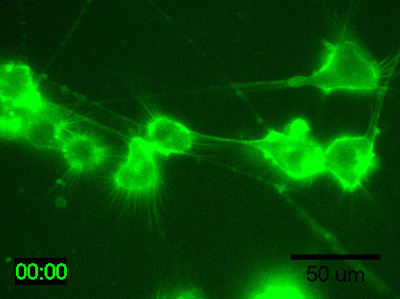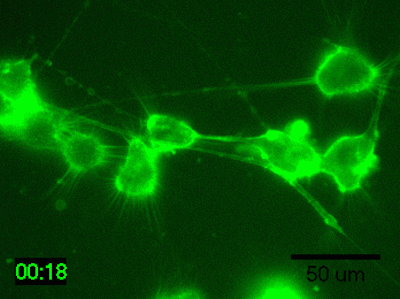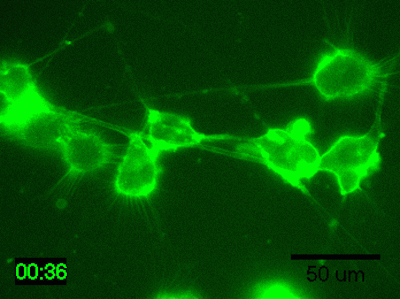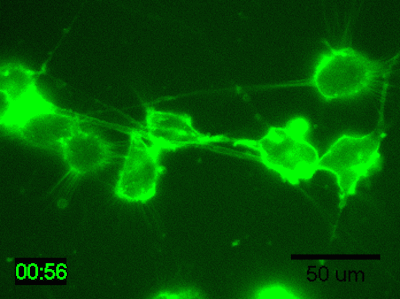
<培養条件>
・細胞:N1E-115細胞(脳由来マウス神経芽細胞腫)
・培地:5% FBS、1% グルタミン含有D-MEM(Low-glucose)
・培養器材:35 mm glass bottom dish
<撮影条件>
・撮影機器:インキュベーター付き蛍光顕微鏡
・撮影時間:1時間、撮影間隔:2分
※本実験例は芝浦工業大学システム理工学部の涌澤 充 様、福井 浩二 教授よりご提供いただきました。
実験例:植物細胞を用いた既存色素との共染色
タバコ培養細胞BY-2 をPlasMem Bright Green (100倍希釈)と既存色素FM 4-64 (10 μmol/l)で15分間染色した後、共焦点レーザー顕微鏡で細胞の観察を行いました。結果、PlasMem Bright GreenとFM4-64色素は共に、BY-2細胞の細胞膜を鮮明に染色することがわかりました。
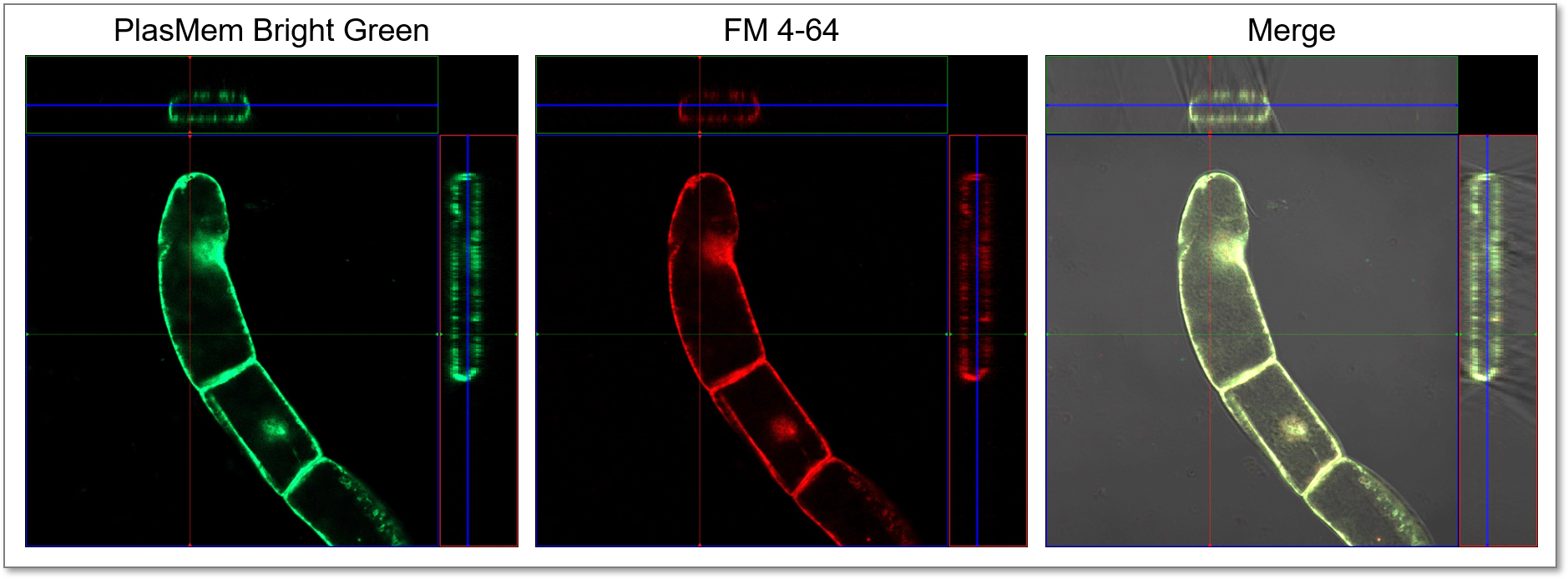
<観察条件>
PlasMem Bright Green (緑):Ex. 488 nm/Em. 500 - 560 nm
FM4-64 (赤):Ex. 561 nm/Em. 630 - 700 nm
<実験操作>
(1) BY2細胞懸濁液 50 µl に、培地で希釈したPlasMem Bright Green (50倍希釈)とFM 4-64 (20 μmol/l)を50 µlを添加
(2) 室温で15 分間インキュベート
(3) 共焦点レーザー顕微鏡で観察
※こちらのBY-2 細胞は理研 BRC から入手しました。
実験例:タバコ培養細胞BY-2 染色
タバコ培養細胞BY-2 をPlasMem Bright Green (200倍希釈)で5分間染色して洗浄後、5分毎にタイムラプス観察を行いました。BY-2細胞の細胞膜が蛍光観察されたことに加えて、細胞分裂時の細胞板形成が観察されました。
(名古屋大学 トランスフォーマティブ生命分子研究所 栗原大輔 先生よりご提供)
<測定条件>
・スピニングディスク共焦点観察
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)
・図中の時間は00時00分で表記
実験例:シロイヌナズナ根の染色
シロイズナズナ根をPlasMem Bright Green (200倍希釈)で15分間染色後、zスタック撮影により蛍光観察を行いました。取得した3次元蛍光画像から各細胞膜を蛍光検出されたことが確認されました。
(名古屋大学 トランスフォーマティブ生命分子研究所 栗原大輔 先生よりご提供)
<測定条件>
・スピニングディスク共焦点観察, zスタック撮影
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)
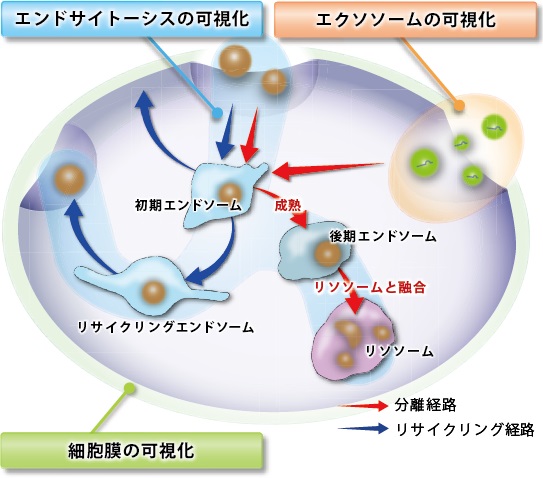
実験例:エクソソームとの共染色
PlasMem Bright Greenで細胞膜を染色したHeLa細胞にエクソソーム 膜蛍光染色キット(ExoSparkler Exosome Membrane labeling Kit-Red)で染色したエクソソームを添加し、細胞へのエクソソームの取り込みを観察しました。
その結果、生細胞の細胞膜由来小胞(エンドソーム)内に存在するエクソソームを可視化でき、さらにエクソソームが取り込まれていないエンドソームを見分けることができました。
また、染色後の細胞を固定化しても生細胞と同様に細胞膜由来小胞(エンドソーム)内に存在するエクソソームを可視化できました。
HeLa細胞(生細胞)
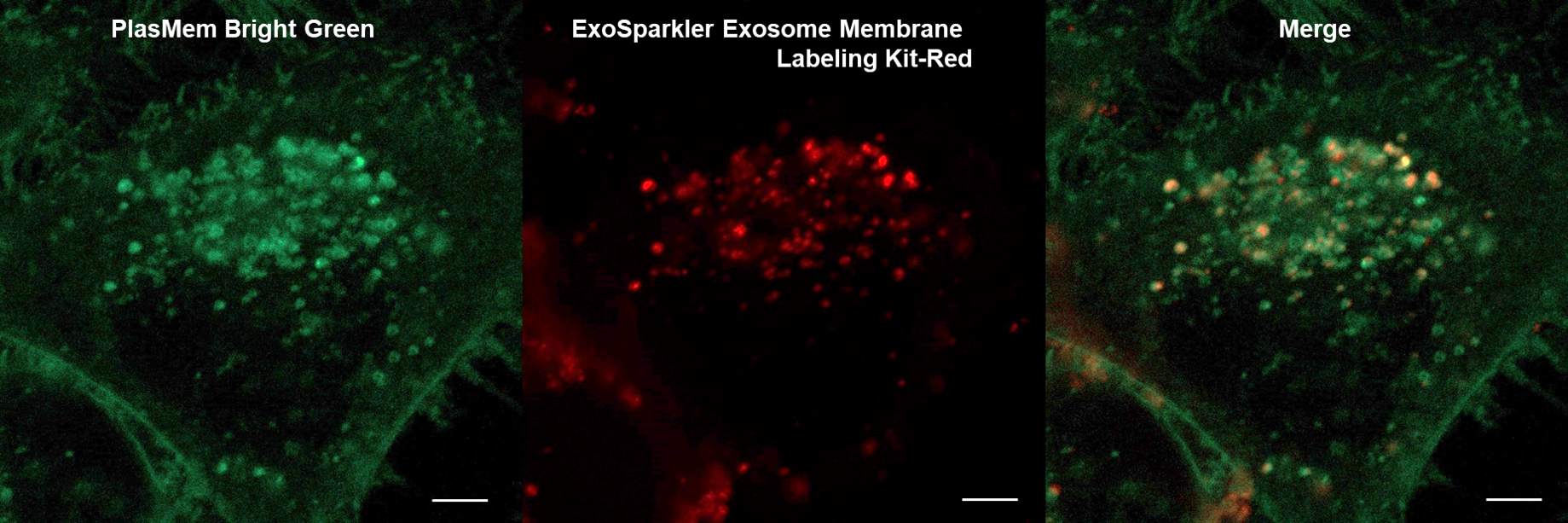
(スケールバー:5 µm)
HeLa細胞(PFA固定化細胞)
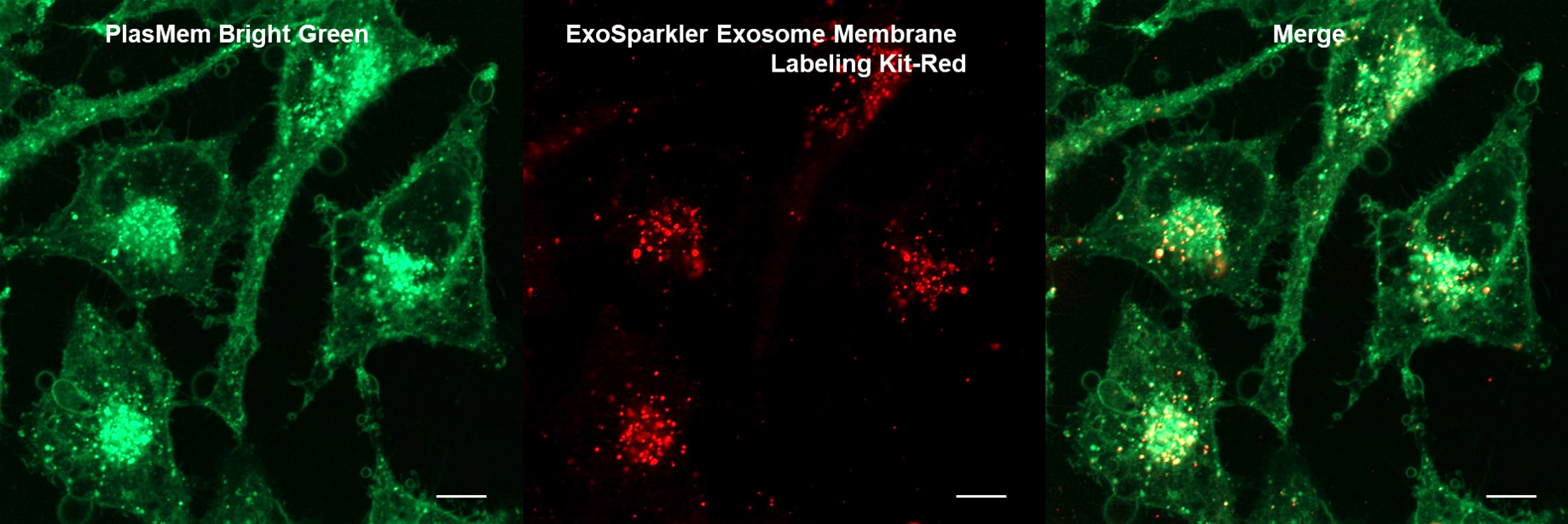
(スケールバー:10 µm)
<観察条件>
細胞膜(PlasMem Bright Green、緑): Ex. 488 nm / Em. 500 - 560 nm
エクソソーム(ExoSparkler Exosome Membrane Labeling Kit-Red、赤):Ex. 561 nm / Em. 560 - 620 nm
<実験操作>
(1) HeLa細胞を播種し、24時間インキュベート
(2) 上澄みを除去し、培地で調製したPlasMem Bright Green(100倍希釈)を添加
(3) 10分間インキュベート
(4) HBSSで細胞を3回洗浄
(5) MEM培地 175 μl と ExoSparkler Exosome Membrane Labeling Kit-Red で染色済みの Exosome溶液 25 ulを添加
(6) CO2インキュベーターで1晩インキュベート
(固定化の場合) 細胞をHBSSで2回洗浄して 4% PFAを添加、15 分間インキュベート後に細胞をHBSSで2回洗浄
(7) 共焦点レーザー顕微鏡で観察
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 CML Cell (慢性骨髄性白血病) |
蛍光顕微鏡 | T. Hoshiko, Y. Kubota, R. Onodera, T. Higashi, M. Ykoo, K. Motoyama and S. Kimura, "Folic Acid-Appended Hydroxypropyl- -Cyclodextrin Exhibits Potent Antitumor Activity in Chronic Myeloid Leukemia Cells via Autophagic Cell Death", Cancers, 2021, doi:10.3390/cancers13215413. |
| 2) | 細胞 HCT116 Cell (ヒト結腸腺癌) |
蛍光顕微鏡 | Z. Liu, Y. Li, Y. Zhu, N. Li, W. Li, C. Shang, G. Song, S. Li, J. Cong, T. Li, Z. Xiu, J. Lu, C. Ge, X. Yang, Y. Li, L. Sun, X. Li and N. Jin, "Apoptin induces pyroptosis of colorectal cancer cells via the GSDME-dependent pathway", Int. J. Biol. Sci., 2022, doi:10.7150/ijbs.64350. |
| 3) |
細胞 |
蛍光顕微鏡 | L.Haisha, M. Xinyu, Z. Yuanyuan, L. Yuheng, L. Nan, Z. Weiying, C. Jianhui, L. Boqi, D. Wanqing, L. Xiaohui, Y. Li, "The formation of migrasomes is initiated by the assembly of sphingomyelin synthase 2 foci at the leading edge of migrating cells", Nature cell biology, 2023, doi: 10.1038/s41556-023-01188-8. |
よくある質問
-
Q
細胞の固定化はできますか?
-
A
4% PFAでの固定化が可能です。
ただし、蛍光が消失する原因となりますので膜透過処理を行わないでください。
-
Q
タイムラプスイメージングは可能ですか?
-
A
可能です。
注意点として、励起光を最低限に抑え、検出感度を上げてください。細胞への断続的な励起光の照射は、細胞へのダメージと色素の分解を引き起こす可能性がございますので、インターバルの時間などもご検討ください。
-
Q
Working solutionを調製する際、血清無しの培地やバッファーで希釈することは可能ですか?
-
A
血清無しの培地やバッファーでの希釈も可能です。
-
Q
染色後の細胞の洗浄にはどのようなものが使用できますか?
-
A
無血清培地もしくはPBS, HBSSの様なバッファーがご利用いただけます。
-
Q
Working solution添加後、すぐに観察が可能ですか?
-
A
添加直後から観察は可能です。なお、小社プロトコルでは試薬を添加して5分間インキュベートした後に観察することを推奨しています。
-
Q
細胞膜以外にも染まっている箇所があります。どのような理由が考えられますか?
-
A
細胞膜以外が染まっているように見える理由として以下の2点が考えられます。
① 細胞膜に滞留している試薬の一部は、時間経過とともにエンドサイトーシスによって細胞内に取り込まれます。
本製品ページ内「技術情報:細胞膜への長期滞留性」にあります、小社製品の染色後24時間後の図をご参照ください。② 撮像時の焦点が底面(細胞底部の接着面)にあっていると下図Aのように観察される場合があります。
撮像時のZ軸の高さを下図Bのように調製してください。
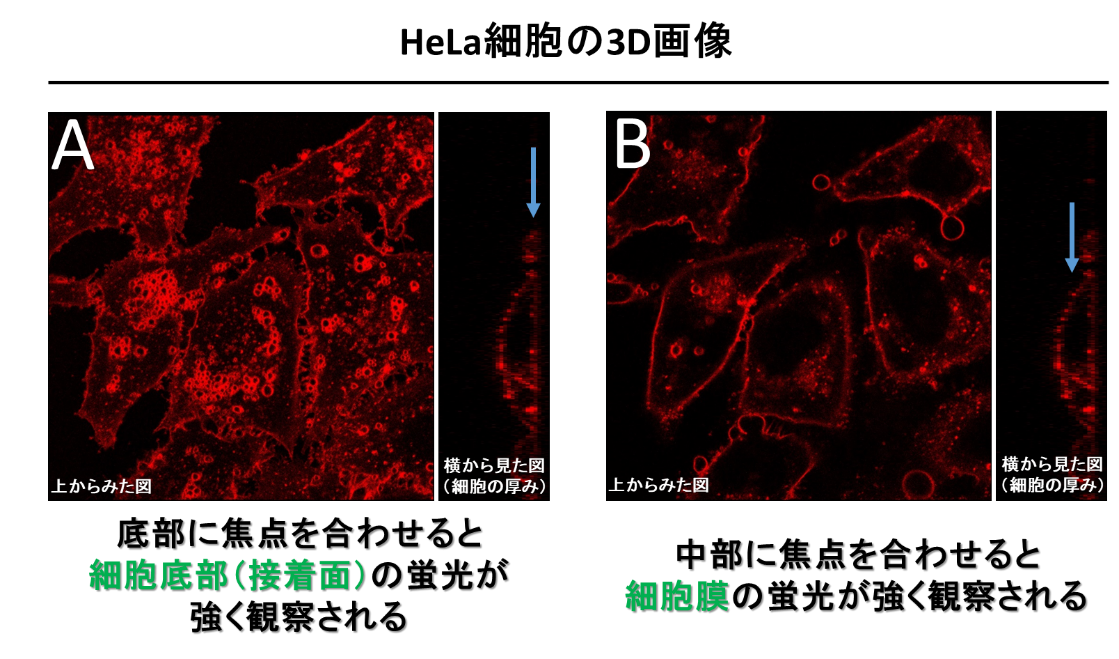
.png)
-
Q
PlasMem Bright Greenで染色した細胞とPlasMem Bright Redで染色した細胞を共培養し、細胞を染め分けることはできますか?
-
A
細胞同士が接触すると色素がもう一方の細胞へ移動するため、染め分けることはできません。
-
Q
共染色時の注意点を教えてください。
-
A
本試薬はストークシフトが長い蛍光特性を持ちます。そのため、ご使用の前に本試薬と共染色試薬の蛍光波長を必ずご確認の上、適切な励起・検出波長に設定してください。