|
高濃度の炎症性サイトカインは神経毒性を誘発し、炎症に起因する神経変性を触媒するが、ミクログリアからの放出機構は未だ解明されていない。本論文では、分泌型オートファジー(Secretory Autophagy: SA)が、SKA2とFKBP5のシグナル伝達を介して、神経炎症が介在する神経変性を制御していることを明らかにした。また、SKA2をノックダウンすると、SAが亢進し、神経炎症が起こり、その後神経変性が起こり、海馬が完全に萎縮することが確認された。SAの亢進はIL-1βの放出を増加させ、NLRP3-インフラマソームの活性化とガスダーミンDを介した神経毒性を含む炎症性フィードフォワード悪循環の一因となり、最終的に神経変性を引き起こすことが示された。さらに、死後ヒト脳のタンパク質解析から、アルツハイマー病ではSAが亢進していることが明らかにされた。これらの結果は、SKA2が制御するSAの亢進が神経炎症を促進し、アルツハイマー病と関連していることを示唆している。 |
||||
|
SKA2 regulated hyperactive secretory autophagy drives neuroinflammation-induced neurodegeneration |
||||
|
注目ポイント ・SKA2はFKBP5の機能を阻害することでSA依存性のIL-1β放出を抑制する ・雄のマウスで海馬のSKA2をノックダウンすると、SAが亢進し、神経炎症とそれに続く神経変性が引き起こされる ・SAが亢進するとIL-1βの放出が増加し、NLRP3インフラマソームの活性化やガスダーミンDを介した神経毒性など、炎症によるフィードフォワード悪循環に寄与する ・死後のヒト脳のタンパク質解析から、アルツハイマー病ではSAが亢進していることが示された |
||||
| 関連製品 | ||||
|
||||
|
||||
|
||||
|
||||
|
||||
| アプリケーションデータ | ||||
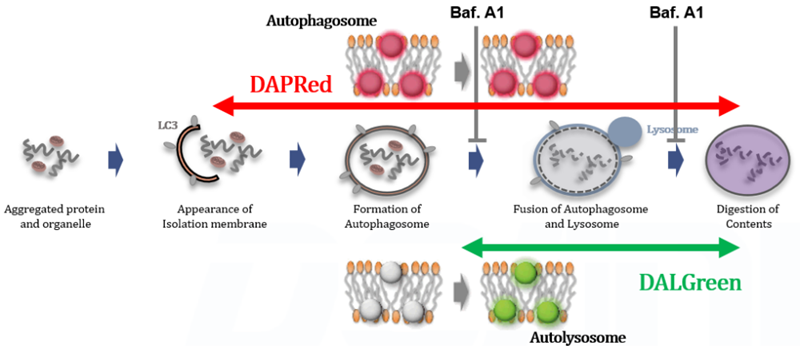
試薬の添加だけでオートファジー経路(flux)を解析できる |
||||
|
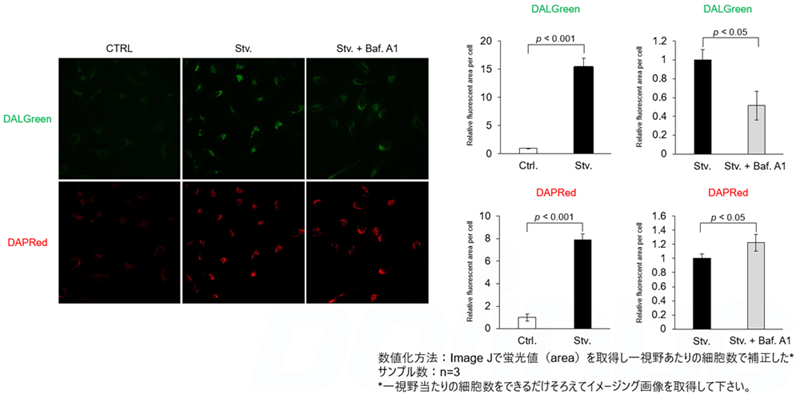
検出原理 DALGreenおよびDAPRedで染色したHeLa細胞を用いて、リソソーム酸性化阻害剤バフィロマイシンA1(Baf.A1)により誘導されるオートファジーによる一連の流れの変化を評価した。飢餓状態と比較して、Baf.A1の添加によるオートリソソーム形成阻害条件下では、DALGreenの蛍光シグナルは減少した。一方、DAPRedの蛍光シグナルは同条件下で増加したことから、Baf. A1はオートファゴソームの蓄積を誘導した。
実験データ
実験条件
操作 |
||||