|
細胞が不要になった構成要素を分解・再利用する仕組みとして知られるオートファジー。なかでも、特定の対象を識別して選別的に分解する「選択的オートファジー」は、細胞内恒常性の維持に不可欠な役割を果たしている。近年、この選択的オートファジーの開始に重要な役割を果たす「相分離」のメカニズムに注目が集まっている。本論文では、酵母を用いて、オートファジー受容体と標的カーゴの間の低親和性・多価な相互作用が、カーゴ表面に「イニシエーションハブ」と呼ばれる相分離構造を形成することを明らかにした。これが、オートファジー開始部位(PAS)の形成へとつながる鍵であることが示唆された。さらに、カーゴと受容体の高親和性な結合は逆に進行を妨げること、さらには人為的に相分離を誘導することで「分解されなかったタンパク質」を分解可能にする技術応用の可能性も示された。ヒト細胞でも同様の相分離現象が観察され、進化的に保存された基本原理であることも確認されている。これらの結果は選択的オートファジーの工学的制御や、新たな創薬標的開発の糸口として、基礎・応用の両面で大きな意義を持つといえる。 |
|||
| Phase separation of initiation hubs on cargo is a trigger switch for selective autophagy
論文へのアクセスはこちら: Licheva, M., et al, Nat Cell Biol, (2025) |
|||
|
注目ポイント ・選択的オートファジーの開始はカーゴ表面での相分離が鍵となる ・オートファジー受容体との高親和性結合は、選択的オートファジーの進行を阻害する ・非分解性だったウイルスタンパク質をネオカーゴ化し、選択的オートファジーでの分解を可能にした |
|||
| 関連製品 | |||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
| アプリケーションデータ | |||
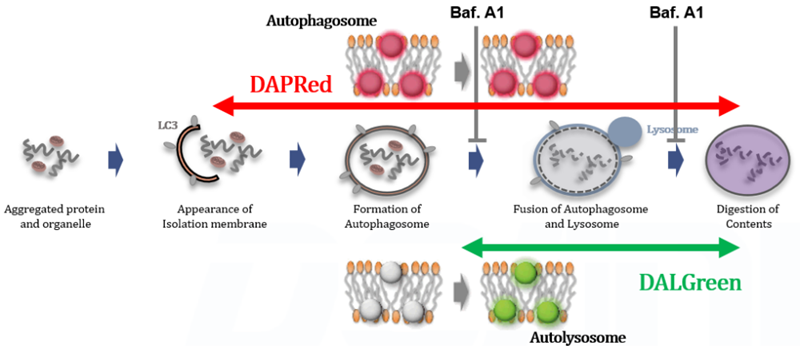
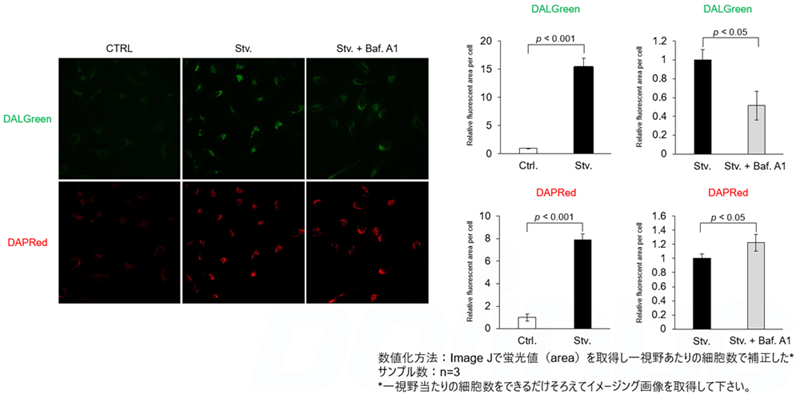
Bafilomycin A1 によるオートリソソームの形成阻害の解析
DALGreenおよびDAPRedで染色したHeLa細胞を用いて、リソソーム酸性化阻害剤バフィロマイシンA1(Baf.A1)により誘導されるオートファジーによる一連の流れの変化を評価した。飢餓状態と比較して、Baf.A1の添加によるオートリソソーム形成阻害条件下では、DALGreenの蛍光シグナルは減少した。一方、DAPRedの蛍光シグナルは同条件下で増加したことから、Baf. A1はオートファゴソームの蓄積を誘導した。
実験データ
<実験条件>
|
|||
|
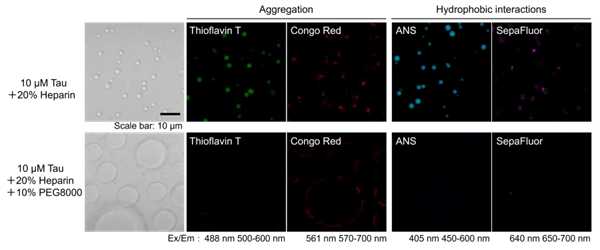
Tauタンパク質液滴の性質に与えるクラウディング剤の影響 LLPS Characterization-dye Setを用いてTauタンパク質液滴の性質の検討を行った。Tauタンパク質に足場となるヘパリンを添加すると、Tauタンパク質液滴が観察され、アミロイド染色色素であるThioflavin T及びCongo Red両色素で陽性を示した。
<実験条件> |
|||