これからはじめる細胞内カルシウム検出
細胞内カルシウムを測定する意義
細胞内カルシウムイオン(Ca²⁺)は、細胞のシグナル伝達、エネルギー代謝、細胞死に関与する重要なセカンドメッセンジャーです。異常なCa²⁺動態は、がん細胞の増殖や転移、神経疾患における神経細胞の障害、老化に伴う細胞機能の低下に関与しており、これらの疾患の理解と治療法の開発において細胞内Ca²⁺の測定は非常に重要です。リアルタイムでのカルシウム動態の解析により、病的変化の早期検出や新規治療戦略の構築が期待されます。
1) M. Swami, The calcium connection. Nature Reviews Cancer, 2010, 10, 739.
2) L. Kaiani., Calcium dysregulation could underlie lysosomal impairment in Alzheimer's disease, Nature Reviews Neurology, 2023, 19, 65.
3) Y. B. Xiong, et al.,, "Mitochondrial calcium uniporter promotes kidney aging in mice through inducing mitochondrial calcium-mediated renal tubular cell senescence", Acta Pharmacologica Sinica, 2024, 45, 2149-2162.
カルシウムと関連疾患の最新の報告例
| 細胞老化とカルシウム |
|---|
|
【要約】老化細胞の除去や機能制御は、加齢関連疾患の予防・治療や健康寿命の延伸に寄与するとして大きな関心を集めています。特にミトコンドリアのカルシウム濃度は細胞老化や細胞死、その両者のバランスの重要な調節因子とされており、老化細胞を制御する新たな戦略の標的物質として期待されています。
C. Margand, P. Morgado-Cáceres, U. Ahumada-Castro, J. César Cárdenas, N. Martin and D. Bernard, Emerging role of mitochondrial calcium levels in cellular senescence and in switching cell fates, Nature Aging, 2025, DOI: https://doi.org/10.1038/s43587-025-00887-1 |
| アポトーシスとカルシウム |
|---|
|
リン脂質結合タンパク質であるアネキシンA5(AnxA5)は、細胞内Ca²⁺恒常性の中心的な制御因子です。本研究では、AnxA5がミトコンドリアCa²⁺フラックスの調節因子として機能し、生理的およびアポトーシス促進条件下でミトコンドリア外膜(OMM)のVDAC1チャネルの透過性を制御する役割について報告しています。 |
| 神経疾患とカルシウム |
|---|
|
アルツハイマー病では、リアノジン受容体(RyR)を介したCa²⁺恒常性の異常が、リソソームの酸性化やタンパク質分解、オートファジーによる除去を妨げます。これにより神経細胞の生存に不可欠なプロセスが損なわれますが、Ca²⁺の恒常性を回復することで改善できます。本研究は、早期ADにおけるCa²⁺制御異常と病的タンパク質蓄積の関連性を示し、治療標的の可能性を示唆しています。
|
細胞内カルシウム測定の課題
細胞内Ca2+の測定は、カルシウムプローブを用いた方法が広く使用されていますが、初めて測定する際に以下のような問題から「蛍光強度の変化が得られない」というご相談をいただくことがあります。
・プローブが細胞に取り込まれていない
・細胞の厚みやプローブ濃度などにより結果がばらつく
・アッセイ中に細胞に毒性が出る、細胞が剥がれる
・装置の設定
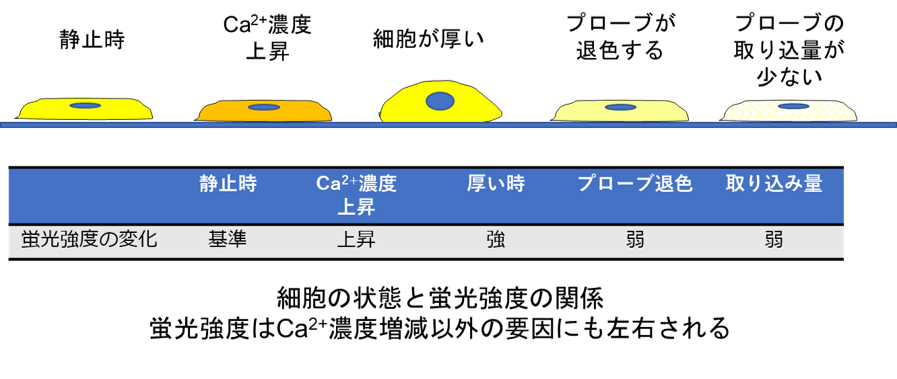

細胞内Ca2+測定を上手く行うには、実験系に応じて適切なプローブを選択し細胞機能への影響を考慮しながらアッセイを行う必要があります。また、実験の成功へ向けて事前によくあるトラブルと対処法を把握しておくことでよりスムーズに実験を進められます。
目的別に選べる同仁化学のキット
小社キットにはカルシウムプローブの溶解補助剤である界面活性剤2種類とカルシウムプローブの細胞からの漏れ出しを防止する陰イオントランスポーター阻害剤1種類が入っており、細胞種や添加する薬剤に応じてそれぞれ試薬の濃度を任意で設定することができます。測定用のBufferも添付しているため別途試薬を準備する必要はありません。また測定系に影響を受けにくいWashタイプと洗浄が不要のNon-Washタイプが選べるため、剥がれやすい細胞や神経細胞等の洗浄操作の影響を受けやすい細胞でも安心してお使いいただけます。
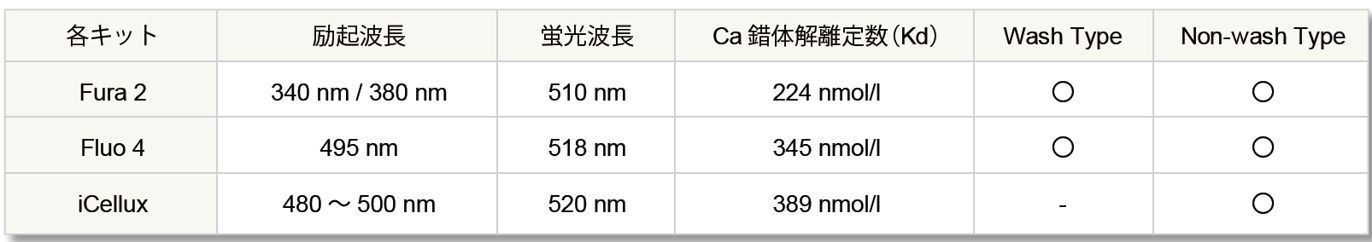
カルシウムプローブの特性

キットの選択
① はじめてのカルシウム測定におすすめ: Fluo 4 |
|---|
|
・実績が豊富で蛍光強度の変化率で議論できるため理解しやすい
|
② ばらつきが少ないデータ測定、カルシウム濃度の定量:Fura 2 |
|---|
|
・レシオメトリー測定で、プローブの濃度、細胞の厚さ、自家蛍光等の影響を抑えて測定できる
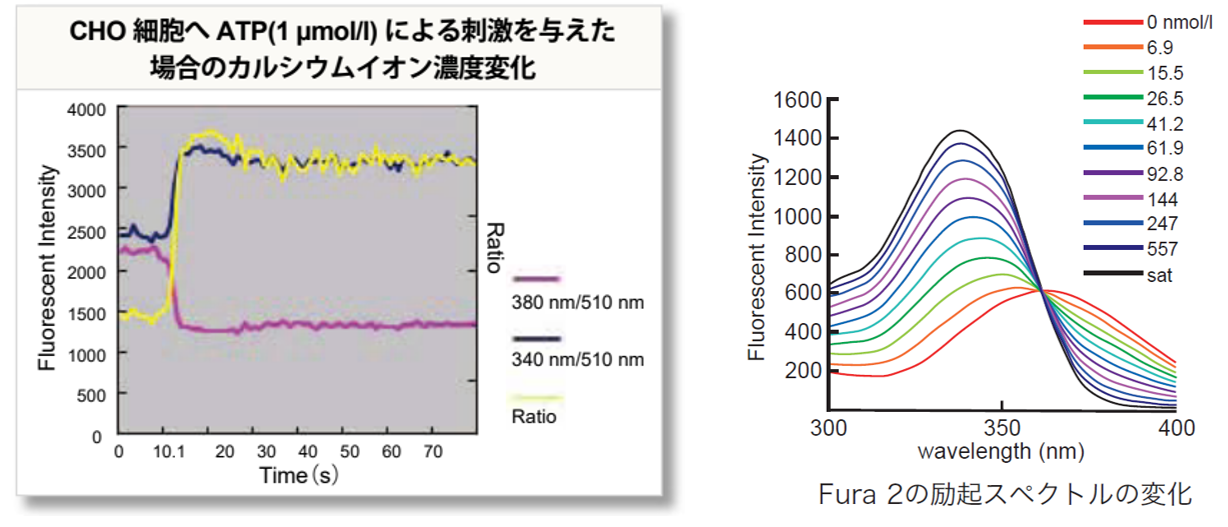
レシオメトリー測定のメリット Fura 2は、Ca2+濃度が高くなると340 nm 励起の蛍光強度が上昇し、380 nm 励起の蛍光強度が低下します。このときの蛍光強度比(R=Fex340 nm/Fex380 nm) をとることで、プローブの濃度、細胞の厚さ、自家蛍光等の影響を抑えてCa2+濃度を議論することができます。よりばらつきの少ないデータを取得できることから、細胞内Ca2+濃度を算出する場合にも有用です。 |
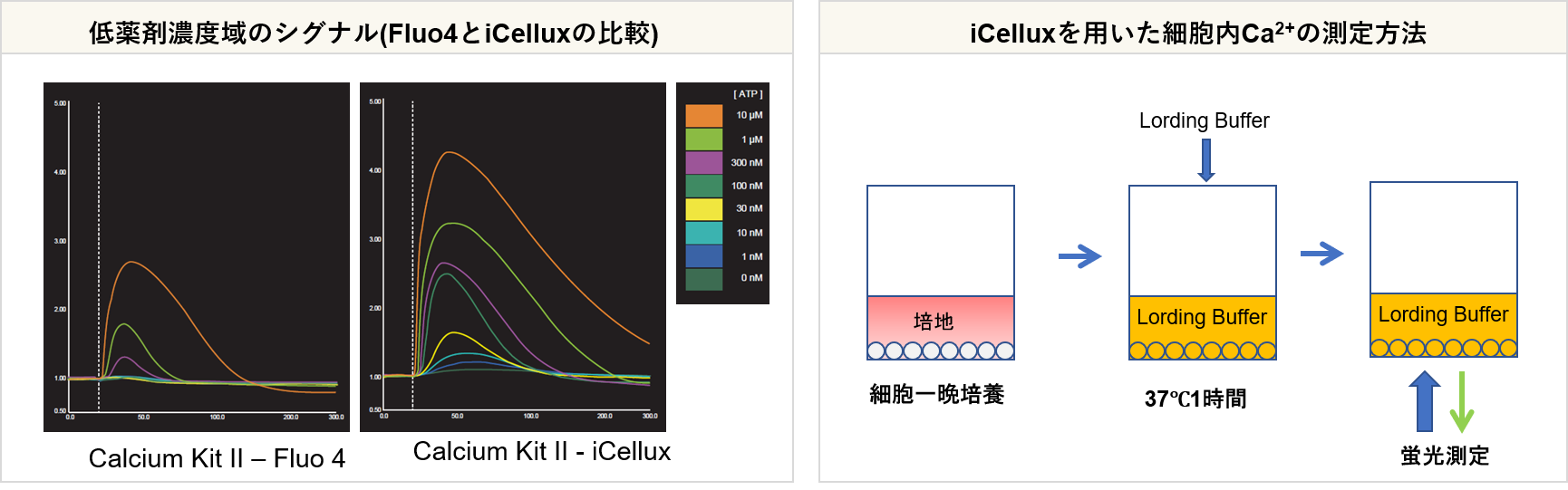
③ 低薬剤濃度域を高感度にスクリーニング:iCellux |
|---|
|
・Fluo4よりも薬剤低濃度域のシグナル応答が向上
|
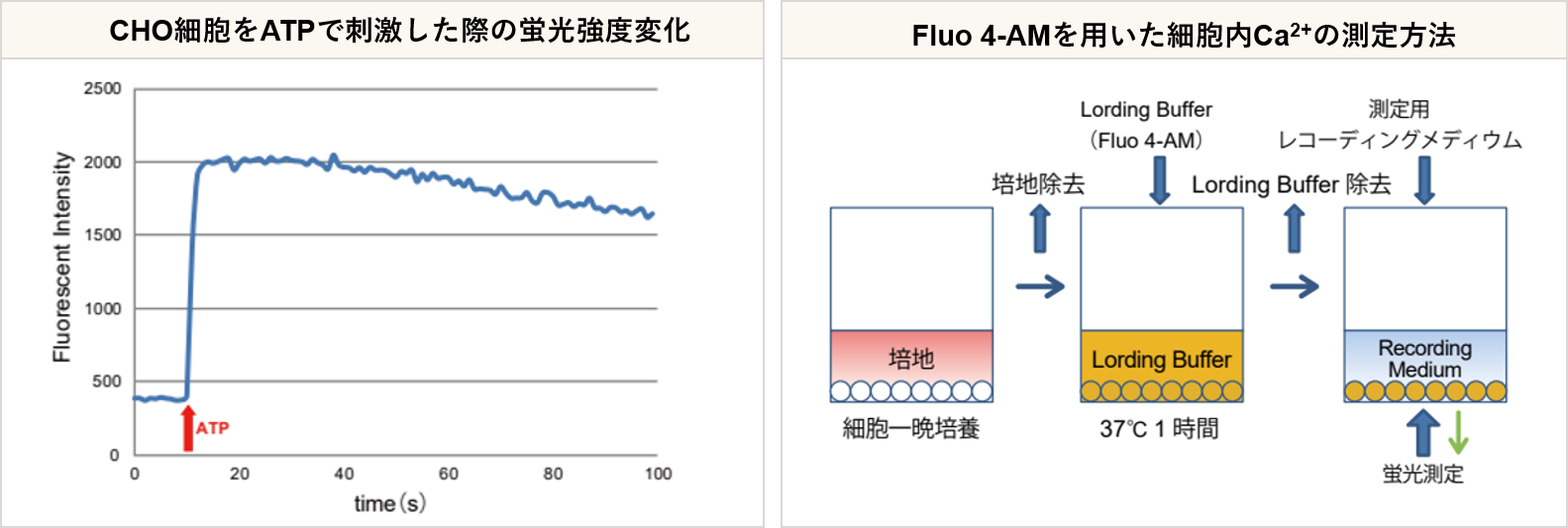
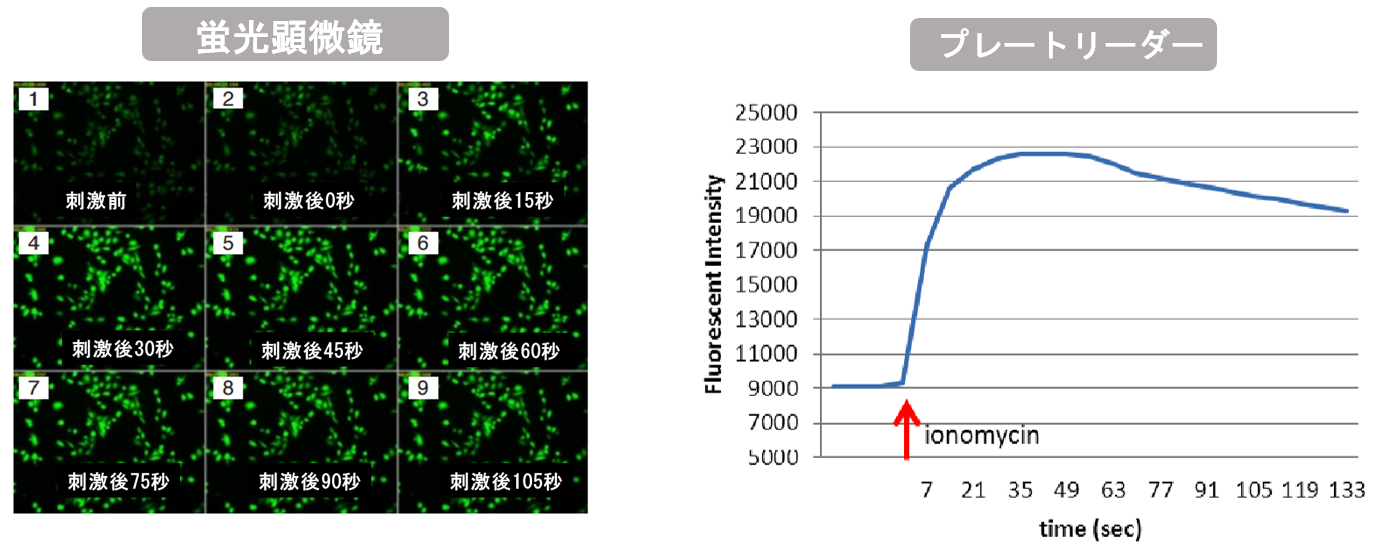
実験例 (Fluo 4):ionomycine刺激したCHO細胞のCa2+濃度による蛍光強度変化測定
CHO細胞をionomycineにて刺激しCa2+濃度変化を蛍光顕微鏡、プレートリーダーで測定しました。蛍光顕微鏡での観察、プレートリーダーへの測定において、刺激後に蛍光強度が上昇し細胞内のCa2+濃度が上昇していることを確認しました。


<対象製品>
Calcium Kit - Fluo 4 [CS22]、Calcium Kit Ⅱ- Fluo 4 [CS32]
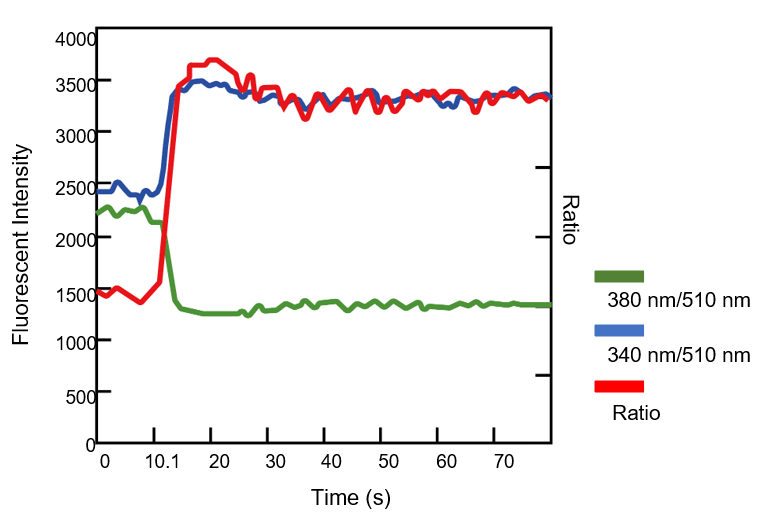
実験例 (Fura2):ATP刺激したCHO細胞のレシオメトリー測定によるCa2+濃度変化測定
CHO細胞を用い ATP(終濃度1 μmol/l)刺激によるCa2+濃度変化を測定しました。ATPを添加すると、2波長(380 nm, 340nm)の蛍光強度比が上昇し細胞内のCa2+濃度が上昇していることを確認しました。
<対象製品>
Calcium Kit – Fura 2 [CS23]、Calcium Kit Ⅱ- Fura 2 [CS33]
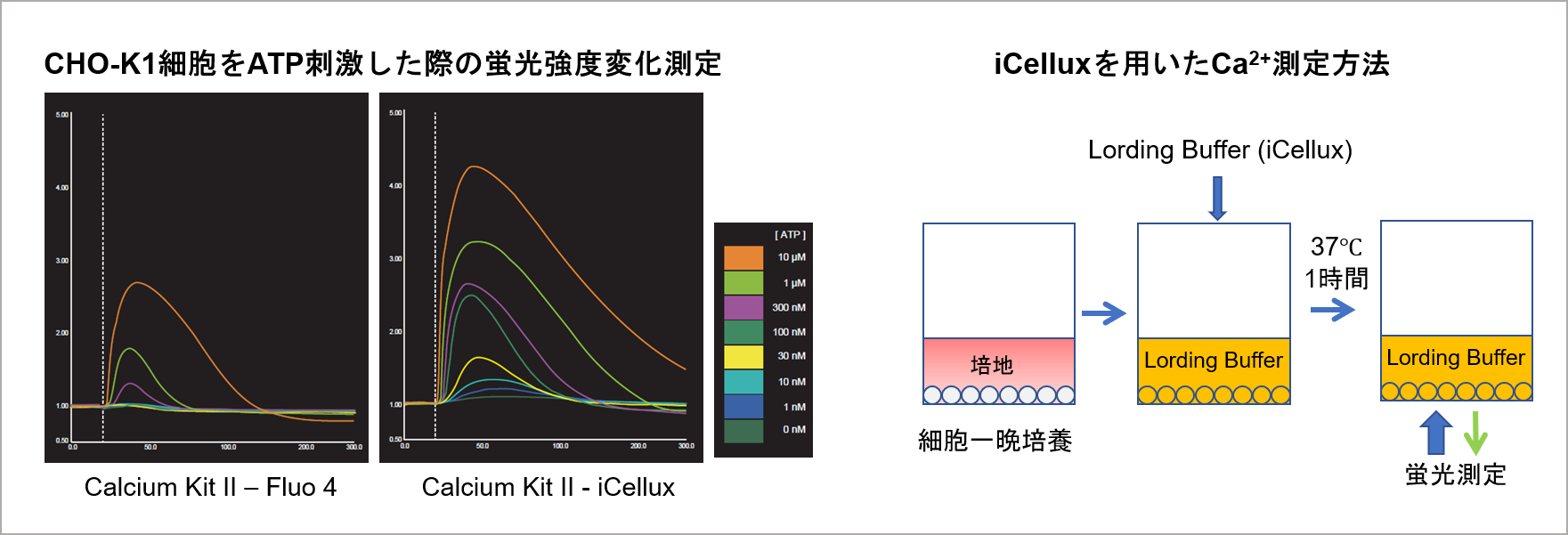
実験例 (iCellux):CHO-K1細胞をATP刺激した際の蛍光強度変化測定
CHO-K1細胞を用い、ATP(1nmol/l~10 μmol/l)刺激による細胞内Ca2+濃度の変化を小社Calcium Kit Ⅱ-iCellux及びA社製品を用いて測定しました。その結果、小社キットでは低薬剤濃度域のCa2+濃度の変化を測定することができました。
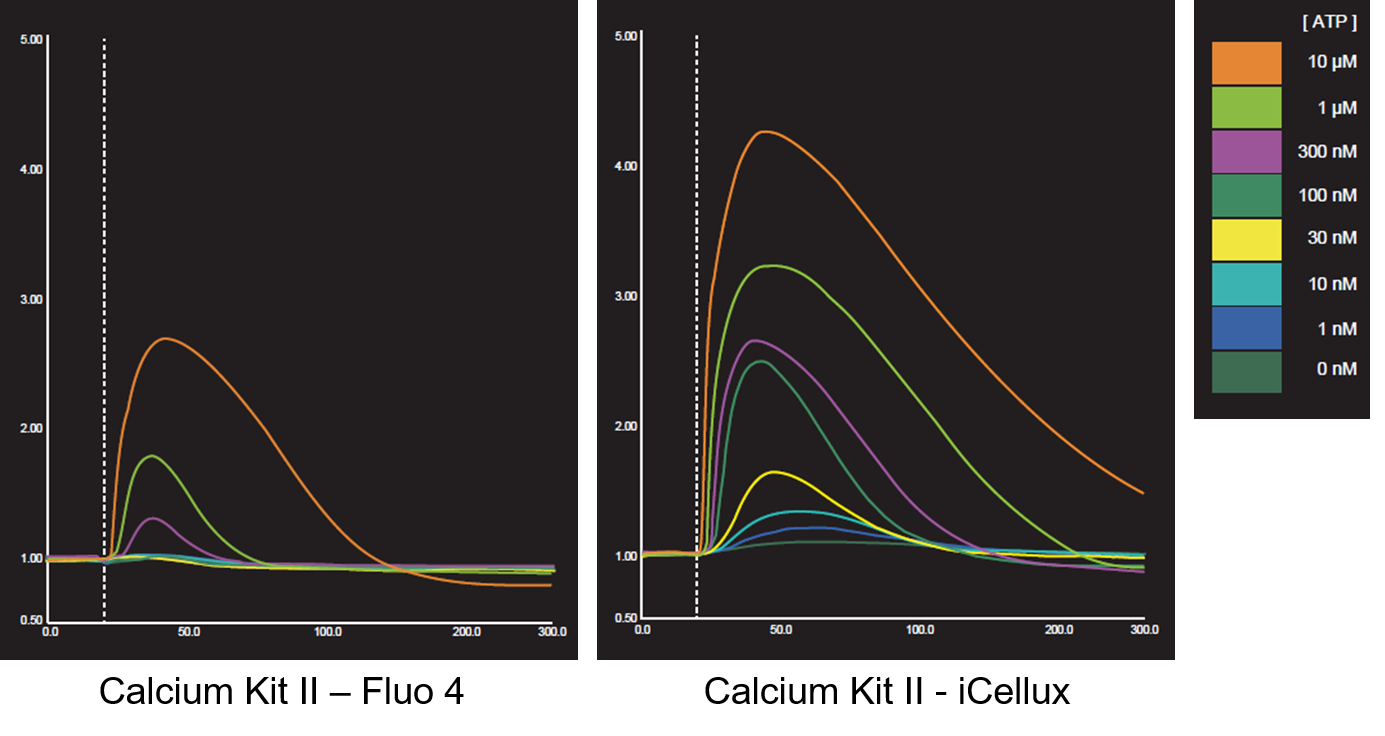
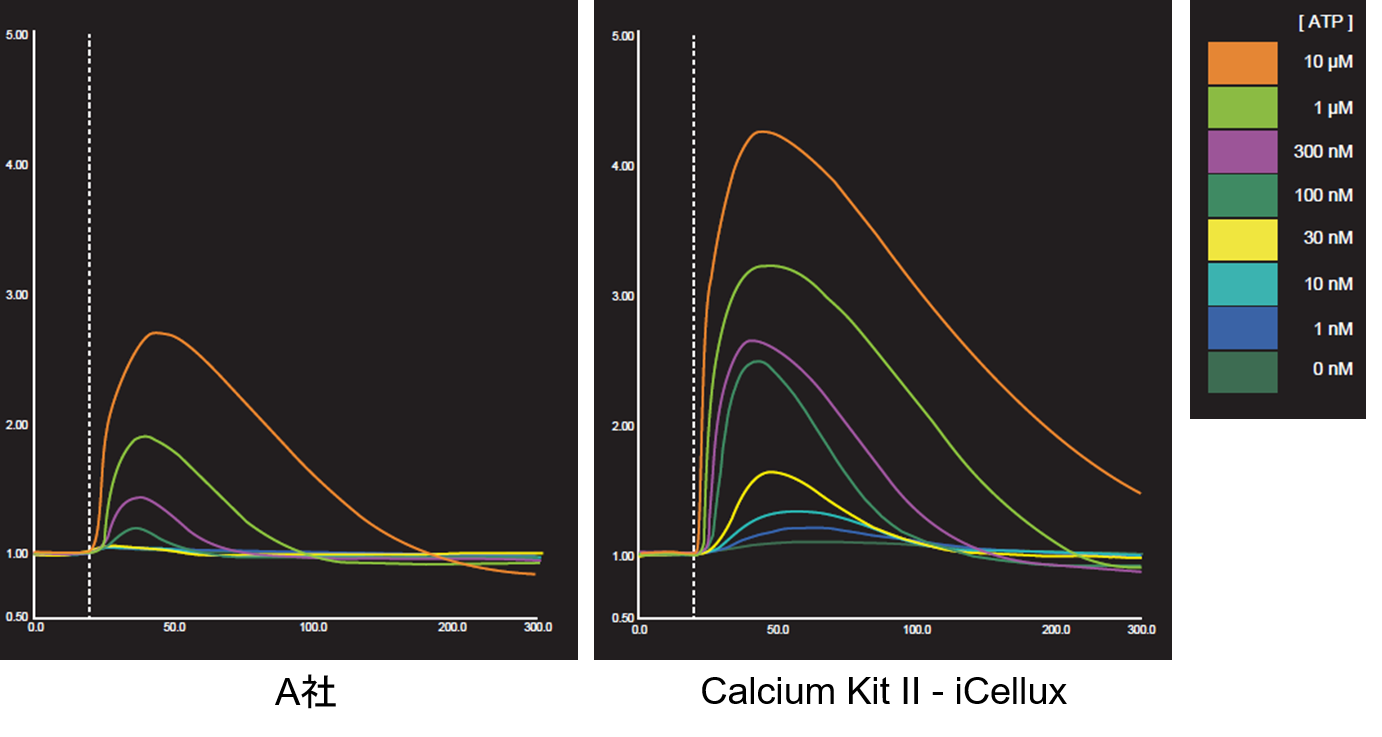
<対象製品>
Calcium Kit Ⅱ-iCellux [CS34]
<実験条件>
細胞:CHO-K1
プレート:NUNC384 wells plate (Non-coating)
刺激薬剤:ATP (final 1 nmol/l-10 μmol/l
Probenecid: 1.25 mmol/l, Calcium Probe インキュベート時間: 1hr
(データ提供:浜松ホトニクス株式会社)