抗体を用いた代表的な免疫実験法としてELISAと免疫染色について原理や特徴をまとめています。
またお役立ち情報には、抗体標識プロトコルや実験に応じて標識キットを選択できるページのリンクをご用意しています。
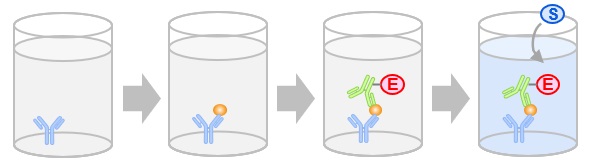
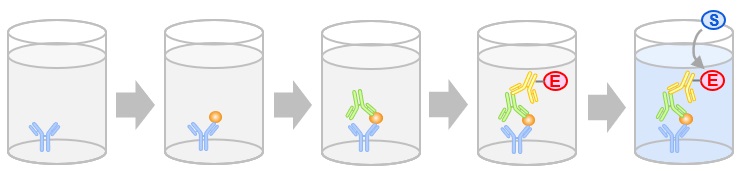
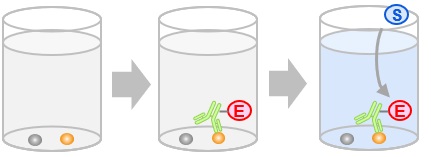
- ELISA (enzyme-linked immunosorbent assay)
原理
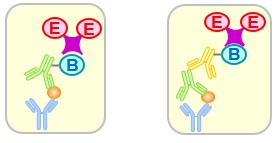
各種ELISAの比較
抗体への直接標識
標識酵素の特徴比較
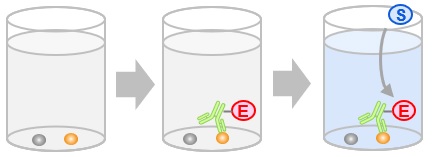
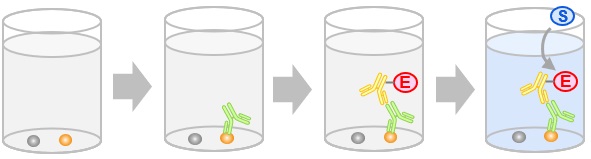
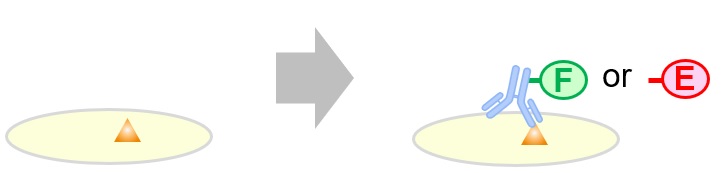
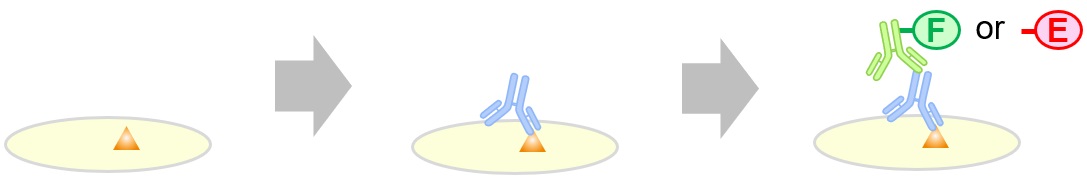
- 免疫染色(immunostaining)
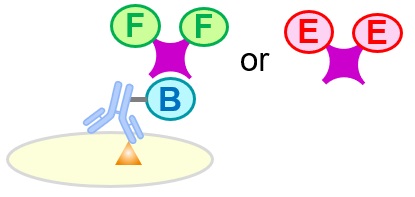
各種免疫染色で用いられる検出法
酵素検出時の基質
カウンター蛍光染色で用いられる試薬
- お役立ち
はじめての抗体標識プロトコル
プロトコル PDFダウンロード