|
免疫原性細胞の細胞死は抗癌治療の成功に大きく貢献しているが、鉄の蓄積と脂質過酸化を特徴とする細胞死の一形態であるフェロトーシスは、この観点からはまだ十分に評価されていない。本研究では、フェロトーシス誘導モデルから脂質過酸化を伴う「初期段階」、ATP放出を伴う「中間段階」、そしてHMGB1放出と細胞膜の完全性の喪失によって認識される「終末段階」の3つの段階を区別し、フェロトーシス性癌細胞に対する免疫細胞応答を研究するためのツールとして確立した。フェロトーシス性癌細胞と樹状細胞(DC)を共培養することで、「初期段階」のフェロトーシス性細胞はDCの成熟を抑制し、取り込みが悪くなることで抗原のクロスプレゼンテーションを弱めることが明らかになった。フェロトーシス性癌細胞を多く含むDCは、ネクロトーシス性癌細胞とは対照的に、腫瘍の増殖を防ぐことができない。また、フェロトーシスを起こした癌細胞を免疫原性アポトーシス細胞に加えると、予防的なワクチン接種の効果は劇的に低下した。これらの結果は、フェロトーシスが抗原提示細胞および獲得免疫応答に悪影響を及ぼし、フェロトーシス誘導の治療応用に支障をきたす可能性があることを示している。 |
|
Cancer cells dying from ferroptosis impede dendritic cell-mediated anti-tumor immunity |
|
注目ポイント ・フェロトーシス細胞はDCの成熟と抗原提示能力を低下させ、抗腫瘍免疫応答を抑制する ・従来の細胞死(ネクロトーシス)と比較して、フェロトーシスによって死滅した癌細胞は免疫原性が低い ・フェロトーシスによって死滅した細胞が免疫応答を抑制するため、期待通りの治療効果が発揮されない可能性がある |
| 関連製品 |
|
|
|
|
|
|
| アプリケーションデータ |
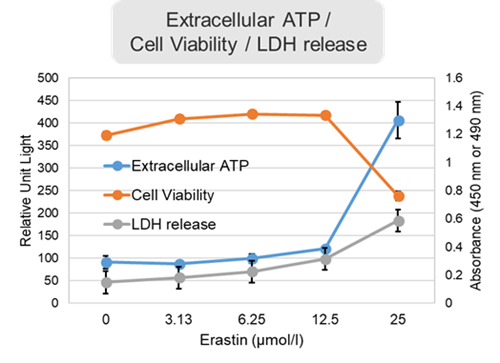
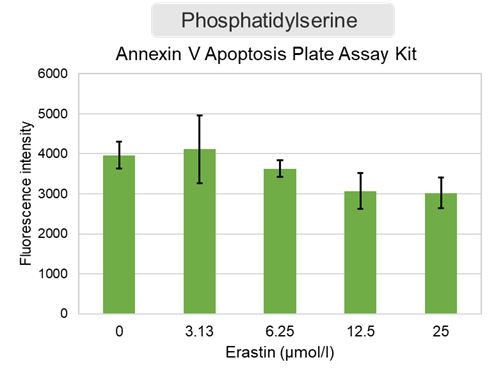
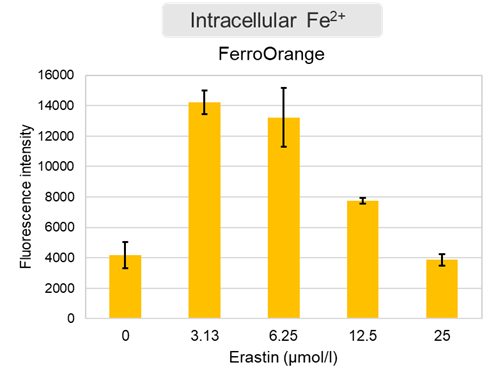
Erastin処理した細胞を用いた評価
<使用製品> |