|
近年、細胞死の一形態である「フェロトーシス(鉄依存的細胞死)」が、がん治療の新たな標的として注目されている。本研究は、リソソームに存在する鉄がフェロトーシスを開始する起点となることを明らかにした。筆者らはまず、フェロトーシス阻害剤リプロキスタチン-1(Lip-1)がリソソーム内で鉄を不活性化することで細胞を保護することを確認した。一方で、誘導剤RSL3はリソソーム膜の脂質酸化を起点としてフェロトーシスを引き起こすことが示された。さらに、リソソーム鉄を人工的に活性化する低分子「フェントマイシン-1(Fento-1)」を設計し、CD44高発現がん細胞において強力にフェロトーシスを誘導することに成功した。特にCD44を高発現する腫瘍細胞は、鉄の取り込みが増加し薬剤耐性性質を持つ一方で、リソソーム鉄を介したフェロトーシスに脆弱であることが判明した。Fento-1を用いた実験では、難治性の膵管腺癌や肉腫、さらに乳がん転移モデルにおいても腫瘍増殖が抑制された。 |
|||
|
Activation of lysosomal iron triggers ferroptosis in cancer 論文へのアクセスはこちら: T. Cañeque, et al, Nature, (2025) |
|||
|
注目ポイント ・リソソーム鉄がフェロトーシス開始の鍵であり、新規薬剤標的として注目される ・CD44高発現がん細胞は鉄取り込み能が高く薬剤耐性を示す一方で、逆にフェロトーシスに脆弱 ・Fento-1により難治性腫瘍や転移モデルで腫瘍増殖を抑制、治療戦略の可能性が拡大 |
|||
| 関連製品 | |||
|
|||
|
|||
|
|||
| アプリケーションデータ | |||
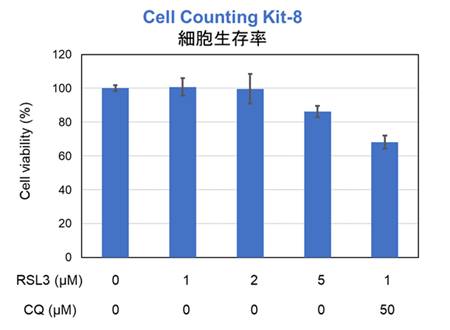
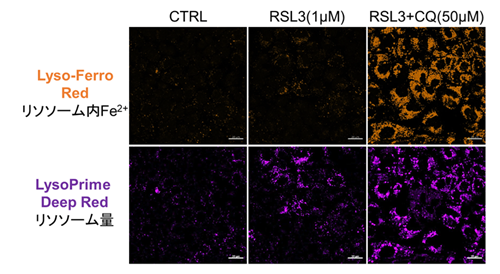
フェロトーシス誘導剤とリソソーム阻害剤の併用による各指標の変化 これまでがん細胞株間ではフェロトーシス感受性が異なることが示唆されており、フェロトーシス抵抗性のがん細胞においてリソソームのストレスを増加させることでフェロトーシスを促進できることが報告されている*。フェロトーシス抵抗性を示すがん細胞、A549細胞を用いてフェロトーシス誘導剤であるRSL3またはRSL3とリソソーム阻害剤であるChloroquine(CQ)を24時間処理し、細胞生存率、リソソーム内Fe2+、リソソーム量の変化を解析した。その結果、RSL3単独で処理した場合では細胞生存率、リソソーム内Fe2+に大きな変化はみられなかったが、一部リソソームが集積している様子(LysoPrime Deep Redの強い輝点)が観察された。一方、RSL3に加えてCQを同時に処理した細胞では、リソソーム内Fe2+の増加とリソソームの肥大化、細胞生存率が低下する既報と同様の結果が得られ、フェロトーシス促進にリソソーム内Fe2+の増加が関与している可能性が示唆された。
<使用製品> |
|||